鐵死亡相關基因的卵巢癌患者生存預測模型
李勇 廖莎
卵巢癌是常見癌癥之一,在女性惡性腫瘤中死亡率最高。許多療法可以用于治療卵巢癌,包括外科手術、化療、激素療法和放療等。由于卵巢深居盆腔,體積小,缺乏典型癥狀,難以早期發現[1]。但是,即使早期接受治療,大多數卵巢癌患者的預后仍然很差[2]。最近的研究表明,卵巢癌的發生發展涉及了許多鐵死亡相關基因功能和通路,表明鐵死亡基因可能與卵巢癌的臨床結局有關[3]。
鐵死亡是一種鐵依賴性的調節性細胞死亡,由脂質過氧化的致死性積累驅動[4]。近年來,誘發鐵死亡已成為觸發癌細胞死亡的一種治療選擇,特別是對于對傳統療法療效不好的惡性腫瘤[5-6]。除了引起鐵死亡的藥物外,許多基因也被鑒定為鐵死亡的調節劑或標志物。并且已知某些基因(例如CISD1基因的多態性)對鐵死亡具有負面調節作用[7]。越來越多的研究證明,鐵死亡基因與卵巢癌的發生發展有關[8-9]。對鐵死亡相關基因的深入了解可能會提供更準確的預后生物標志物,并可能揭示卵巢癌患者化療和免疫療法的更多新靶標。然而,目前還沒有研究探究鐵死亡相關基因是否與卵巢癌的預后有關。
本研究從公共數據庫GEO和TCGA下載了卵巢癌患者的mRNA表達譜和相應的臨床數據,通過建立Cox回歸模型,鑒定了與預后相關的9個鐵死亡相關基因。根據9個基因的表達水平,從GEO數據庫患者中構建卵巢癌預后模型,并在TCGA數據庫患者中進一步證實該模型的重要預后價值。最后,進一步探討了鐵死亡相關基因涉及的免疫相關通路和功能,以探索其潛在的機制。
資料與方法
1.資料收集:從GEO網站(https://www.ncbi.nlm.nih.gov/geo/)下載了380名卵巢癌患者的3級RNA測序(RNA-seq)數據和相應的臨床信息。基因表達譜使用R語言中的“limma” 包標準化。從TCGA網站(https://portal.gdc.cancer.gov)獲得另外377個卵巢癌患者的RNA-seq數據和臨床信息。這兩個數據庫樣本信息主要來自美國白種人群,均可公開獲得。因此,本研究不需要獲得地方倫理委員會批準。本研究遵循了GEO和TCGA的數據訪問策略和發布指南。最后,通過數據庫查找和文獻檢索檢索到60個與鐵死亡相關的基因。
2.方法:
(1)構建和驗證鐵死亡預后相關基因模型。用R語言中的“limma” 包識別腫瘤組織與癌旁正常組織之間的差異表達基因。然后進行總生存期的單變量Cox分析,以篩選與鐵死亡相關且有預后價值的基因。通過Benjamini&Hochberg(BH)校正來調整P值。使用STRING數據庫(版本11.0)構建差異基因的交互網絡。為了防止過度擬合,應用了LASSO算法的Cox回歸分析來構建預后模型。LASSO算法與“glmnet” R軟件包一起用于變量選擇和收縮。回歸中的獨立變量是候選預后差異基因的標準化表達矩陣,而響應變量是TCGA隊列中患者的總體生存率和狀態。該模型的懲罰參數(λ)通過遵循最小標準的十倍交叉驗證來確定。根據每個基因的標準化表達水平及其相應的回歸系數計算患者的風險評分。根據風險評分的中位數將患者分為高危和低危組。基于模型中基因的表達,使用“stats” R包的“prcomp”功能執行PCA。此外,使用“Rtsne” R軟件包進行t-SNE探索不同組的分布。對于每個基因的生存分析,最佳閾值由“survminer” R包裝的“surv_cutpoint”功能確定。“survivalROC” R軟件包用于進行時間依賴的ROC曲線分析,以評估模型的預測能力。
(2)功能豐富分析。將9個差異基因名導入到 WebGestalt 數據庫(http://www.webgestalt.org/),設定閾值 FDR<0.05,進行基因本體(GO)功能注釋和基于京都基因與基因組百科全書(KEGG)通路分析,分析他們涉及的功能和通路。
(3)核心基因的表達。購買卵巢癌細胞株(OC3)和正常卵巢上皮細胞株(IOSE80)(美國ATCC公司)。使用Western Blot方法檢測卵巢癌細胞中核心基因的蛋白質表達水平:先于冰上裂解細胞提取總蛋白,然后進行電泳,轉膜到PVDF膜上,在5%的脫脂牛奶上封閉,加入一抗,在4度冰箱中孵育過夜,TBST洗膜,加入二抗,化學發光法拍攝。
(4)統計分析。使用Student′st檢驗比較腫瘤組織和癌旁正常組織之間的基因表達。通過Kaplan-Meier分析和對數秩檢驗比較不同組之間的總生存期。進行單因素和多因素Cox回歸分析以識別預后的獨立預測因子。所有統計分析均使用R軟件(版本3.6.3)進行。P<0.05為具有統計學意義。
結果
1.臨床特征:研究流程圖如圖1所示。納入了GEO數據庫的380名卵巢癌患者、TCGA數據庫的377名卵巢癌患者和GTEx數據庫的正常患者。患者的詳細臨床特征見表1。
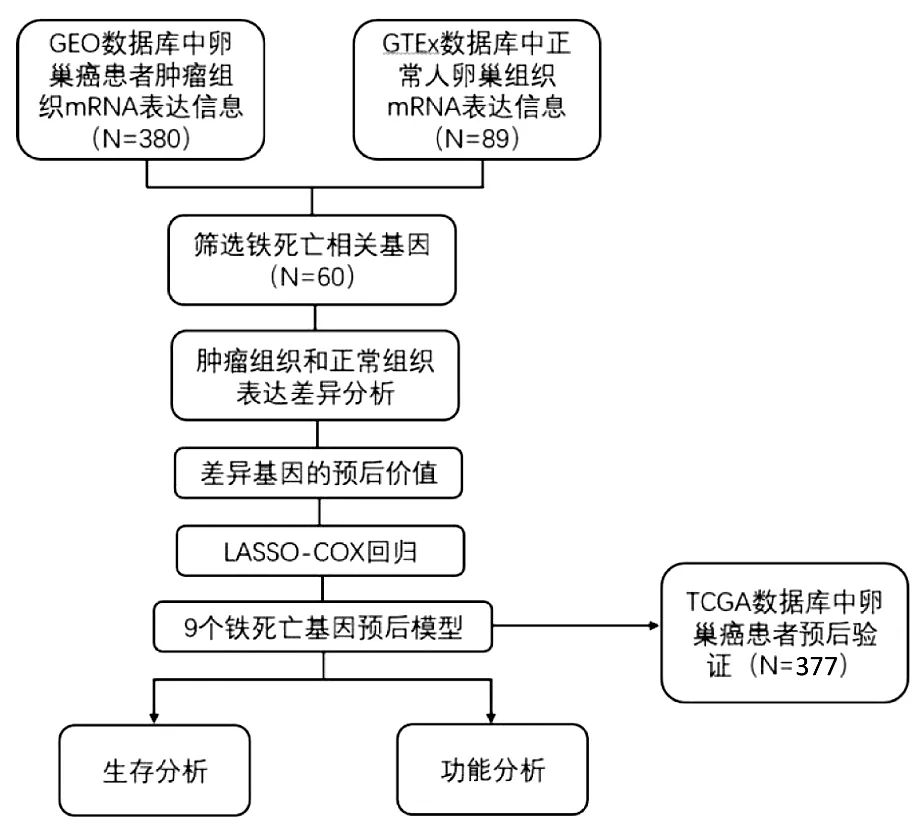
圖1 流程圖

表1 GEO數據庫和TCGA數據庫中卵巢癌患者的臨床特征[例(%)]
2.在GEO隊列中鑒定與預后相關的鐵死亡差異基因:大多數與鐵死亡相關的基因(45/60,75%)在腫瘤組織和癌旁正常組織之間差異表達(圖2-a),在單變量Cox回歸分析中,其中有9個(AKR1C2、AKR1C3、GCLM、NCOA4、SAT1、SLC7A11、ZEB1、NOX1、G6PD)與總生存期相關,AKR1C2、AKR1C3、ZEB1、NOX1與不良預后相關(圖2-b)。這些基因之間的相互作用網絡表明,GCLM、G6PD、AKR1C3、AKR1C2和SLC7A11是核心基因(圖3)。這些基因之間的相關性如圖4所示。

圖2 與總生存期相關的9個預后基因森林圖

圖3 與鐵死亡相關的9個預后基因相互作用圖

圖4 與鐵死亡相關的9個基因相關性圖
3.GEO隊列中預后模型的構建:使用上述9個基因的表達譜,應用LASSO-Cox回歸分析來建立預后模型。根據中位臨界值將患者分為高危組(n =190)或低危組(n=190)(圖5-a)。PCA和t-SNE分析表明,不同風險組的患者分布在兩個方向(圖5-b、圖5-c)。如圖5-d所示,高風險患者比低風險患者有更低的生存時間。同樣的,Kaplan-Meier曲線表明,高危組的患者的總生存時間明顯低于低危組(圖5-e)。總生存時間風險評分的預測性能通過時間依賴性ROC曲線進行評估,1年生存時間的曲線下面積(AUC)為0.842,2年為0.819,3年為0.831(圖5-f)。
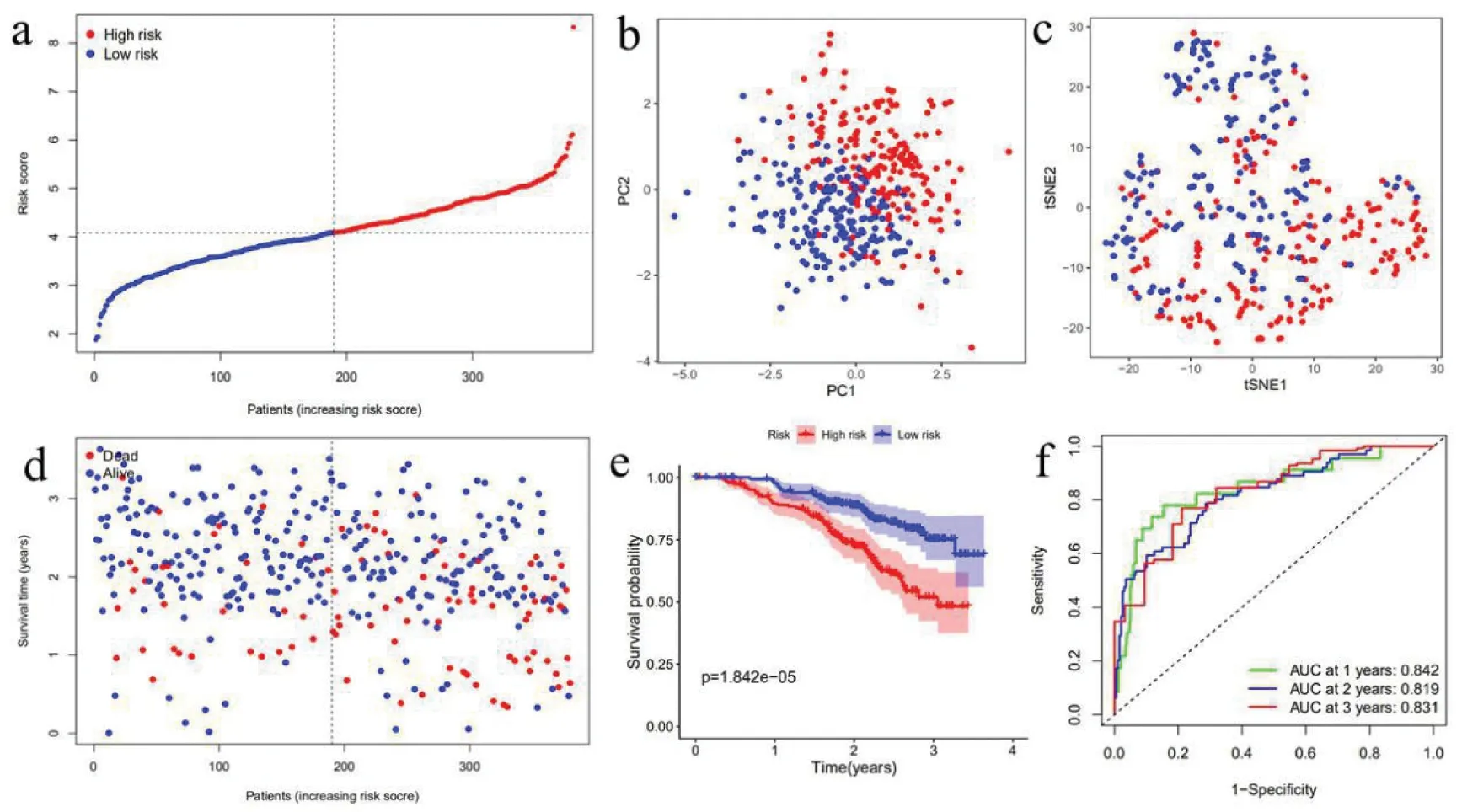
圖5 根據GEO隊列建立預后模型
4.TCGA隊列驗證基因模型:驗證GEO隊列構建的模型魯棒性,TCGA隊列的患者也按照與GEO隊列相同的方法分為高危組或低危組(圖6-a)。結果與GEO隊列相似,PCA和t-SNE分析證實了兩個亞組中的患者分布在離散的方向上不同(圖6-b、圖6-c)。同樣,與低危組相比,高危組患者更有可能更早死亡(圖6-d),并且生存時間縮短(圖6e)。此外,由9個基因建立的模型預測死亡率的AUC也是較高的,在1年時為0.74,在2年時為0.73,在3年時為0.68(圖6f)。
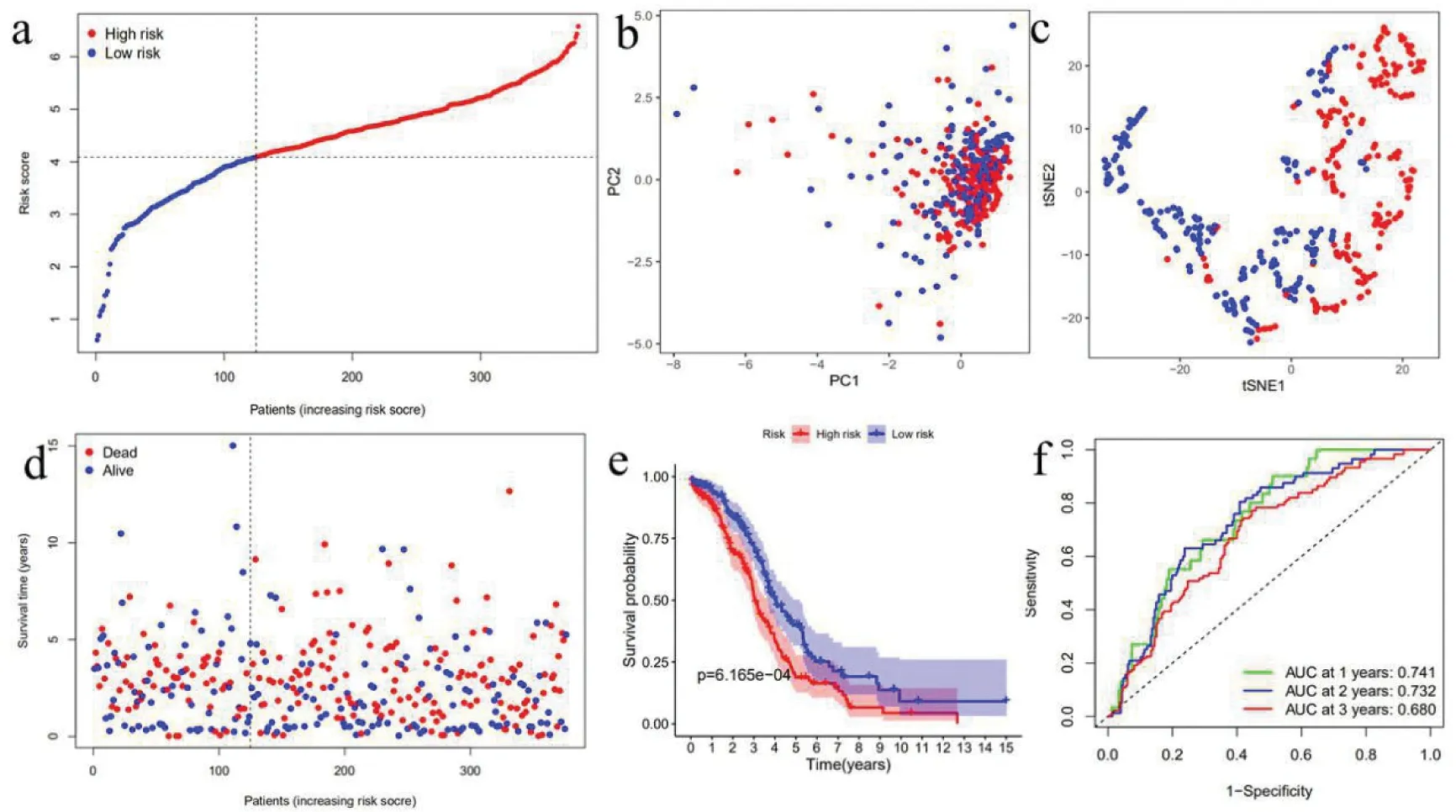
圖6 根據TCGA隊列驗證預后模型
5.GEO和TCGA隊列中的功能分析:為了闡明與風險評分相關的生物學功能和途徑,使用高風險和低風險組之間的9個差異基因進行GO富集和KEGG途徑分析。圖7-a表示了GO富集分析,紅色,藍色和綠色的條形表示生物過程,細胞成分和分子功能類別。條形圖的高度表示類別中注釋基因重疊的基因數。結果顯示,差異基因富含多種與鐵有關和免疫相關的生物過程和分子功能,生物過程例如細胞代謝的調控、多細胞生物過程、細胞發育過程、對刺激的翻譯等,細胞成分主要位于胞質和細胞核,分子功能例如離子結合、轉運、酶活性調節等(圖7-a)。KEGG通路分析還表明,這9個差異基因富集了蛋白聚糖在癌癥中、內質網中蛋白質加工、Th17細胞分化、小細胞肺癌、Th1和Th2細胞分化、脂肪細胞因子、基底細胞癌等和癌癥、免疫、細胞因子相關的通路(圖7-b)。

圖7 GO功能和KEGG途徑分析
6.核心基因的表達分析:5個核心基因在卵巢癌細胞(OC3)中的表達與之前生物信息學挖掘數據庫分析的情況一致。與正常卵巢上皮細胞(IOSE80)相比,GCLM、G6PD基因的表達在卵巢癌細胞中上調,AKR1C3、AKR1C2和SLC7A11基因的表達在卵巢癌細胞中下調(圖8)。
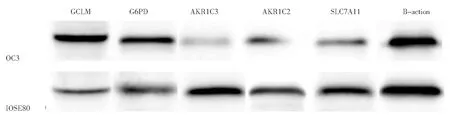
圖8 核心基因在卵巢癌細胞中的表達
討論
本研究系統地研究了60種與鐵死亡相關的基因在卵巢癌組織中的表達及其與總生存期的關系。首先建立了一個整合了9個與鐵死亡相關基因的新型預后模型,并用外部數據對其進行了驗證。功能分析表明,這些基因涉及了豐富的癌癥、免疫、細胞因子相關通路。Western Blot實驗也表明;核心基因在卵巢癌中的表達與之前分析的情況大致相同。
盡管先前的一些研究表明,幾種基因可能在卵巢癌中引起鐵死亡,但它們與卵巢癌患者總生存期的相關性仍然未知。在本研究中,大多數與鐵死亡相關的基因在腫瘤和癌旁組織之間有差異表達,在單變量Cox回歸分析中,超過一半與OS相關。這些結果顯著表明了鐵死亡在卵巢癌中的潛在作用,以及用這些與鐵死亡相關基因建立預后模型的可能性。
本研究中建立的預后模型由9個與鐵死亡相關的基因(AKR1C2、AKR1C3、GCLM、NCOA4、SAT1、SLC7A11、ZEB1、NOX1、G6PD)組成。這些基因可大致分為四類,包括鐵代謝(NCOA4),脂質代謝(AKR1C2、AKR1C3、ZEB1),抗氧化劑代謝(GCLM、SLC7A11、NOX1)和能量代謝(G6PD,SAT1)[10]。NCOA4是核受體共激活子4,能夠介導鐵蛋白吞噬,敲除可以抑制由氨基酸或胱氨酸減少引起的鐵死亡,還能抑制雌激素引起的鐵死亡[11-12]。AKR1C是醛糖酮還原酶家族1成員C1,能夠調節氧化脂質分解產物的降解,能上調表達來抗雌激素引起的鐵死亡[13]。ZEB1鋅指E-盒結合同源異形盒,是EMT調節劑和生脂因子,敲除后可以抑制GPX4減少引起的鐵死亡[14]。GCLM也能通過調節氧化作用抑制鐵死亡[15]。SLC7A11是溶質載體家族7成員11,是Xc-系統的亞基,可以將胱氨酸導入細胞,能抑制鐵死亡[16]。NOX1是NADPH氧化酶超氧化物,能抑制非小細胞肺癌細胞中蛋白素誘導的鐵死亡[16]。G6PD和SAT1是兩個參與能量代謝的鐵銹調節劑[16-18]。據報道G6PD參與磷酸戊糖途徑,敲除后能抑制非小細胞肺癌細胞里雌激素引起的鐵死亡。這些基因是否通過影響鐵死亡的過程而在卵巢癌患者的預后中發揮作用還有待進一步闡明。
腫瘤免疫與鐵死亡之間潛在的調控機制仍未得到闡明,本研究根據不同風險組之間的差異基因進行了KEGG途徑和GO功能富集分析,結果發現許多與癌癥、免疫、細胞因子相關的生物過程和途徑被富集。因此,有理由認為鐵死亡可能與腫瘤免疫有密切聯系。
本研究有幾個局限性。首先,預后模型是利用公共數據庫的回顧性數據構建和驗證,還需要更多的前瞻性數據用以驗證其臨床效用。其次,本研究僅納入鐵死亡相關模型建立預后模型,難以避免混雜因素,因為卵巢癌中還有許多突變的預后基因可能被排除在外。未來將開展進一步的實驗來驗證鐵死亡基因與腫瘤免疫之間的關系。
綜上所述,本研究建立了一個鐵死亡相關基因的新型預后模型。該模型在GEO數據庫和TCGA數據庫中均被證明與預后獨立相關。今后將進一步研究卵巢癌中鐵死亡相關基因和腫瘤免疫之間的潛在機制,為卵巢癌的治療和預測預后提供新的思路。

