人參地微桿菌S4的發酵條件優化及其鹽堿脅迫下對水稻幼苗的促生作用
齊玉璽,張琇*,楊國平,3,朱娟娟,沈婷婷,季鴻飛,吳凱華
人參地微桿菌S4的發酵條件優化及其鹽堿脅迫下對水稻幼苗的促生作用
齊玉璽1,2,張琇1,2*,楊國平1,2,3,朱娟娟1,沈婷婷1,2,季鴻飛1,2,吳凱華1,2
1. 北方民族大學生物科學與工程學院, 寧夏 銀川 750021 2. 寧夏特殊生境微生物資源開發與利用重點實驗室, 寧夏 銀川 750021 3. 寧夏五豐農業科技有限公司, 寧夏 銀川 750021
自然界存在著可促進作物耐鹽堿的菌株,為獲得可提高水稻適應于鹽堿地種植的生物菌劑,本研究以人參地微桿菌S4(S4)為對象,采用搖瓶發酵優化的方式,設計單因素與正交實驗,研究碳源、氮源、無機鹽組分及pH、溫度、轉速、接種量對S4發酵的影響;將發酵優化后條件在5 L發酵罐中進行小試試驗;測定水培14 d后不同處理下水稻幼苗的生理指標。實驗結果表明,該菌株最適生長培養基為蔗糖0.7%、酵母浸出粉1.2%、MgSO40.2%,最適起始pH值為8,最適生長溫度為24 ℃,最佳接種量為5%,最佳轉速為220 r/min。小試發酵優化后比優化前菌體生長量提高了7.09倍。S4菌液浸種后對鹽堿脅迫下的水稻有明顯的促生作用,株高、鮮重及SOD、CAT、POD、Pro顯著提高,而MDA含量顯著降低。研究結果可為S4菌的規模化生產和應用奠定基礎。
人參地微桿菌; 發酵優化; 水稻; 促生作用
土壤鹽漬化是一個全球性的環境問題,鹽堿土的年增長率約為1.0×106~1.5×106hm2[1]。土壤鹽漬化會抑制植物的光合作用、影響相關酶活性及代謝途徑使作物產量減少[2-4]。目前,我國鹽堿地所占面積約為3.6×107hm2,占我國耕地總面積的4.88%[5],鹽堿地利用極其困難,合理開發利用鹽堿地,對于提高我國農業生產力具有重要意義[6,7]。
中國是世界最大的水稻生產國和消費國[8]。水稻是可以種植在鹽堿地的先鋒作物,但是在鹽堿地生長會降低水稻產量和品質[9,10]。許多研究表明,促進植物生長的根際細菌(Plant growth promoting rhizobacteria,PGPR)可以誘導植物建立抗鹽堿或耐鹽堿機制,提高植物在鹽堿脅迫下的生存能力[2,3]。PGPR已成為土壤微生物學研究的熱點,也是生態學和植物抗逆性研究的熱點之一[11],但促進水稻耐鹽堿的菌源較少,有關水稻耐鹽堿促生菌的發酵優化及其性能鑒定研究鮮有報道。
本研究將人參地微桿菌S4菌進行發酵條件優化,并在5 L自動發酵罐中進行小試試驗驗證,初步研究S4菌浸種后對鹽堿脅迫下水稻的促生效應,旨在為鹽堿地改良提供優良菌源。
1 材料與方法
1.1 材料
1.1.1 菌種 人參地微桿菌()S4保藏于寧夏特殊生境微生物資源開發與利用重點實驗室。
水稻種子:品種寧粳51號。
1.1.2 基礎培養基 蛋白胨10.0 g,NaCl 5.0 g,牛肉膏3.0 g,蒸餾水1000 mL,pH 7.2[12]。
LB培養基:胰蛋白胨10 g/L,酵母浸粉5 g/L,NaCl 10 g/L,pH 7.2。
植物營養液:常規植物營養液為1000 mL蒸餾水中加入各種母液1 mL,高壓滅菌20 min;鹽堿脅迫營養液為常規植物營養液加200 mmol NaCl,用飽和Na2CO3溶液調至pH 8.5。蘇州科銘生物技術有限公司試劑盒。
1.2 主要儀器
TGL-20M高速冷凍離心機;UV-1000天美紫外可見分光光度計;JLRX-800B-FB植物培養箱;MRS-9600TFU2L根系掃描儀;G-9S雙光束掃描型紫外分光光度計。
1.3 實驗方法
1.3.1 菌體生長測定 通過全波長掃描確定菌體最大吸光度,將待測發酵液離心后棄上清加入等體積蒸餾水,蒸餾水調零,測定吸光度,分析菌體生長情況,通過平板計數法測定菌數[13,14]。
1.3.2 母液配制 將保存在平板的菌株活化后,將其置于LB培養基中,生長條件為37 ℃、200 r/min,培養周期18 h,置于4 ℃冰箱,備用。
1.3.3 單因素培養基優化實驗 培養基pH值為7.2,接種量為3%,在30 ℃和200 r/min培養18 h。碳源:添加0.3%的牛肉膏、半乳糖、麥芽糖、蔗糖、可溶性淀粉、木糖,空白對照(無碳源)[15],將菌懸液進行離心稀釋后測定OD400時該菌的吸光度,選出最適碳源后,按照0.2%、0.3%、0.4%、0.5%、0.6%、0.7%添加量,選出最佳碳源濃度;氮源:添加1%尿素、氯化銨、蛋白胨、酵母浸粉、胰蛋白胨、硝酸鉀、硫酸銨,空白對照(無氮源)[16],將菌懸液進行離心稀釋后測定OD400時該菌的吸光度,得出最佳氮源,按照0.4%、0.6%、0.8%、1.0%、1.2%、1.4%添加量,選出最佳氮源濃度;無機鹽:添加0.5%的NaCl、MgSO4、K2SO4、CoCl2、MnCl2,空白對照(不添加無機鹽),將菌懸液進行離心稀釋后測定OD400處該菌的吸光度,找出對菌生長效果最佳的無機鹽后,按照0%、0.1%、0.2%添加量,選出最佳無機鹽濃度。
1.3.4 培養基的正交實驗在單因素實驗的基礎上,將該菌OD值作為判斷依據。研究碳源、氮源及其無機鹽對S4菌生長的作用。采取3因素3水平L9 (34)的正交實驗得出最適合S4菌株生長培養基的組合。
1.3.5 生長條件優化單因素實驗 以培養基優化為基礎,研究接種量、培養溫度、pH和轉速對該菌生長的影響。
1.3.6 生長條件優化正交實驗 以單因素實驗為基礎,研究了接種量、pH、培養溫度、轉速等因素對S4菌生長的影響。采用4因素3水平L9(34)進行正交實驗。
1.3.7 小試發酵 用發酵罐培養進一步進行驗證搖瓶優化結果,將正交優化所得最佳發酵培養條件和優化前的發酵培養條件進行5 L自動發酵罐小試試驗,每隔3 h記錄菌株的生長情況,將該菌株在優化前后的生長情況進行對比分析。優化前培養條件為基礎培養基、溫度30 ℃、pH為7.2,接種量3%。
1.3.8 水稻幼苗的生理指標測定 本次實驗設置2個處理:鹽堿對照組:無S4菌浸種,鹽堿脅迫植物營養液;鹽堿加菌浸種組:S4菌浸種,鹽堿脅迫植物營養液(S4菌浸種方法為1×108cfu/mL菌懸液浸種)。將2個處理所需的種子在55 ℃水浴鍋浸種15 min,用酒精去除表面張力10 s,0.1%升汞進行表面消毒30 s,無菌水清洗6次,消毒完成后對種子進行不同處理,將不同處理的種子擺放于水瓊脂,待其發芽后移到滅菌的塑料瓶,塑料瓶中有300 g石子,60 mL不同處理的植物營養液,放入植物光照培養箱培養14 d后測定不同處理下水稻根長、株高,將樣品液氮保存后存放于-80 ℃超低溫冰箱備用,用蘇州科銘試劑公司試劑盒測定水稻幼苗根部的超氧化物歧化酶(Superoxide Dismutase,SOD)、過氧化物酶(Peroxidase,POD)、過氧化氫酶(Catalase,CAT)、脯氨酸(Pro)、丙二醛(malondialdehyde,MDA)。
2 結果與分析
2.1 單因素培養基優化結果
2.1.1 碳源對菌株生長的影響 根據圖1(a)可得,蔗糖最有利于菌體生長,空白組中菌株生長量最低,實驗得出蔗糖為最適合其生長的碳源。(b)圖表明,當蔗糖添加量為0.5%時,菌株的生長最好。
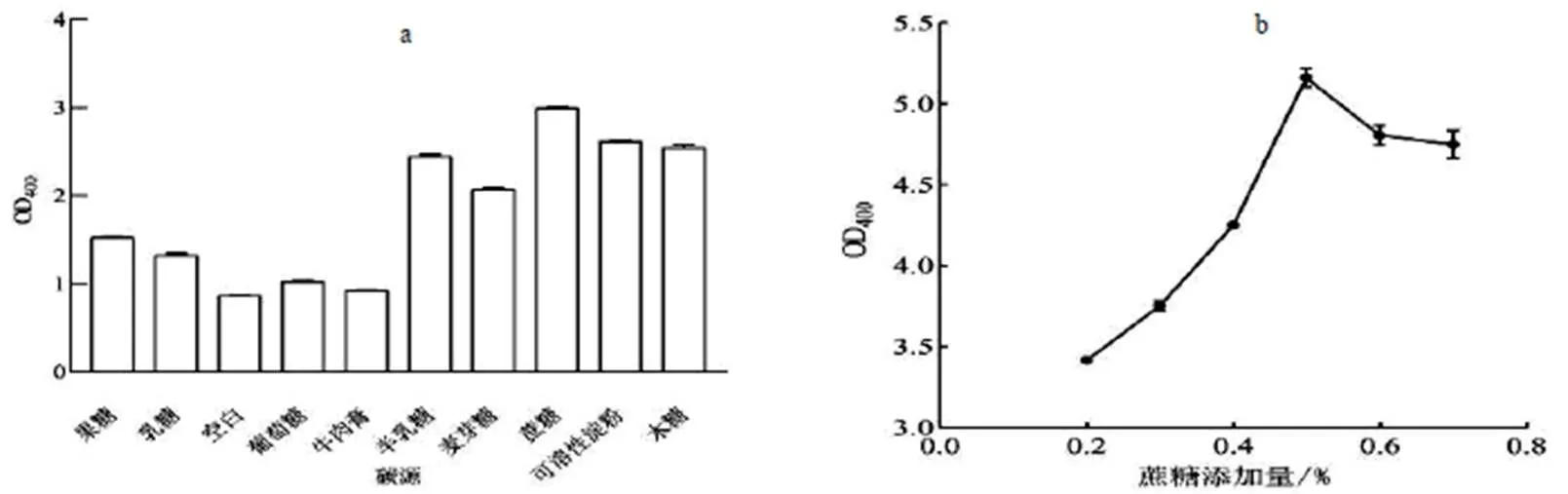
圖1 最佳碳源及其濃度的確定
2.1.2 氮源對菌株生長情況的影響 圖2 (a)表示在該菌株的生長期間,使用不同的氮源等量替換基礎培養基的氮源,該菌的生長情況。酵母浸粉為氮源時明顯優于其他氮源和空白組。圖2(b)結果表明,當最適氮源酵母浸粉為培養基中氮源時,其氮源添加量對該菌生長的作用。其添加量1.2%時,菌株生長最好。
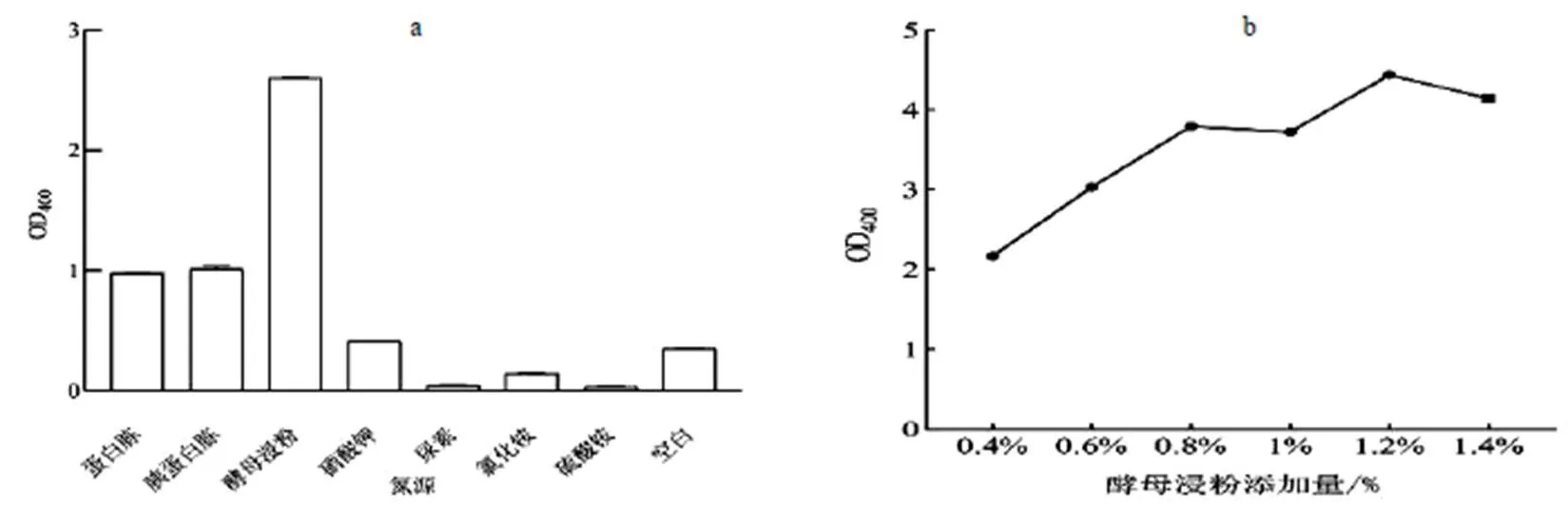
圖2 最佳氮源及其濃度的確定
2.1.3 無機鹽對菌株生長的影響 由圖3可以看出,沒有添加無機鹽的培養基與添加MgSO4的培養基菌體生長情況好于加入NaCl、K2SO4、CoCl2、MnCl2的培養基。將MgSO4添加量0%、0.1%、0.2%作為正交實驗的因素。
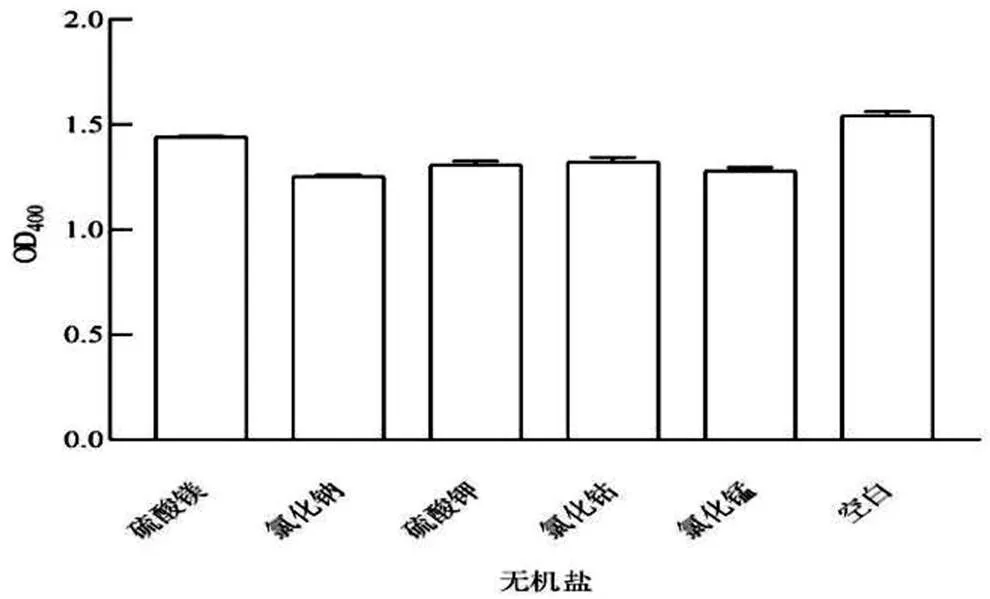
圖3 最佳無機鹽及其濃度的確定
2.2 最佳培養基的確定
以菌體OD值為生長指標,研究了碳源、氮源及無機鹽對細菌生長的作用。采用三因素三水平L9(34)正交實驗得到該菌培養基的最佳組合。正交實驗因素水平如表1所顯。
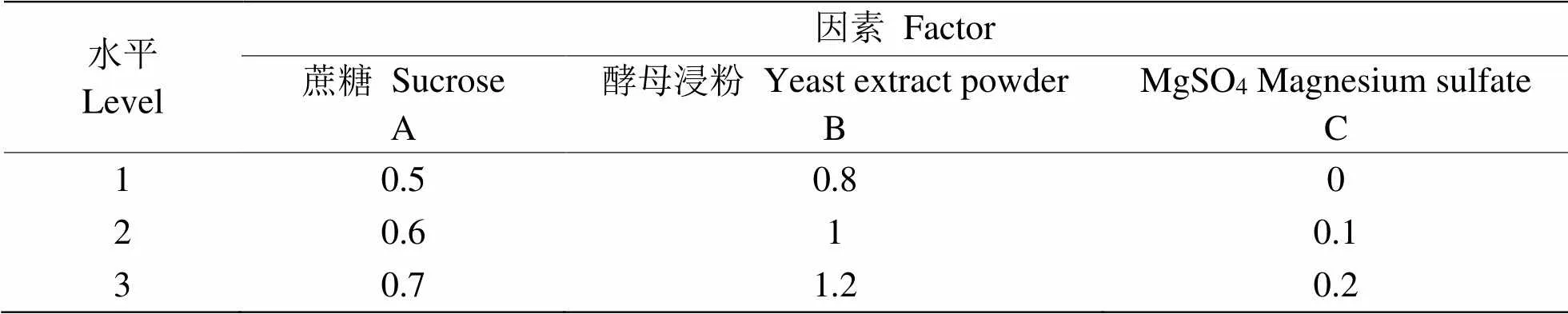
表1 L9(34)正交實驗因素水平表
2.2.1 生長條件優化的正交實驗結果 S4菌生長情況如表2所示。
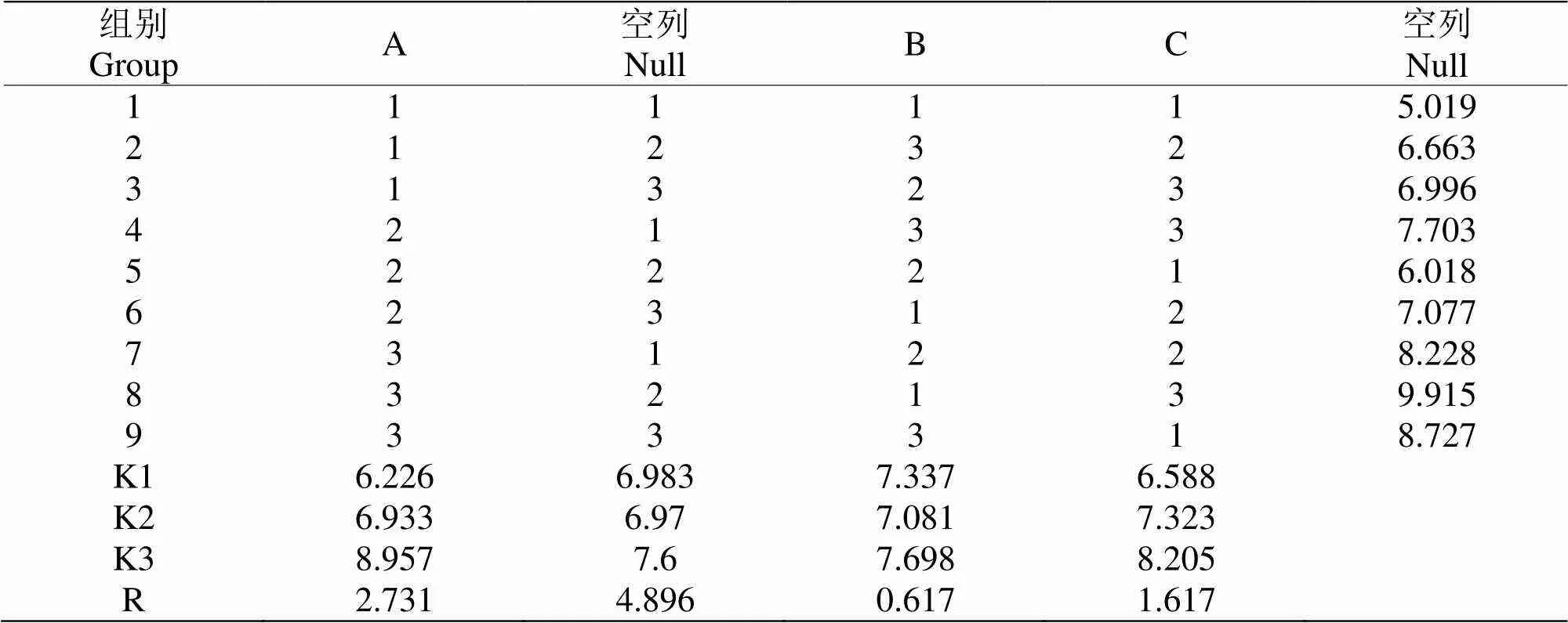
表 2 L9(34 )正交實驗設計及結果
由表2得出,極差值大小排序為A>C>B,故對S4菌體生長的影響因素蔗糖>MgSO4>酵母浸粉。通過圖表分析,A3 B3 C3的實驗組合為最佳方案。
2.2.2 培養基優化的驗證實驗 將正交優化所得到的最佳組合A3 B3 C3與實驗過程中生長情況最好的組合A3 B1 C3進行3次重復實驗,對正交結果進行驗證,A3 B3 C3的菌濃度比A3 B1 C3提升了6×108cfu/mL。驗證結果與正交實驗結果相符合,故S4菌的最佳培養基配方為蔗糖0.7%,酵母浸粉1.2%,MgSO40.2%。
2.3 優化培養條件的單因素實驗結果
2.3.1 pH值對S4菌生長的影響 以培養基正交優化得到的結果為基礎,施加適量1 mol/L NaOH和1 mol/L HCl調至培養基pH為5.0、6.0、7.0、8.0、9.0和10,接種體積3%,30 ℃,200 r/min,培養18 h,用UV光譜儀進行細菌計數。如圖4所顯,在酸性和堿性環境中,不利于菌體生長。當pH值為8時,菌體生長情況最佳。
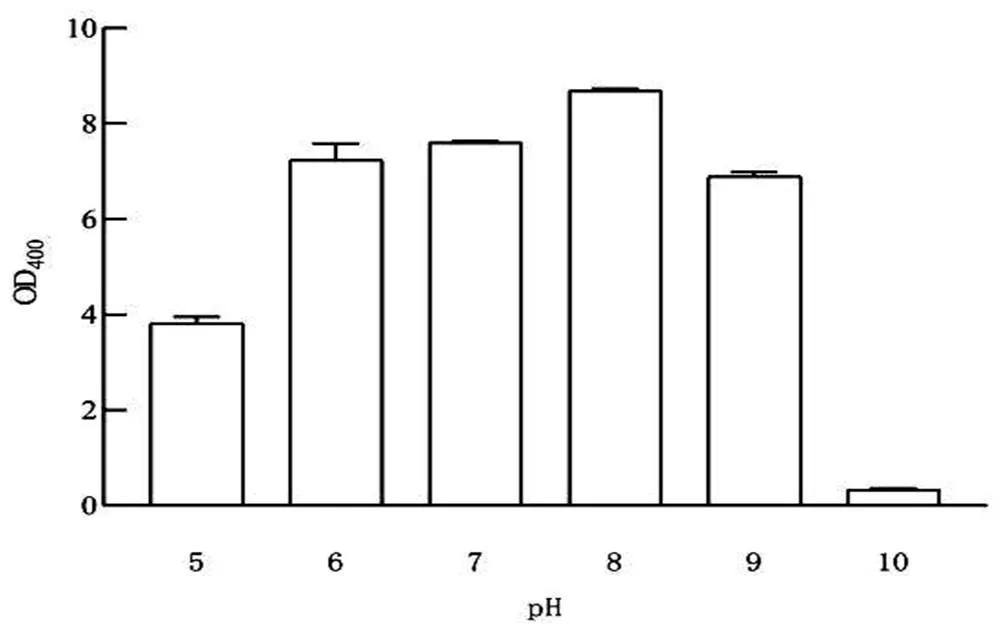
圖4 pH值S4菌生長的影響
2.3.2 S4菌在不同溫度下的生長情況 由2.3.1所得,培養基的pH值為8,轉速為200 r/min,放置于15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃的搖床培養18 h,紫外分光光度法測菌體數量,生長情況如圖5所顯。通過分析圖5得出,伴隨培養條件溫度升高,該菌數量增加,可是超過25 ℃溫度后,該菌數量減少。培養條件25 ℃時,菌體生長情況最好。
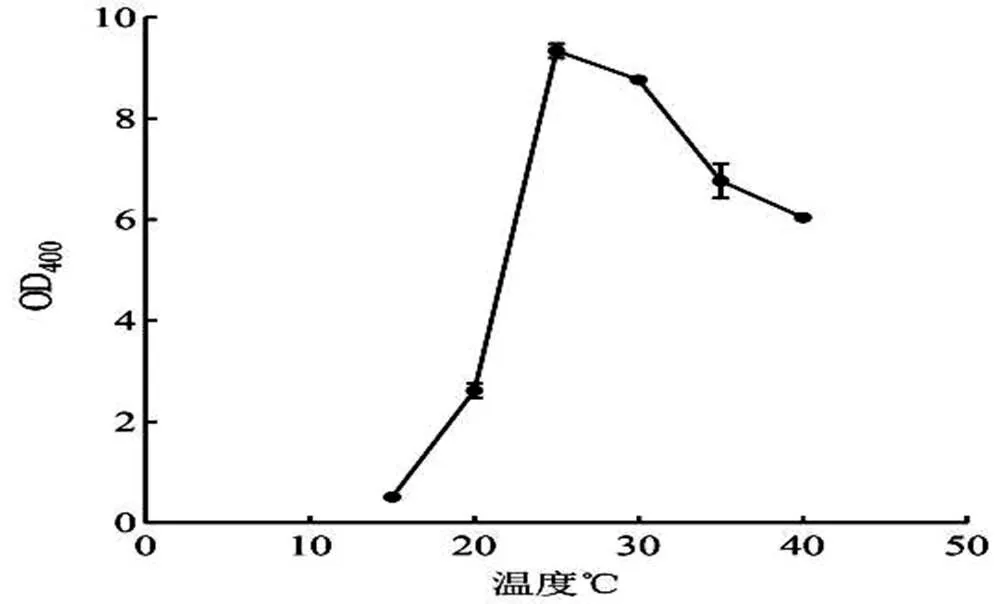
圖5 溫度對S4菌生長的影響
2.3.3 不同轉速對S4菌影響 以2.3.1和2.3.2的實驗所得為基礎,觀察菌株在轉速為120 r/min、140 r/min、160 r/min、180 r/min、200 r/min、220 r/min條件下的生長情況,紫外分光光度法測定菌OD值,生長情況見圖6。由圖6可以看出,轉速設置為200 r/min時,菌株生長情況最好。
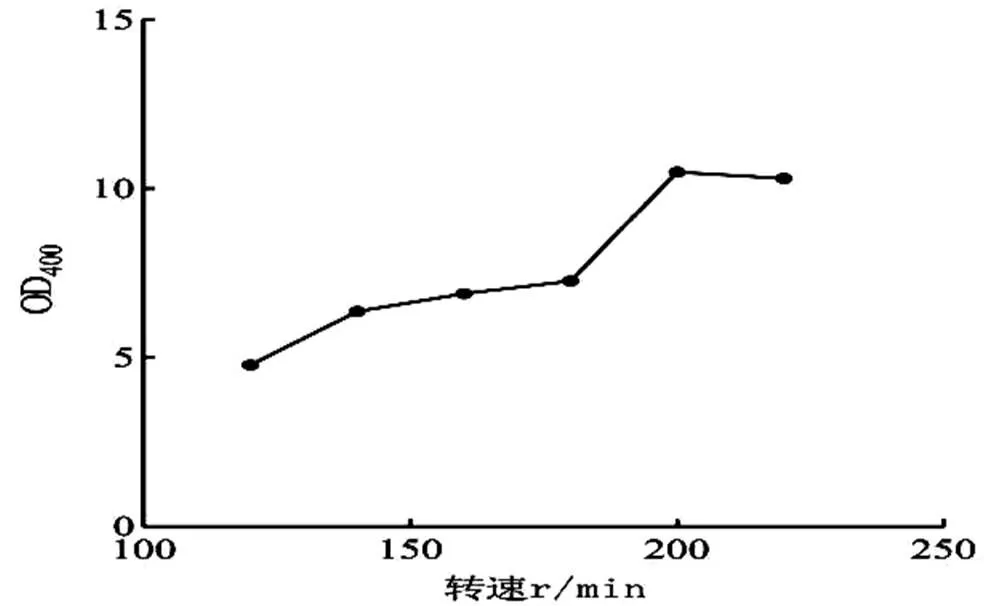
圖6 轉速對S4菌生長的影響
2.3.4 不同接種量對S4菌影響 以2.3.1、2.3.2和2.3.3的實驗為基礎,調至培養基pH值為8.0,搖床培養條件25 ℃,200 r/min,種子液按照接種量為2%、4%、6%、8%、10%和12%加入至優化完成后的培養基中,培養24 h。生長情況見圖7。如圖7所示,在某一范圍下S4菌是伴隨接種量的提高,生長量也隨之提高。該菌株接種量4%時,菌株的生長量最高,接種量超過4%影響菌體生長。
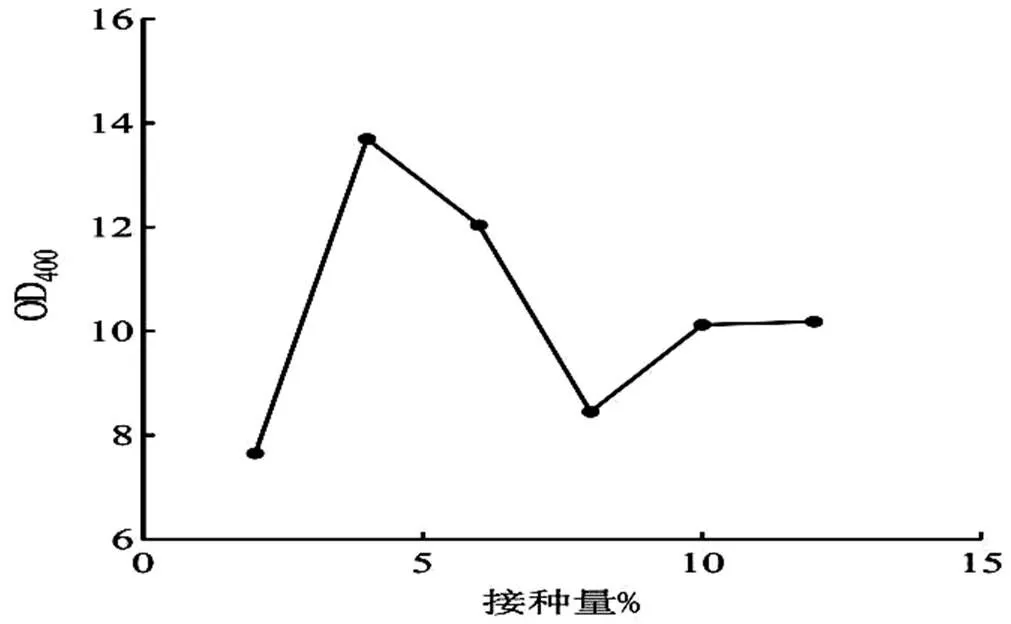
圖7 接種量對S4菌生長的影響
2.4 生長條件優化的正交實驗 根據以上單因素實驗數據所得,以該菌的OD值為評價指標,研究了接種量、pH值、轉速和溫度對S4菌株生長的影響。根據四因素三水平L9(34)正交實驗研究,得到了菌株最佳培養條件。正交實驗的因素水平和實驗所得結果見表3和表4。
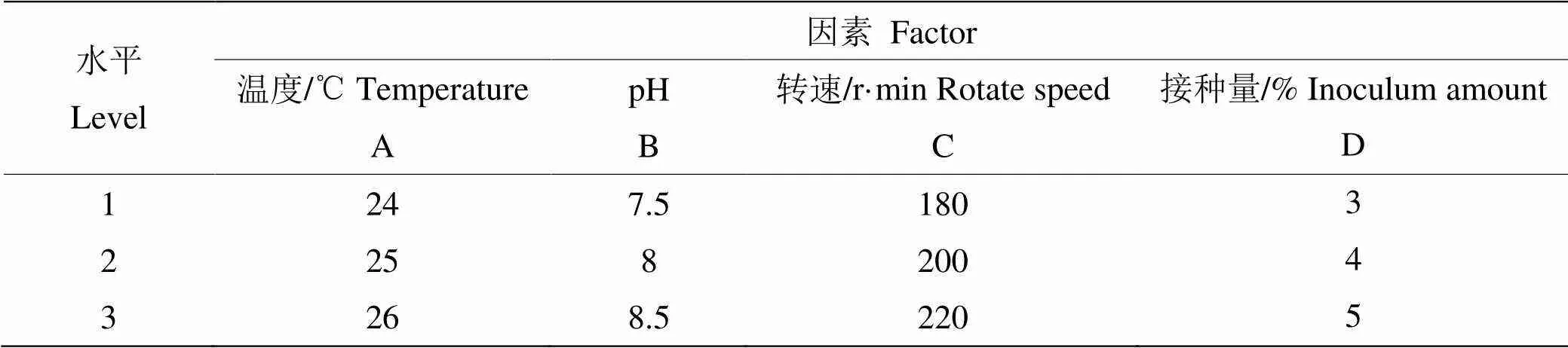
表3 L9(34 )正交實驗因素水平表
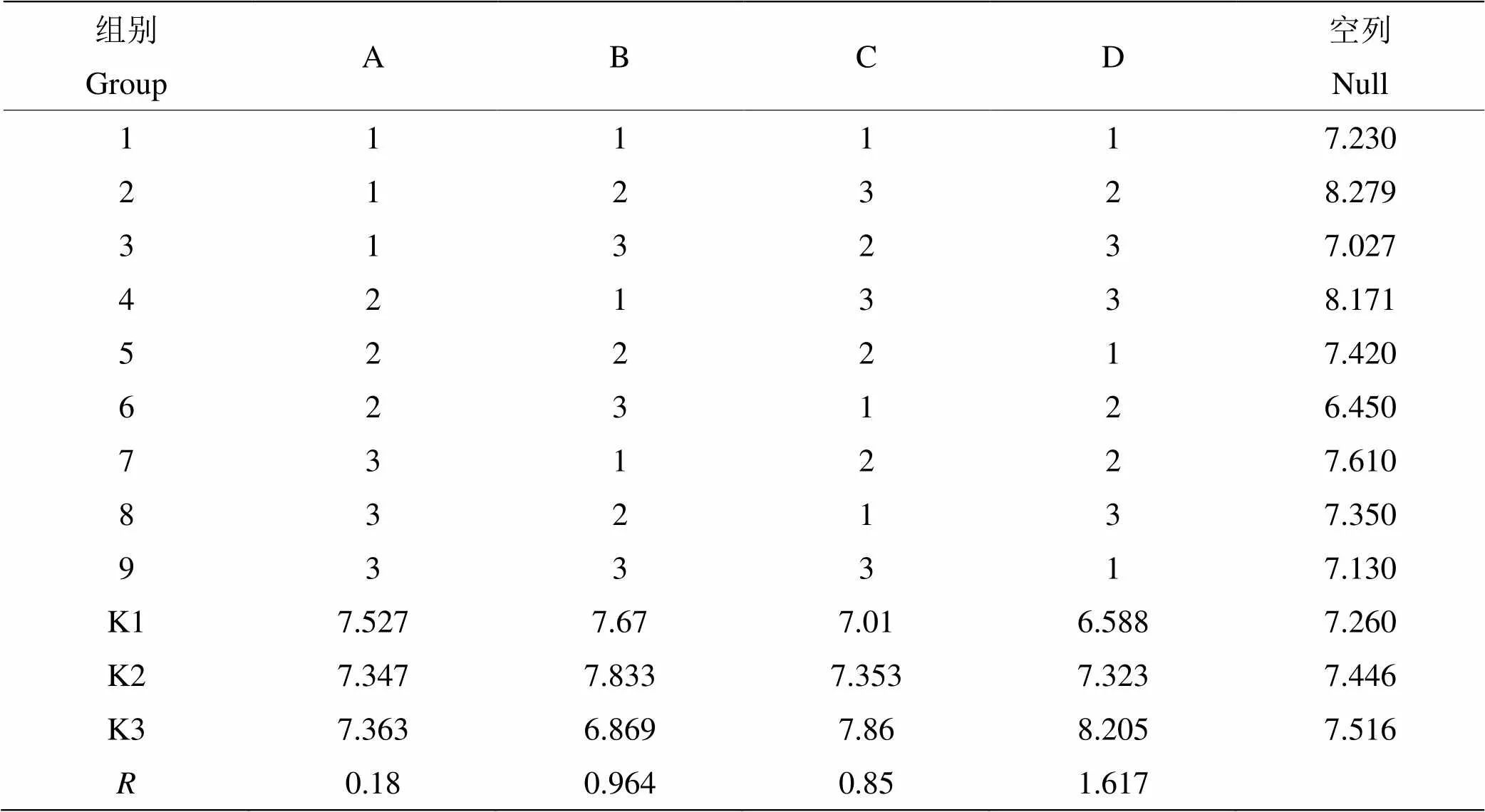
表4 L9(34 )正交實驗設計及結果
將正交優化所得到的最佳組合A1 B2 C3 D3與實驗過程中生長情況最好的組合A1 B2 C3 D2 及初始發酵條件進行3次重復實驗后進行結果驗證,組合A1 B2 C3 D3的菌濃度達到3.7×109cfu/mL優于組合A1 B2 C3 D2,并相較于初始發酵條件下菌體濃度3.44×108cfu/mL提高了10.76倍。實驗結果與正交實驗推斷相符合,得出S4菌生長的最佳發酵條件為pH值8,溫度24 ℃,轉速220 r/min,接種量5%。
2.5 生長曲線的測定
將菌株在最適條件進行培養,間隔3 h取樣,離心后棄掉上清液,使用蒸餾水稀釋,測定菌株在400 nm處的OD值,記錄生長曲線。圖8可見,培養9 h后進入對數生長期,21 h后進入穩定期,36 h后進入菌的衰亡期。
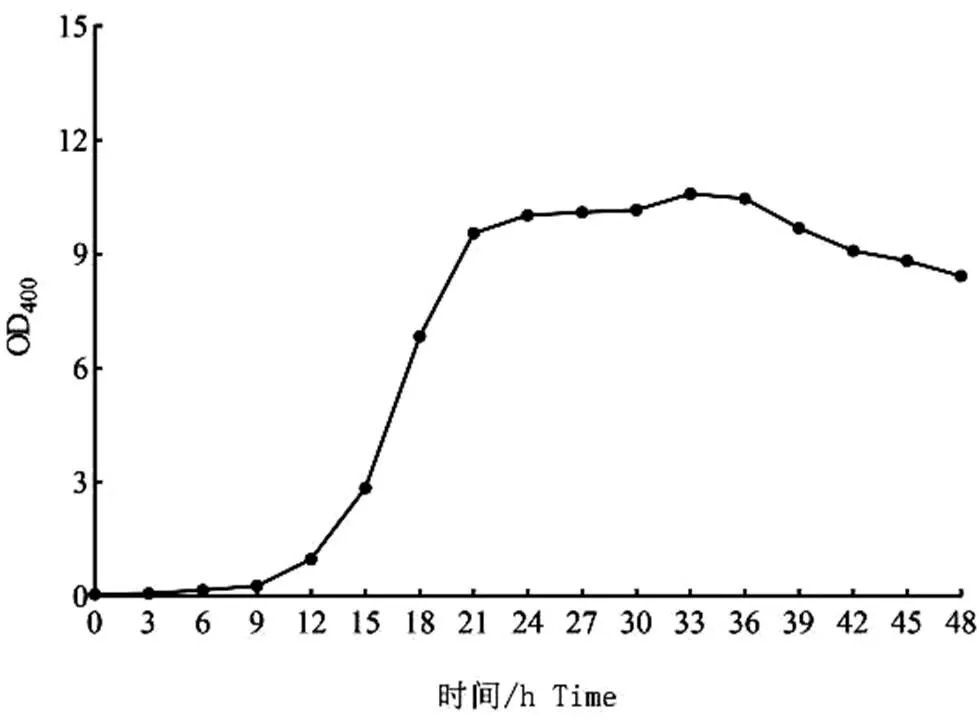
圖8 菌株生長曲線
2.6 小試發酵試驗
通過圖9可看出,S4菌在優化后的培養條件中培養,菌體生長量明顯高于在優化前培養條件中的生長量,利用5 L自動發酵罐進行試驗,試驗結果與搖瓶實驗結果基本一致,較優化前菌體生長量提高了7.09倍,且在5 L發酵罐中培養的S4菌的生長量高于搖瓶發酵的生長量。
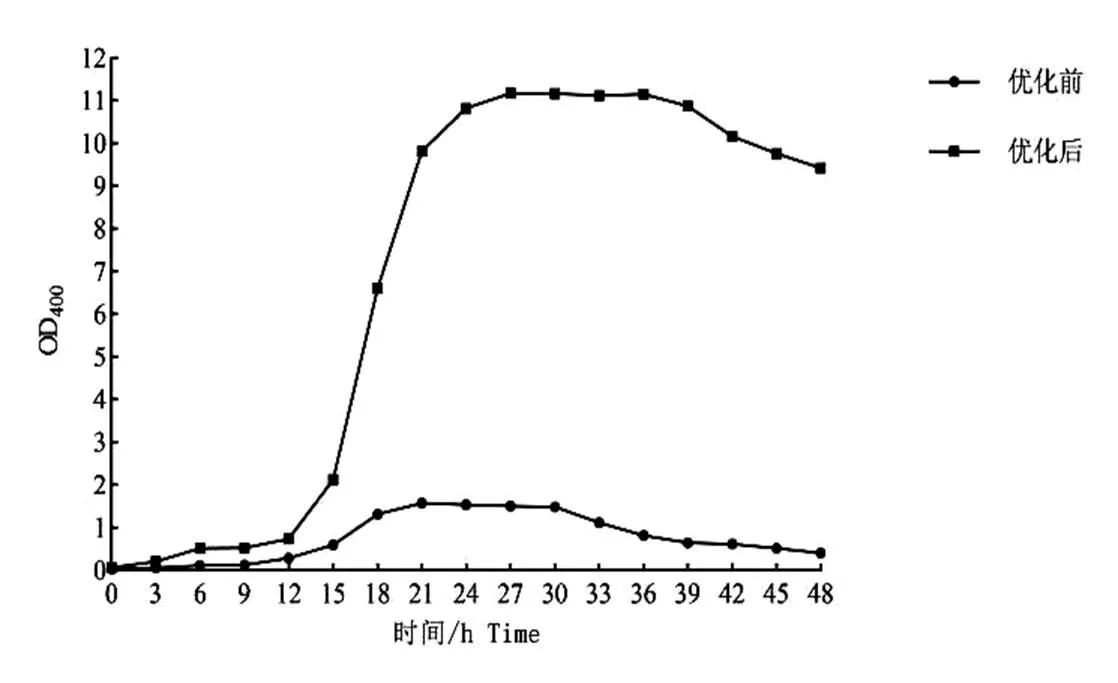
圖9 5L自動發酵罐中優化前后條件下菌株的生長曲線
2.7 S4菌對鹽堿脅迫下水稻幼苗的促生作用
測定S4菌浸種對鹽堿條件下水稻生理指標的影響,由圖10和表5可知:用S4菌浸種后鹽堿脅迫下的水稻幼苗相較于鹽堿對照處理有更好的生長表現,檢驗差異分析得出:除根長與POD沒有得到顯著變化,株高、鮮重、SOD、CAT、Pro、MDA均有顯著性差異,鹽堿+加菌浸種組的株高、鮮重、SOD、CAT、Pro相較于鹽堿對照組分別顯著提升了36.05%、13.88%、23.07%、16.88%、33.26%,MDA含量顯著下降了55.50%,表明該菌對水稻有明顯的促生作用,可以顯著提高水稻SOD、CAT、Pro含量,降低活性氧和過氧化氫過量引發的膜質破壞,調節滲透壓,并減少有害物質如MDA等的積累,增強水稻的抗氧化能力。
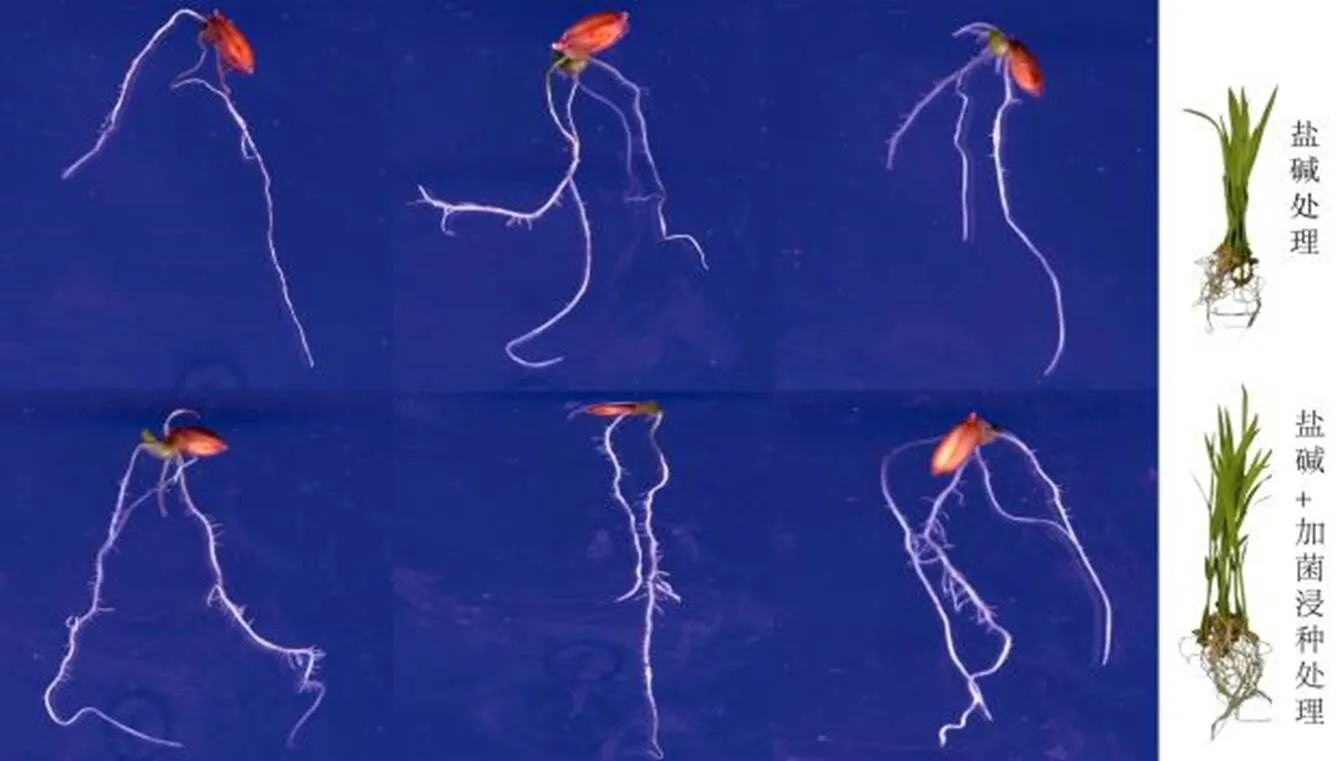
圖10 鹽堿+加菌浸種后水稻幼苗生長情況與鹽堿對照對比
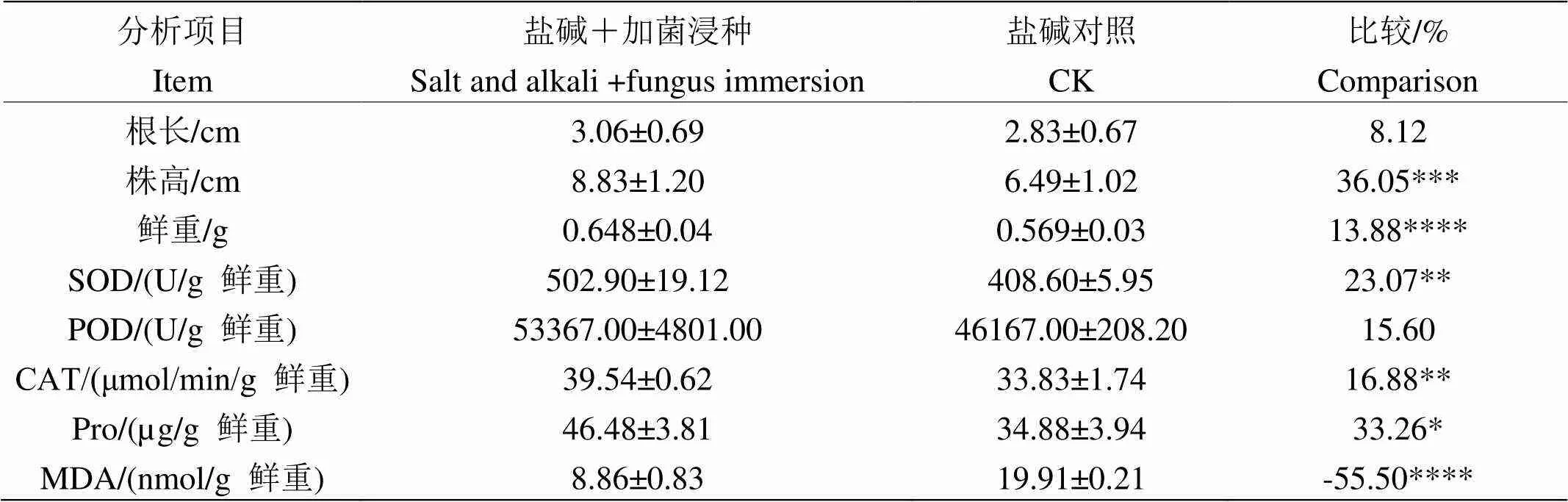
表5 菌浸種對鹽堿脅迫下水稻幼苗的影響
3 討論
早在19世紀末期,根瘤菌就應用于農業生產。植物促生菌能夠提高作物產量,施用植物促生菌劑成為解決當前農業生產問題最有效手段之一,但是促生菌菌源稀缺,能夠提高耐鹽、堿作用的菌株更是稀缺。目前,已發現的PGPR大多數屬于芽孢桿菌屬、假單胞菌屬[17,18]等,但人參地微桿菌作為植物促生菌的研究尚屬少見。袁東等[19]研究表明在鹽脅迫下加植物促生菌可以增加水稻幼苗的根長、株高、鮮重,提高SOD、POD、CAT酶的活性,清除過量的活性氧帶來的損傷;顯著提高了用于判定植物抗逆能力與受損程度的Pro含量,顯著降低決定膜損傷程度的MDA含量,與本研究鹽堿脅迫下加入S4菌水稻生理指標變化結果相似。大部分植物促生菌研究目前還停留在實驗室階段,未能將促生菌進行規模化發酵,應用于田間試驗,本研究對人參地微桿菌S4進行發酵優化為后續進行的大田實驗和促生菌菌劑生產提供理論依據[20,21]。
4 結論
(1)S4菌株最適生長培養基為蔗糖7.0 g/L、酵母浸出粉12 .0 g/L、MgSO42.0 g/L;最適培養條件為pH 8.0,溫度24 ℃,轉速220 r/min,接種量5%;培養9 h達到對數期,在生長18 h菌株活力旺盛;正交優化條件可用于5 L發酵罐中進行小試發酵,菌體產量較高;
(2)水培實驗顯示用S4菌株浸種后水稻幼苗在鹽堿條件下的根長、株高、鮮重、SOD、POD、CAT、Pro均高于對照組,MDA含量低于對照組,鹽堿+加菌浸種組的株高、鮮重、SOD、CAT、Pro相較于對照組,分別顯著提高36.05%、13.88%、23.07%、16.88%、33.26%,MDA含量顯著降低55.50%。
[1] Godfray HC, Beddington JR, Crute IR,. Food security:the challenge of feeding 9 billion people [J]. Science, 2010,327(5967):812-818
[2] 井大煒,馬海林,劉方春,等.鹽脅迫環境下接種根際促生細菌對白蠟樹根際生物學特征及其生長的影響[J].水土保 持通報,2018,38(1):76-81
[3] Vimal SR, Singh JS, Arora NK,. Soil-plant-microbe interactions in stressed agriculture management:A review [J]. Pedosphere, 2017,27(2):177-192
[4] 李建國,濮勵杰,朱明,等.土壤鹽漬化研究現狀及未來研究熱點[J].地理學報,2012,67(9):1233-1245
[5] 王佳麗,黃賢金,鐘太洋,等.鹽堿地可持續利用研究綜述[J].地理學報,2011,66(5):673-684
[6] 楊勁松,姚榮江,王相平,等.中國鹽漬土研究:歷程、現狀與展望[J].土壤學報,2022,59(1):10-27
[7] 趙明范.世界土壤鹽漬化現狀及研究趨勢[J].世界林業研究,1994(1):84-86
[8] 郭韜,余泓,邱杰,等.中國水稻遺傳學研究進展與分子設計育種[J].中國科學:生命科學,2019,49(10):1185-1212
[9] 丁俊杰,劉凱,姚亮亮,等.微生物菌劑及硅肥對鹽堿地水稻生長發育及土壤環境的影響[J].中國稻米,2022,28(1):63-66
[10] 楊淑華,鞏志忠,郭巖,等.中國植物應答環境變化研究的過去與未來[J].中國科學:生命科學,2019,49(11):1457-1478
[11] 穆文強,康慎敏,李平蘭.根際促生菌對植物的生長促進作用及機制研究進展[J].生命科學,2022,34(2):118-127
[12] 葉碧霞,左勇,傅彬,等.一種枯草芽孢桿菌培養基及培養條件的優化[J].食品科技,2017,42(1):23-28
[13] 沈萍,陳向東.微生物學實驗[M].北京:高等教育出版社,2007:28-34
[14] 張琇,林勤.紅酵母NZ-01發酵條件的優化[J].生物技術通報,2010(4):198-202
[15] 楊曉蕾,李建宏,姚拓,等.復合促生菌劑發酵條件優化及其對青稞促生效果評價[J].草地學報,2022,30(1):212-219
[16] 董京萍,陳羽,張順琦,等.枯草芽孢桿菌B731發酵工藝優化[J].揚州大學學報(農業與生命科學版),2016,37(2):87-92
[17] 王洋,張瑞,劉永昊,等.水稻對鹽脅迫的響應及耐鹽機理研究進展[J].中國水稻科學,2022,36(2):105-117
[18] 邢起銘,金文杰,周利斌,等.植物根際促生菌提高植物耐鹽性的研究進展[J].中國農學通報,2022,38(11):46-52
[19] 袁東.植物促生菌的分離及鹽脅迫下對水稻生長的影響[D].天津:天津大學,2019
[20] 袁輝林,蔡尚,呂烈武,等.植物促生菌培養條件優化及其對尾葉桉幼苗接種效應的研究[J].熱帶作物學報,2013,34 (10):1888-1894
[21] 李壯,吳凱華,齊玉璽,等.促進水稻耐鹽堿細菌S4菌株的篩選鑒定及其效果研究[J].西北農業學報,2022,31(8):1-9
Optimization of Fermentation Conditions of Strain S4 and Its Growth-promoting Effect on Rice Seedlings under Saline Alkali Stress
QI Yu-xi1,2, ZHANG Xiu1,2, YANG Guo-ping1,2,3, ZHU Juan-juan1, SHEN Ting-ting1,2, JI Hong-fei1,2, WU Kai-hua1,2
1.750021,2750021,3750021,
There are strains that can promote the salt tolerance of crops in nature. In order to obtain biological agents that can improve the adaptability of rice to plant in saline alkali land,S4 was selected to study in this paper.The carbon source, nitrogen source, inorganic salt components in culture media of strain S4 and pH, temperature, rotating speed, inoculation amount etc were optimized by shaking flask with single factor and orthogonal experiment. The conditions after fermentation optimization were tested in a 5 L fermentor; The physiological indexes of rice seedlings under different treatments after 14 days of hydroponic culture were measured. The results indicated that the optimum growth medium of strain S4 was sucrose 0.7 %, yeast extract powder 1.2 %, MgSO40.2 %, the optimum initial pH was 8, the optimum growth temperature was 24 ℃, the optimum inoculation amount was 5%, and the optimum rotation speed was 220 r/min. The cell quantity after fermentation optimization was 7.09 times higher than that before fermentation optimization. After soaking seeds in the bacterial suspension of strain S4, it can significantly promote the growth of rice under salt and alkali stress. The height, fresh weight of rice seedlings and the activities of SOD, CAT, POD and Pro in rice seedlings increased significantly, while the content of MDA in rice seedlings decreased remarkably. The results could lay a foundation for the large-scale culture and application of strain S4.
; fermentation optimization; rice; growth-promoting effect
Q815
A
1000-2324(2022)05-0719-09
2022-04-14
2022-05-20
國家自然科學基金(32060424);寧夏銀川市科技創新項目(2022NY04);國家民委中青年英才計劃項目(2016)
齊玉璽(1998-),男,在讀研究生,研究方向:微生物生態學. E-mail:2665711327@qq.com
通訊作者:Author for correspondence.E-mail:zhangxiu101@aliyun.com

