眼部蠕形螨感染影響瞼酯菌群組成的相關分析
朱佩燕,林少欽,林婉瑩,李牧玲,范宏英,林瓊希,馮裕涵,徐 靜,楊 娟,劉 瓊
0 引言
眼表共生菌具有與皮膚和腸道菌群相似的功能,可通過競爭性生長維持眼表的穩態,抑制其他致病菌的增殖[1]。眼表微環境的細微改變可能使患者易受到條件致病菌的侵襲,增加患者眼表疾病的風險。蠕形螨俗稱毛囊蟲,是一類廣泛寄生于多種宿主的小型寄生蟲,存在于人體的蠕形螨為皮脂蠕形螨和毛囊蠕形螨2種[2]。其中,毛囊蠕形螨主要寄居于睫毛毛囊,皮脂蠕形螨主要寄居于眼瞼相關的皮脂腺和瞼板腺[3],是細菌和真菌病原體的載體,其寄生于眼部并引起眼表不適,造成眼表損害,從而誘發眼表疾病[4]。目前尚未見蠕形螨感染影響眼表菌群分布相關研究的報道。為了進一步研究眼部蠕形螨感染對眼表菌群的影響,我們對受試者瞼板腺瞼酯樣本進行16S rRNA測序,分析蠕形螨和眼表微生物菌落之間的相互作用。
1 對象和方法
1.1對象選取2020-07/2021-02在南方醫科大學南方醫院眼科門診就診的316例632眼患者作為研究對象。通過詢問受試者的基本信息,填寫眼表疾病指數(OSDI)問卷調查,完成篩查檢查指標包括裂隙燈檢查、淚液分泌試驗(SⅠt)、淚膜破裂時間(BUT)、淚河高度及角膜熒光素染色(FL)、瞼緣螨蟲檢查情況,并利用眼表檢查系統觀察瞼板腺數量及形態進行評分。選取39例受試者瞼板腺瞼酯樣本進行16S rRNA測序。根據有無蠕形螨感染或有無瞼板腺功能障礙(MGD)將受試者分為三組,對照組(Con組,從316例632眼中根據以下納入標準和排除標準選取無眼表蠕形螨感染及瞼板腺功能障礙的健康人,14例)、瞼板腺功能障礙組(MGD組,有瞼板腺功能障礙但無眼表蠕形螨感染的患者,14例)、蠕形螨感染組(FM組,有眼表蠕形螨感染但無瞼板腺功能障礙的患者,11例)。本研究已獲得南方醫科大學南方醫院醫學倫理委員會批準(倫理號:NFEC-2020-089)。
1.1.1納入標準(1)自愿簽署知情同意書;(2)年齡≥18歲;(3)符合中國干眼專家共識(2020)[5],經生物顯微鏡檢查、裂隙燈檢查、SⅠt、BUT測定及FL檢查有/無蠕形螨感染或有/無瞼板腺功能障礙者;(4)就診之前的3mo內,眼部沒有發生角膜、結膜、眼瞼急性炎癥及內眼疾病等活動性炎性反應;(5)就診之前的3mo內,未曾使用任何滴眼液;(6)沒有角膜接觸鏡配戴史;(7)沒有眼部外傷史。
1.1.2排除標準(1)患有甲狀腺功能亢進等影響淚液分泌的疾病;(2)有控制不良的糖尿病病史;(3)妊娠期、哺乳期婦女;(4)有精神疾病;(5)有干燥綜合征;(6)有出血傾向的慢性疾病。
1.1.3MGD的診斷參照文獻的標準[6],由兩名眼科醫生基于臨床表現對MGD進行獨立診斷:(1)超過3mo的眼表癥狀(眼部干燥、疲勞、灼燒感和/或異物感、沙礫感);(2)裂隙燈檢查見瞼板腺孔堵塞;(3)瞼板腺分泌物的質(瞼脂混濁、伴或不伴分泌物中的條絮或顆粒、瞼酯黏稠如膏狀)和/或量異常。
1.2方法所有受試者需要在入組前完成相關檢查,按照納排標準進行篩選入組。詢問所有受試者的基本信息,包括年齡、性別、體質量、身高和其他疾病史,結果指標為OSDI問卷調查、毛囊蠕形螨檢出率、瞼緣體征、瞼板腺分泌物性狀、分泌難易程度及瞼板腺缺失評分、生物顯微鏡檢查、裂隙燈檢查、SⅠt、BUT測定及FL檢查等。
1.2.1樣本收集為了進行菌群分析,每個受試者在樣本采集前進行眼部表面麻醉(0.5%鹽酸丙美卡因滴眼液)。采集下眼瞼前囑患者眼球向上固視,操作者左手用無菌干棉簽輕輕拉開患者下眼瞼,右手將無菌棉簽伸入下眼瞼瞼結膜處,作為受力點。用棉簽沿瞼板腺導管走向從導管開口遠端向近端輕輕擠壓,將潴留于瞼板腺導管內的瞼酯擠出,采集瞼板腺瞼酯標本。采集上眼瞼前囑患者眼球向下固視,操作者左手用無菌干棉簽輕輕按壓上眼瞼,右手將無菌棉簽伸入上結膜囊,翻轉患者上眼瞼,并用棉簽固定翻轉的瞼緣,著力于眶緣,用棉簽沿瞼板腺導管走向從導管開口遠端向近端輕輕擠壓,將瞼板腺導管內的瞼酯擠出,采集瞼板腺瞼酯標本。收集的樣本儲存在-80℃冰箱中。
1.2.2眼表蠕形螨檢查在裂隙燈顯微鏡下用倒睫鑷分別在上瞼和下瞼的鼻側、顳側、中央各拔取1根睫毛,每個眼瞼取3根睫毛(主要選取根部帶有脂樣袖套狀分泌物的睫毛或倒睫、亂睫),雙眼上下瞼共取12根;將拔下的睫毛平行置于載玻片上,加蓋蓋玻片,在光學顯微鏡下觀察蠕形螨,分別統計每個眼瞼3根睫毛上檢出蠕形螨的數量及形態[7]。若拔出的睫毛根部鱗屑較多,可于載玻片上滴加香柏油進行觀察[4],有利于對蟲體進行分辨。根據我國蠕形螨瞼緣炎診斷和治療專家共識(2018年)[8],蠕形螨檢查陽性診斷標準:(1)各期的蠕形螨均計數在內;(2)成人患者在4個眼瞼中的任意1個眼瞼蠕形螨計數達到3條/3根睫毛;(3)小于上述標準為可疑陽性。因此,將眼表蠕形螨感染的嚴重程度分為陰性、可疑陽性和陽性3個級別。
1.2.3DNA的提取和測序根據DNA提取試劑盒的說明書提取瞼板腺瞼酯樣本基因組DNA,經質檢后對樣本16S rRNA基因V3~V4可變區進行PCR擴增[9],采用的測序引物為338F(5’-ACTCCTACGGGAGGCAGCA-3’)和806R(5’-GGACTACHVGGGTWTCTAAT-3’)。利用Gene Tools Analysis Software(Version4.03.05.0,SynGene)對PCR產物進行濃度對比后,按照等質量原則計算各樣品所需體積,將各PCR產物進行混合。
使用E.Z.N.A.?GelExtractionKit凝膠回收試劑盒回收PCR混合產物,TE緩沖液洗脫回收目標DNA片段。后續建庫按照NEBNext?UltraTMNA Library Prep Kit for Illumina?標準流程進行建庫,完成后采用高通量測序平臺Miseq對其進行測序。測序數據使用FLASH軟件進行拼接,fastp軟件進行質控[10],并使用UPARSE[11]軟件根據97%的相似度對序列進行操作分類單元(operational taxonomic units, OTUs)聚類,獲得OTU豐度表。
1.2.4數據分析采用R語言(version 3.3.1)軟件繪制樣本群落柱形圖(Bar圖),利用α多樣性分析組內菌群的物種多樣性,其中richness指數和Chao指數反映群落豐富度,Richness和Chao指數越大,表示該組腸道微生物豐富度越高。Shannon指數反映群落多樣性,Shannon指數越大說明群落多樣性越高。Simpson指數反映樣本的均勻度。采用β多樣性分析比較組間的菌群結構差異,以主坐標分析(principal coordinate analysis biplots, PCoA)結果展示。采用Kruskal-WallisH檢驗分析物種組間差異。采用LEfSe(linear discriminant analysis effect size)分析方法對樣本組間差異細菌進行線性判別分析(LDA),找出組間產生顯著性差異影響的物種。
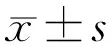
2 結果
2.1受試者基線資料分析本研究收集了39例受試者的瞼酯樣本進行檢測,其中女性33例、男性6例,并且均無高血壓史、糖尿病史及甲狀腺功能亢進史,其余具體信息見表1。

表1 受試者基線資料
2.2眼表蠕形螨感染患者與對照組瞼酯菌群相對豐度的差異收集了39例受試者的瞼酯樣本菌群進行16S rRNA基因V3~V4片段的高通量測序。為了探究蠕形螨感染對瞼酯菌群的影響,分別在門和屬水平分析了受試者瞼酯菌群的相對豐度。菌群相對豐度是指某些細菌的豐度與整體菌群豐度的比率。在常見菌門中,厚壁菌門、變形菌門、放線菌門和擬桿菌門均為對照組、MGD組和FM組的主要細菌(圖1A)。通過門水平上的相對豐度比較發現,三組樣本在厚壁菌門(F=6.036,P=0.007)和變形菌門(F=7.749,P=0.002)豐度的差異具有統計學意義。進一步兩兩比較顯示FM組的厚壁菌門豐度顯著低于對照組(P=0.002)和MGD組(P=0.041),變形菌門豐度顯著高于對照組(P=0.001)和MGD組(P=0.007),見表2。
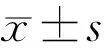
表2 門水平上的菌群豐度比較
在屬的水平上,三組樣本的優勢菌群存在差異。對照組的前4種優勢菌屬分別為芽孢桿菌屬(38%)、棒桿菌屬_1(14%)、葡萄球菌屬(13%)和不動桿菌屬(11%),MGD組分別為芽孢桿菌屬(22%)、葡萄球菌屬(15%)、丙酸菌屬(11%)和棒桿菌屬_1(7%),FM組分別是假單胞菌屬(14%)、葡萄球菌屬(11%)、不動桿菌屬(8%)和棒桿菌屬_1(5%)(圖1B)。通過屬水平上的相對豐度比較發現,三組間的假單胞菌屬(F=13.704,P<0.001)、羅爾斯通氏菌屬(F=6.140,P=0.006)和叢毛單胞菌屬(F=10.077,P=0.001)的豐度差異具有統計學意義,進一步兩兩比較顯示FM組的假單胞菌屬豐度顯著高于對照組和MGD組(均P<0.001),叢毛單胞菌屬豐度顯著高于對照組(P<0.001)和MGD組(P=0.001),羅爾斯通氏菌屬豐度顯著低于對照組(P=0.048)和MGD組(P=0.002),見表3。

圖1 瞼酯菌群分布比較 A:門水平的菌群分布比較;B:屬水平的菌群分布比較。
通過LEfSe分析科-屬水平上的三組樣本菌群差異,進一步篩選出組間具有顯著差異的標志性微生物。我們檢測到健康對照組主要富集芽孢桿菌科、厭氧芽孢桿菌屬和莫拉氏菌科,MGD組主要富集丙酸桿菌屬、丙酸桿菌屬和棒狀桿菌屬等10個菌群,FM組主要富集奈瑟氏菌科、假單胞菌科和假單胞菌屬等17個菌群(LDA>4),見圖2。

圖2 LEfSe組間差異分析。
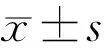
表3 屬水平上的菌群豐度比較
2.3眼表蠕形螨感染患者與對照組瞼酯菌群多樣性分析對三組瞼酯樣本進行微生物群落OTU數量分析,經優化后三組瞼板腺分泌物DNA共獲得3 715 104條有效序列,OTU聚類分析得到對照組共產生820個OTU,MGD組的OTU數目為867個,與對照組接近,而FM組相比其余兩組具有更豐富的OTU,總計1 561個(圖3)。采用4個指標(Richness、Chao、Simpson和Shannon)進行三組間瞼酯菌群的多樣性分析。

圖3 瞼酯微生物群落OTU分析。
三組間的Richness(F=4.929,P=0.015)和Chao(F=4.997,P=0.014)指數差異存在統計學意義,兩兩比較顯示FM組樣品的Richness(P=0.004)和Chao(P=0.004)指數均顯著高于對照組,提示FM組樣品的微生物豐富度顯著高于對照組(圖4A、B)。三組樣品的Simpson指數無明顯差異,提示三組均勻度沒有顯著差異(F=1.755,P=0.192,圖4C)。三組間的Shannon指數差異存在統計學意義(F=3.730,P=0.037),兩兩比較顯示FM組樣品的Shannon指數顯著高于對照組(P=0.013),提示FM組樣品的微生物群落多樣性顯著高于對照組(圖4D)。

圖4 瞼酯菌群的α多樣性分析 A:Richness; B:Chao; C:Simpson; D:Shannon。aP<0.05,bP<0.01 vs 對照組。
利用unweighted UniFrac distances計算β多樣性分析指數。PCoA分析發現三組樣本微生物群落組成存在明顯差異(Adonis,P=0.003),第一主成分和第二主成分的貢獻率分別為10.5%和6.4%。組間差異性分析顯示,FM組的群落組成與對照組(P=0.001)和MGD組(P=0.015)均存在顯著差異(圖5)。

圖5 瞼酯菌群的β多樣性分析。
3 討論
健康的眼表菌群可以保護眼表組織,正常人眼結膜嚢菌群以葡萄球菌(或棒狀桿菌)、丙酸桿菌為主[12]。當眼表菌群失調時,眼表屏障功能受損,導致眼表疾病的發生[13]。隨著二代測序16S rRNA的應用,研究者發現在部分正常人群眼表存在200余種細菌,分為5個門59個屬,同時也印證了眼表菌群主要由以凝固酶陰性葡萄球菌、棒狀桿菌、丙酸桿菌等革蘭陽性菌為主的多種菌共同組成[14]。以往對眼表菌群研究的樣本主要來源于結膜拭子[15],目前對瞼酯菌群構成以及蠕形螨感染對瞼酯菌群影響的相關研究未見報道。我們首次應用二代測序技術在門和屬水平對瞼酯菌群進行分析,發現健康人群瞼酯中的優勢菌群為芽孢桿菌屬、棒桿菌屬、葡萄球菌屬和不動桿菌屬。
瞼板腺分泌的瞼酯參與了淚膜脂質層構成,發揮著維持淚膜穩定性,降低淚膜水液層蒸發率等重要作用。MGD是眼科常見疾病,通常以終末導管的堵塞和瞼酯的質/量分泌異常為病理特征,是干眼的重要原因[16]。既往研究表明盡管MGD患者瞼板腺中細菌總數與正常人相比較無明顯增多,但具有產生酯酶能力的細菌卻明顯多于正常人,其酯酶的活性也明顯升高[17]。我們的研究也發現MGD組瞼酯菌群中丙酸桿菌屬顯著高于對照組和FM組,丙酸桿菌科在MGD組含量最高(11%)。瞼板腺中存在的痤瘡丙酸桿菌科等細菌可產生分解瞼板腺油脂的酯酶,這些酯酶能將脂質分解成多種脂肪酸,過量的游離脂肪酸則會通過皂化作用形成泡沫狀分泌物,從而影響淚膜穩定性,導致淚膜崩解[18],同時引起眼表的炎癥反應。
蠕形螨是許多細菌和真菌病原體的載體,可以寄生于眼部并誘發眼表疾病[4]。首先,蠕形螨以皮脂、毛囊和腺上皮細胞為食,蠕形螨的感染率越高,對瞼板腺的結構損傷越嚴重[19]。蠕形螨感染可導致瞼板腺腺泡擴張、融合、萎縮,瞼板腺腺孔密度降低,腺體孔口不規則,內壁不光滑,孔口面積變小[16]。其次,蠕形螨也是鏈球菌、葡萄球菌等細菌的載體[1],其感染灶能夠為細菌、真菌等微生物提供良好的生存環境,加重皮膚、眼瞼腺體損害,進一步損傷角膜結膜組織[20]。另一方面,致病細菌也產生一系列毒素和酶等毒力因子,導致皮膚和腺體結構的破壞,進一步為蠕形螨繁殖提供良好的微環境,促進疾病的發生發展。Liang等[15]的研究認為蠕形螨感染改變了眼表(結膜拭子)優勢菌群的組成,尤其是假單胞菌屬和新鞘脂菌屬,而對眼表(結膜拭子)菌群的多樣性沒有顯著影響。我們采集了39例受試者(包括14例健康人,14例瞼板腺功能障礙患者和11例眼表蠕形螨感染患者)的瞼酯細菌樣本,并對其進行了16S rRNA測序。我們發現FM組瞼酯菌群構成比與其他兩組顯著不同,假單胞菌屬和叢毛單胞菌屬均顯著高于對照組和MGD組。通過LEfSe分析組間菌群差異,我們發現FM組瞼酯菌群主要富集奈瑟氏菌科、假單胞菌科和假單胞菌屬等17個菌群。假單胞菌通常感染受損組織或免疫力低下的組織[21],從蠕形螨皮損中可分離到銅綠假單胞菌,而非蠕形螨感染組織則無法分離,提示蠕形螨感染與機會性假單胞菌感染有關[22]。
與眼表蠕形螨不影響眼表菌群多樣性不同的是,我們發現MGD組和FM組瞼酯菌群微生物豐富度(Richness指數和Chao指數)、微生物群落多樣性(Shannon指數)顯著高于對照組,提示蠕形螨不僅改變了瞼酯菌群的結構,還提高了瞼酯菌群的多樣性。Gao等[23]研究發現,眼部蠕形螨的侵襲會引起瞼酯組成成分發生變化。在該研究中,蠕形螨感染組的25種o-酰基-ω-羥基脂肪酸(OAHFA)水平升高,這可能是MGD后眼表微環境不平衡導致瞼板腺的適應性改變,也可能是蠕形螨大量繁殖導致細菌微生物的不平衡,改變了瞼板腺的脂質成分。綜上,我們推測蠕形螨感染改變眼表及瞼板腺的微環境,改變瞼酯菌群結構,優勢菌群變為假單胞菌屬,提高了瞼酯菌群多樣性,可能進一步改變瞼酯成分,加重眼表的損傷。
本研究招募了39例受試者的瞼酯樣本進行檢測,首次應用二代測序技術對受試者的瞼酯菌群進行分析,發現蠕形螨感染改變了瞼酯菌群的構成,并提高了瞼酯菌群的微生物豐富度和群落多樣性。FM組的假單胞菌屬和叢毛單胞菌屬均顯著高于對照組和MGD組,羅爾斯通氏菌屬顯著低于對照組和MGD組。綜上,我們推測眼表蠕形螨感染可能通過改變瞼板腺微環境,影響瞼酯菌群結構,改變瞼酯成分,加重眼表損傷。但是,本研究招募瞼酯樣本的受試者樣本量較小,這可能導致選擇偏差,受試者一般資料及病史情況是否對眼表蠕形螨感染產生差異,未來須有大量多中心臨床研究,提高研究結論的科學性和代表性。

