不同傳染性法氏囊病病毒株感染對CCL19-CCR7軸系表達量的影響
王秋霞,張 新,楚富茗,王明明,王 芳,盧 浪,魏小兵,余 燕,張艷紅,馬金友,姜金慶,歐長波,劉興友,2
(1. 河南科技學院動物科技學院,河南 新鄉 453003 ; 2. 新鄉學院生命科學與基礎醫學學院,河南 新鄉 453003)
傳染性法氏囊病病毒(Infectious bursal disease virus,IBDV)是禽類傳染性法氏囊病(Infectious bursal disease,IBD)的病原體,主要攻擊禽類的中樞免疫器官——法氏囊,從而引起育成雞的病理損傷和免疫抑制,若同時混合其他病原感染,往往會引起雞只的大批死亡,給養禽業帶來嚴重的經濟損失。
有研究顯示,在IBDV感染過程中,法氏囊組織受到攻擊,導致前B淋巴細胞凋亡[1-2],大量的外源T細胞遷移至法氏囊[3],浸潤法氏囊的T細胞活化后,釋放Th1細胞因子γ-干擾素(IFN-γ),可刺激巨噬細胞進一步產生促炎細胞因子,如白細胞介素IL-6、IL-1β和趨化因子CXCLi2等[4],在IBDV感染后的炎癥過程、病毒清除和法氏囊損傷發展以及恢復過程中發揮了重要作用,也造成了周圍組織的病理損傷[5-7]。高通量測序結果顯示,IBDV CJ801株感染早期,部分趨化因子及其受體的表達量明顯上調,其中以趨化因子CCL19的表達量變化最為明顯[8]。
T細胞趨化至法氏囊發揮T細胞免疫應答受宿主基因型和毒株毒力的影響,有研究顯示,宿主基因型和毒株毒力能夠影響IBDV感染后產生的病變程度、細胞浸潤狀態、細胞因子表達水平及信號通路的激活[4,9]。但是,不同毒株感染對趨化因子表達量的影響是否存在差異尚不清楚,為了進一步了解不同毒力毒株感染后對CCL19及其受體基因表達水平的影響,本試驗選取IBDV經典毒株CJ801株和新鄉本地分離毒株HN-1株進行攻毒試驗,比較分析CCL19及其受體CCR7基因表達情況,以期為后續的研究提供數據支撐。
1 材料與方法
1.1 材料
1.1.1 病毒 IBDV CJ801株,由北京市農林科學院畜牧獸醫研究所劉爵研究員饋贈;IBDV HN-1株,由本實驗室自新鄉本地病禽體內分離獲得。
1.1.2 試驗動物 SPF種蛋,購自北京梅里亞維通利華實驗動物技術有限公司,孵化后于隔離器中飼養,21日齡進行攻毒試驗。
1.1.3 試劑 總RNA提取試劑盒、質粒小提試劑盒、凝膠回收試劑盒,均購自Omega公司;M-MLV反轉錄酶,購自Promega公司;Real Master Mix (SYBR Green I),購自Invitrogen公司;其他常規試劑均為國產分析純。
1.2 方法
1.2.1 動物攻毒試驗 將53只SPF雞隨機分成3個組,分別為HN-1感染組、CJ801感染組和對照組,感染組每組20只,對照組13只。分別通過點眼、滴鼻的方式感染,按103EID50/0.1 mL的劑量,給予感染組每只雞0.2 mL IBDV病毒液,對照組每只雞以同樣方式給予0.2 mL PBS。不同組雞只分別飼養在不同的隔離器中,自由飲水、進食,光照、黑夜各12 h。在病毒感染后第1、3、5天和第7天,每組隨機挑選3只雞,麻醉致死,收集法氏囊備用。
1.2.2 RNA提取與反轉錄 分別取感染組和對照組雞的法氏囊組織,經液氮研磨后,按照試劑盒說明書提取總RNA后進行反轉錄,合成cDNA。
1.2.3 引物設計與合成 根據GenBank上已登錄IBDVVP2、禽源CCL19和CCR7基因序列,分別設計1對引物,同時針對β-actin基因設計1對引物作為內參,進行熒光定量PCR(qPCR)檢測。所設計引物見表1。

表1 引物序列Table 1 Primer sequences
1.2.4VP2基因PCR擴增 以反轉錄合成的cDNA為模板,使用VP2基因的引物進行PCR擴增。反應程序:95 ℃預變性1 min;95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸1 min 20 s,30個循環;72 ℃延伸10 min。擴增產物使用1%瓊脂糖凝膠電泳檢測,紫外照射下觀察條帶并拍照。
1.2.5 序列比對分析 PCR擴增呈陽性的HN-1株IBDVVP2片段送至生工生物工程(上海)股份有限公司進行測序,利用DNASTAR 5.0軟件,將測序結果與GenBank中登錄的不同毒力IBDV毒株(表2)的VP2基因序列進行比對,通過MEGA軟件做進化分析。
1.2.6 qPCR檢測 qPCR使用SYBR Green Master Mix試劑盒,在7500 Real-time PCR儀中進行。qPCR程序:95 ℃ 1 min;95 ℃ 15 s,58 ℃ 30 s,72 ℃ 20 s,40個循環;72 ℃ 10 min。qPCR以β-actin為內參基因。所有樣品重復3次確保擴增重復性。使用2-ΔΔCt方法對基因表達水平進行相對含量計算。
1.2.7 數據處理與分析 執行t檢驗分析,利用 Graphpad Prism 7.0 軟件對處理數據生成圖片和分析,將對照組基因表達水平設置為1,評價感染組目的基因表達水平。結果記為“平均值±標準誤”,P<0. 05 表示差異顯著,P<0.01表示差異極顯著,P>0. 05 表示差異不顯著。

表2 比對和進化分析所用參考序列Table 2 Reference strains used in the sequence alignment and phylogenetic analysis
2 結果
2.1 動物攻毒試驗 感染組SPF雞攻毒后自第1天開始便出現精神沉郁癥狀,隨著時間的推移,CJ801感染組和HN-1感染組雞只均出現羽毛蓬亂、腹瀉等癥狀。2個感染組剖檢癥狀無明顯差異,均可見胸肌、腿肌的明顯出血,法氏囊呈明顯的“紫葡萄”狀(圖1);但與CJ801感染組相比,HN-1感染組雞只死亡時間稍延后,感染后期可見胸腺嚴重萎縮。對照組無明顯臨床癥狀,剖檢未見明顯病理變化。攻毒試驗結果表明,感染組SPF雞成功感染IBDV。

圖1 IBDV攻毒SPF雞引起的病理變化Fig.1 Macroscopic lesions in SPF chicken after inoculation with IBDVA: 感染組雞法氏囊; B: 對照組雞法氏囊; C:感染組腿肌和胸肌; D:對照組腿肌和胸肌A: Bursal tissues from infection group SPF chicken; B: Bursal tissues from control group SPF chicken; C: Leg muscles and chest muscles from infection group SPF chicken; D: Leg muscles and chest muscles from control group SPF chicken
2.2VP2基因PCR擴增 為了進一步證實攻毒試驗成功,分別取感染組和對照組雞只法氏囊樣品,提取總RNA,以反轉錄合成的cDNA為模板,對IBDV的VP2基因進行PCR擴增。凝膠電泳結果如圖2所示,無論是CJ801感染組還是HN-1感染組,擴增產物條帶大小均與預期大小一致,對照組未見明顯條帶。

圖2 VP2片段的PCR擴增Fig.2 PCR amplification of VP2 geneM:DL2 000 Marker; 1:對照組; 2:CJ801感染組; 3:HN-1感染組M:DL2 000 Marker; 1:Control group; 2:CJ801 infection group; 3:HN-1 infection group
2.3 序列比對分析 擴增的VP2片段測序后經BLAST分析,與GenBank上登錄的IBDVVP2基因序列一致,進一步證實本次感染成功。為進一步了解本地分離株HN-1的進化關系及其與CJ801株之間的遺傳距離,使用測得的HN-1VP2基因序列與GenBank上登錄的不同毒力IBDV毒株VP2基因序列進行比對,利用MEGA軟件構建進化樹,結果顯示,HN-1株VP2基因序列與UK661、Harbin-1、OKYM、D6948等超強毒株VP2基因序列高度同源,而與CJ801株的VP2基因序列不在同一個小分支上(圖3)。

圖3 CJ801株和HN-1株IBDV VP2序列進化分析Fig.3 Phylogenetic analysis of VP2 nucleotide sequences from IBDV CJ801 strain and HN-1 strain●:本試驗毒株●:Strains in this study
2.4 感染早期法氏囊組織中CCL19基因表達 分別取感染組和對照組雞法氏囊組織,液氮研磨后提取總RNA,反轉錄后進行qPCR擴增,檢測IBDV不同毒株對雞T細胞趨化因子CCL19基因表達量的影響。結果如圖4和圖5所示,盡管CJ801株感染雞CCL19基因的表達要早于HN-1株,達到最高峰的時間也早于HN-1株,但感染后,無論是CJ801組,還是HN-1組,CCL19基因的表達水平均明顯高于對照組(P<0.05或P<0.01)。

圖4 CJ801株IBDV感染SPF雞后法氏囊組織中CCL19 mRNA的表達Fig.4 Chicken bursal CCL19 mRNA expression levels after infection with IBDV CJ801 strain與對照組相比,*:P<0.05,**:P<0.01; 下圖同Compared with the control group,*:P<0.05,**:P<0.01. The same as below
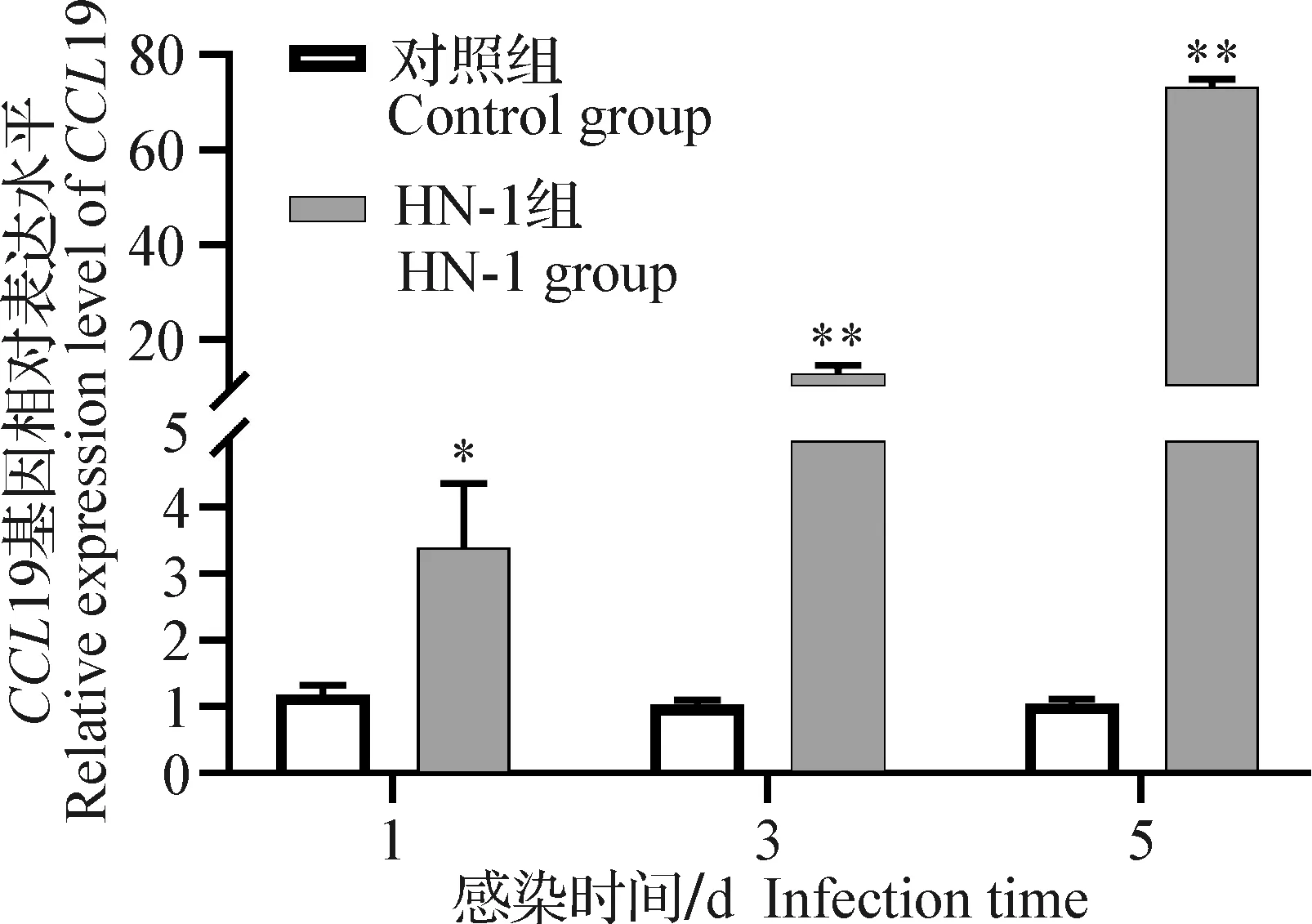
圖5 HN-1株IBDV感染SPF雞后法氏囊組織中CCL19 mRNA的表達Fig.5 Chicken bursal CCL19 mRNA expression levels after infection with IBDV HN-1 strain
2.5 感染早期法氏囊組織中CCR7基因表達CCR7基因的qPCR檢測結果與CCL19基因呈一致的趨勢(圖6、圖7)。感染早期,CCR7基因的表達量明顯升高,HN-1株感染雞CCR7基因的表達和達到高峰的時間均晚于CJ801株。但感染后,2個感染組CCR7的mRNA表達水平均明顯高于對照組(P<0.01)。

圖6 CJ801株IBDV感染SPF雞后法氏囊組織中CCR 7 mRNA的表達Fig.6 Chicken bursal CCR 7 mRNA expression levels after infection with IBDV CJ801 strain
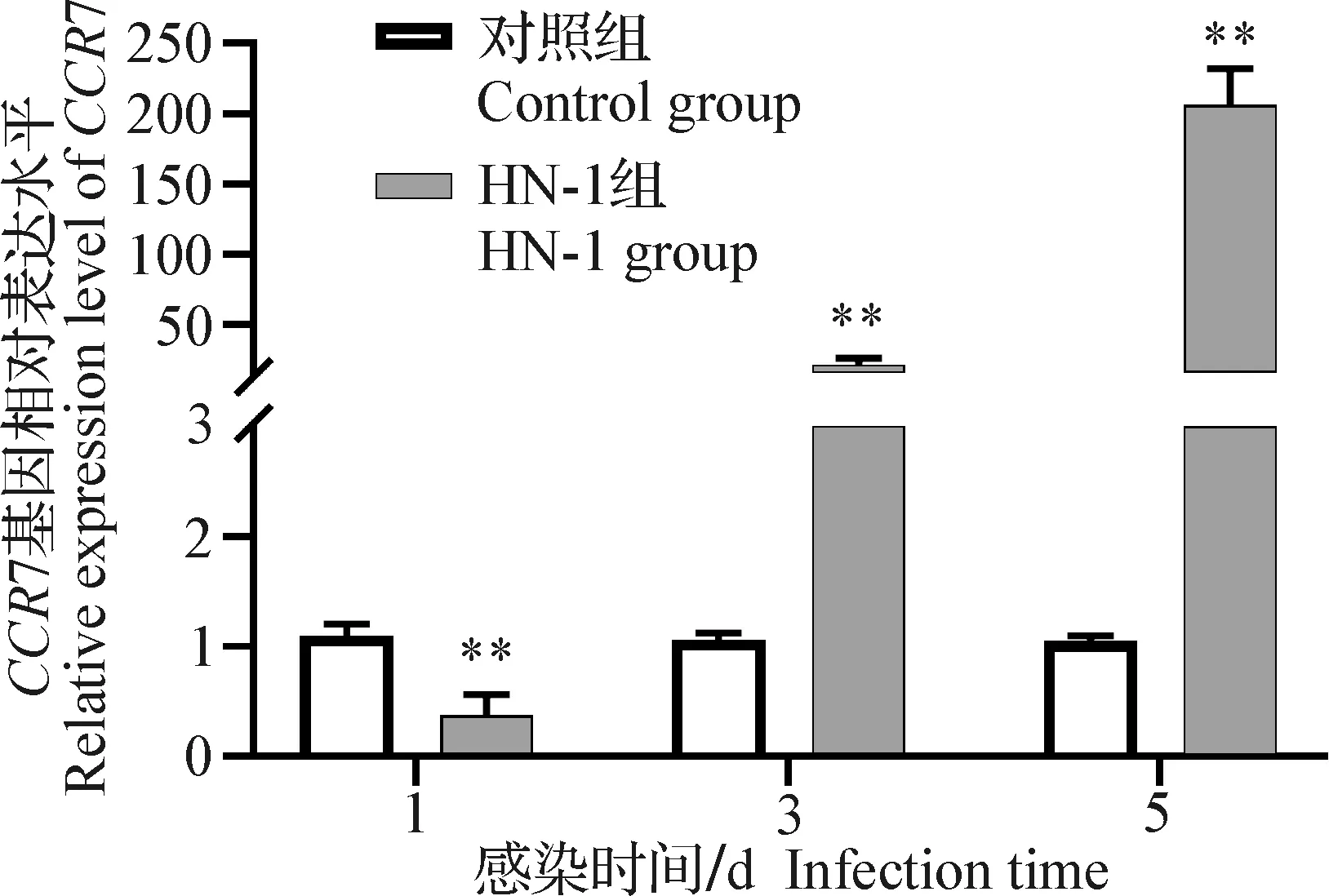
圖7 HN-1株IBDV感染SPF雞后法氏囊組織中CCR 7 mRNA的表達Fig.7 Chicken bursal CCR 7 mRNA expression levels after infection with IBDV HN-1 strain
3 討論
IBDV主要侵襲雞法氏囊組織,破壞其中樞免疫器官法氏囊,導致雞的免疫反應性降低,長期處于免疫抑制狀態,因此,IBD也被稱為雞的“艾滋病”,當合并其他細菌或病毒感染時,極易造成雞只的死亡,給養禽業帶來嚴重危害。有研究顯示,當IBDV侵染法氏囊組織后,IBDV在法氏囊內大量增殖,造成B細胞和巨噬細胞損傷[4,10],T細胞滲入,最終導致法氏囊組織中T細胞達到65%,而B細胞僅占7%[3]。浸潤法氏囊的T細胞活化后,釋放Th1細胞因子IFN-γ,發揮抗病毒作用;同時上調促炎因子,介導炎癥反應,損傷法氏囊,延緩組織修復。升高的CD4+CD25+T細胞還可能參與IBDV誘導的免疫抑制[6],而IBDV誘導的免疫損傷也與法氏囊的炎癥、凋亡和炎性細胞因子失衡有關[11]。通常認為,趨化因子與受體結合參與了T細胞遷移的調節作用[12-14]。
在前期研究中,本團隊發現,經典毒株CJ801感染SPF雞后,感染組法氏囊樣品與對照組樣品差異表達基因很多。在感染早期,許多與免疫相關的基因,如炎性反應基因、抗病毒相關基因等,表達水平明顯升高。在炎性反應相關基因中,趨化因子往往通過趨化免疫細胞,參與人和動物許多疾病進程。在對高通量測序結果分析過程中,本團隊發現趨化因子CCL19及其受體CCR7的表達量變化比較明顯,推測CCL19及其受體的相互作用可能在T細胞遷移過程中發揮著非常重要的作用。進一步的研究結果也證實,CCL19是T細胞遷移至法氏囊的主要驅動力[15]。但是這個結果是否具有代表性?不同毒株感染后,趨化因子CCL19及其受體的變化趨勢是否相同?從本試驗的結果來看,無論是經典毒株CJ801還是本地分離毒株HN-1,感染后,盡管引起趨化因子CCL19及其受體CCR7基因表達量達到最高的時間有所差異,但二者都能夠引起趨化因子CCL19及其受體CCR7基因表達量的明顯上升。但是本試驗也觀察到一個奇怪現象:進化分析的結果顯示,本地分離毒株HN-1株VP2基因序列與UK661、Harbin-1、OKYM、D6948等超強毒株VP2基因序列高度同源,而與CJ801株VP2基因序列進化關系較遠。進化分析結果表明HN-1株與CJ801株毒力上存在一定的差異,但感染試驗的結果表明二者毒力相近;HN-1感染后趨化因子CCL19及其受體CCR7表達量的升高要晚于CJ801株,持續時間也偏長。VP2是IBDV的主要保護性抗原基因,其高變區通常能夠影響毒株的毒力,因此,許多學者將其作為分子流行病學和進化研究的指標[16-17]。本試驗也選取了VP2基因序列進行進化分析,但從分析結果和感染試驗結果比對來看,僅使用VP2基因來做進化分析是不夠的。前期研究中,對本地分離株HN-1的B片段進行了比對分析,顯示其B片段與超強毒株存在較大差異,與一些重組毒株具有近的親緣關系[18]。這些結果提示B片段的來源在一定程度上影響了HN-1株的毒力,Lu等[19]、Gao等[20]和Abou El-Fetouh等[21]學者的研究結果,均證實了IBDV B片段對其毒力具有一定的貢獻。因此,推測是由于重組造成毒株的毒力下降,出現了上述情況。
本試驗結果證實,不同毒力IBDV毒株感染均能引起趨化因子CCL19及其受體CCR7基因表達呈一定程度的升高,而IBDV毒株毒力強弱也能夠影響CCL19和CCR7基因表達變化趨勢。這為進一步探究是否可以通過調控CCL19或CCR7基因表達水平,減輕IBDV感染后細胞因子風暴對法氏囊組織的影響提供了數據支撐。

