犬源皮氏葡萄球菌的分離鑒定和耐藥性分析
李虹瑾,唐玉嬌,劉嘉琳,劉 斌,董文龍
(1.長春科技學院職業技術學院,吉林 長春 130600 ; 2.吉林農業大學動物科學技術學院,吉林 長春 130118 ; 3.吉林農業科技學院動物科技學院,吉林 吉林 132109)
寵物犬作為人類忠實的伙伴,已成為很多家庭的伴侶動物。然而,由于犬只本身免疫低下或是寵主的不科學喂養,常導致寵物犬感染致病性細菌而發病。本試驗在1只患有外耳炎的金毛犬耳道拭子樣品中分離到1種凝固酶陰性葡萄球菌,并對分離菌株進行了鑒定和藥物敏感性分析。
1 材料與方法
1.1 樣品來源 無菌采集金毛犬外耳炎膿液樣品,進行致病性細菌的分離鑒定。
1.2 主要試劑 Mueller-Hinton瓊脂、腦心浸液瓊脂、腦心浸液肉湯、細菌生化鑒定管和兔血漿,均購自青島海博生物技術有限責任公司;細菌基因組DNA提取試劑盒、膠回收試劑盒、革蘭染色液,均購自北京索萊寶科技有限公司;DL2 000 DNA Marker,購自寶生物工程(大連)有限公司;TaqPCR Mix 預混液、瓊脂糖、無菌去離子水、50×TAE 緩沖液、溴化乙錠(EB),均購自生工生物工程(上海)股份有限公司。
1.3 試驗藥品 環丙沙星、恩諾沙星、四環素、多西環素、阿奇霉素、紅霉素、林可霉素、克林霉素、頭孢噻肟、氯霉素、慶大霉素、萬古霉素、阿莫西林和磺胺間甲氧嘧啶共14種抗菌藥物,均由吉林農業科技學院饋贈。
1.4 細菌的分離培養 將采集的膿液樣品接種于腦心浸液瓊脂平板上,37 ℃條件下恒溫培養12 h,挑取單菌落于腦心浸液肉湯中搖床增殖培養至對數生長期備用。取100 mL菌液進行1 000倍稀釋后涂布于腦心浸液瓊脂平板上,37 ℃恒溫培養12 h,觀察菌落形態。
1.5 革蘭染色鏡檢 清潔載玻片表面,采用無菌生理鹽水稀釋挑取的單菌落,酒精燈火焰上進行加熱固定,按步驟進行革蘭染色,油鏡下觀察菌體形態特征。
1.6 生化試驗 在兔血漿安瓿瓶中加入腦心浸出液肉湯培養基0.2 mL,再加入制備的濃菌懸液 0.5 mL,(36±1) ℃培養,連續觀察6 h,根據是否有凝塊形成判定分離菌株是否能夠產生血漿凝固酶。備用的培養菌液分別接種于葡萄糖、乳糖、甘露醇等發酵管中進行產酸生化試驗。
1.7 16S rRNA基因序列分析 抽取1 mL備用菌液10 000 r/min離心5 min,收集菌體沉淀,按照細菌基因組DNA提取試劑盒說明書提取DNA,作為分離菌株16S rRNA基因PCR擴增的模板。參照參考文獻[1]設計16S rRNA細菌鑒定通用引物,由生工生物工程(上海)股份有限公司合成。上游引物:5′-AGAGTTTGATCCTGGCTCAG-3′,下游引物:5′-GGTTACCTTGTTACGACTT-3′。PCR 反應體系(25 μL):基因組DNA模板1 μL,上、下游引物各1 μL,TaqPCR Mix 預混液12 μL,無菌去離子水10 μL。PCR反應條件:94 ℃ 5 min;94 ℃ 1 min,50 ℃ 1 min,72 ℃ 1 min,共30個循環;72 ℃ 延伸10 min。取5 μL PCR產物進行瓊脂糖凝膠電泳檢測,對1 500 bp處目的條帶進行切膠回收,送生工生物工程(長春)股份有限公司測序,將一代測序獲得的基因序列進行BLAST比對分析。
1.8 系統進化分析 于GenBank數據庫中下載與分離菌株16S rRNA基因序列高度同源的16S rRNA基因序列,采用MEGA 6.0軟件構建系統進化樹。
1.9 最小抑菌濃度(Mininum inhibitory concentration,MIC)測定及藥敏試驗 將菌液調整至濃度為1×106CFU/mL,抗菌藥物配制成0.030、0.060、0.125、0.250、0.500、1.000、2.000、4.000、8.000、16.000、32.000、64.000、128.000、256.000 μg/mL和512.000 μg/mL 15個不同的梯度濃度,采用瓊脂擴散法測定14種抗菌藥物對分離菌株的MIC。藥敏結果的判讀參照美國臨床和實驗室標準協會(Clinical and Laboratory Standards Institute,CLSI)抗微生物藥物敏感性試驗判斷標準。
2 結果
2.1 細菌的分離培養 分離菌株命名為SP-1,涂布于腦心浸液瓊脂平板上培養后,可見乳白色較小菌落,邊緣整齊,表面光滑,略凸起(圖1)。

圖1 SP-1菌落形態Fig.1 SP-1 colony morphology
2.2 革蘭染色鏡檢 油鏡下觀察可見明顯的革蘭陽性葡萄球菌,多數菌體呈聚集狀態(圖2)。
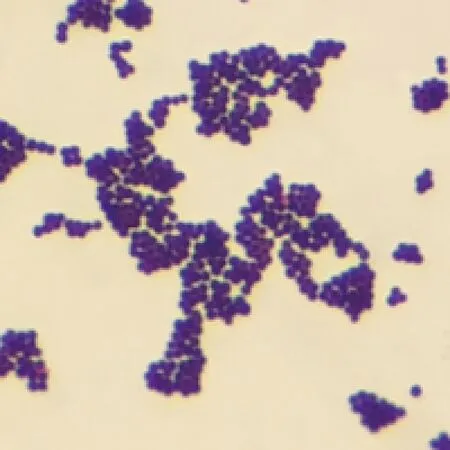
圖2 SP-1革蘭染色結果(1 000×)Fig.2 Result of SP-1 Gram staining (1 000×)
2.3 生化試驗 分離菌株SP-1不能產生血漿凝固酶,其他各項生化試驗結果與 Trülzsch等[2]相關試驗中皮氏葡萄球菌的生化結果基本一致(表1)。

表1 SP-1生化試驗結果Table 1 Results of SP-1 biochemical test
2.4 16S rRNA基因序列分析 分離菌株16S rRNA基因PCR擴增產物經1%瓊脂糖凝膠電泳檢測,在約1 500 bp處有一清晰核酸電泳條帶(圖3)。PCR擴增產物測序結果(1 461 bp)與GenBank數據庫中相關菌株序列進行比對,結果顯示,SP-1與皮氏葡萄球菌的同源性為99%。

圖3 分離株16S rRNA的 PCR 擴增Fig.3 PCR amplification of 16S rRNA of the isolateM:DL2 000 DNA Marker; 1:SP-1 16S rRNA 基因PCR擴增產物M:DL2 000 Marker; 1:PCR product of SP-1 16S rRNA
2.5 系統進化分析 選取SP-1 16S rRNA基因序列與GenBank數據庫中其他來源皮氏葡萄球菌的16S rRNA基因序列構建系統進化樹,結果顯示,SP-1與其他來源的皮氏葡萄球菌親緣關系均較遠(圖4)。

圖4 SP-1 與其他來源皮氏葡萄球菌16S rRNA基因系統進化樹的構建Fig.4 Construction of phylogenetic tree of 16S rRNA gene from SP-1 and other Staphylococcus pettenkoferi▲:本試驗所得分離株▲:The strain isolated in this experiment
2.6 MIC測定及藥敏試驗 采用瓊脂擴散法測定14種抗菌藥物對SP-1的MIC值,藥物敏感性結果顯示,SP-1對環丙沙星、恩諾沙星、氯霉素、四環素、多西環素、頭孢噻肟、慶大霉素、萬古霉素和阿莫西林敏感,對林可霉素、克林霉素、阿奇霉素、紅霉素和磺胺間甲氧嘧啶高度耐藥(表2)。
3 討論
凝固酶陰性葡萄球菌(Coagulase-negative staphylococci,CoNS)被認為是構成人類和動物皮膚及黏膜正常微生物群的主要組成部分,一般無致病作用,與臨床感染關聯并不密切。然而,近年來大量臨床數據表明,這些凝固酶陰性葡萄球菌如表皮葡萄球菌、腐生葡萄球菌、木糖葡萄球菌可引起免疫缺陷患者或新生兒不同形式的感染,如細菌性腦膜炎、鼻炎、鼻息肉、鼻竇炎、壞死性鼻竇炎、假體周圍關節感染、咽炎、頭頸骨髓炎、扁桃體炎、復發性扁桃體炎等[3-4]。此外,在獸醫臨床上具有致病性的凝固酶陰性葡萄球菌的分離率也在逐漸增多,該類細菌可引起奶牛的乳房炎、豬的呼吸系統疾病、貓的尿路感染和外耳炎等[5-7]。
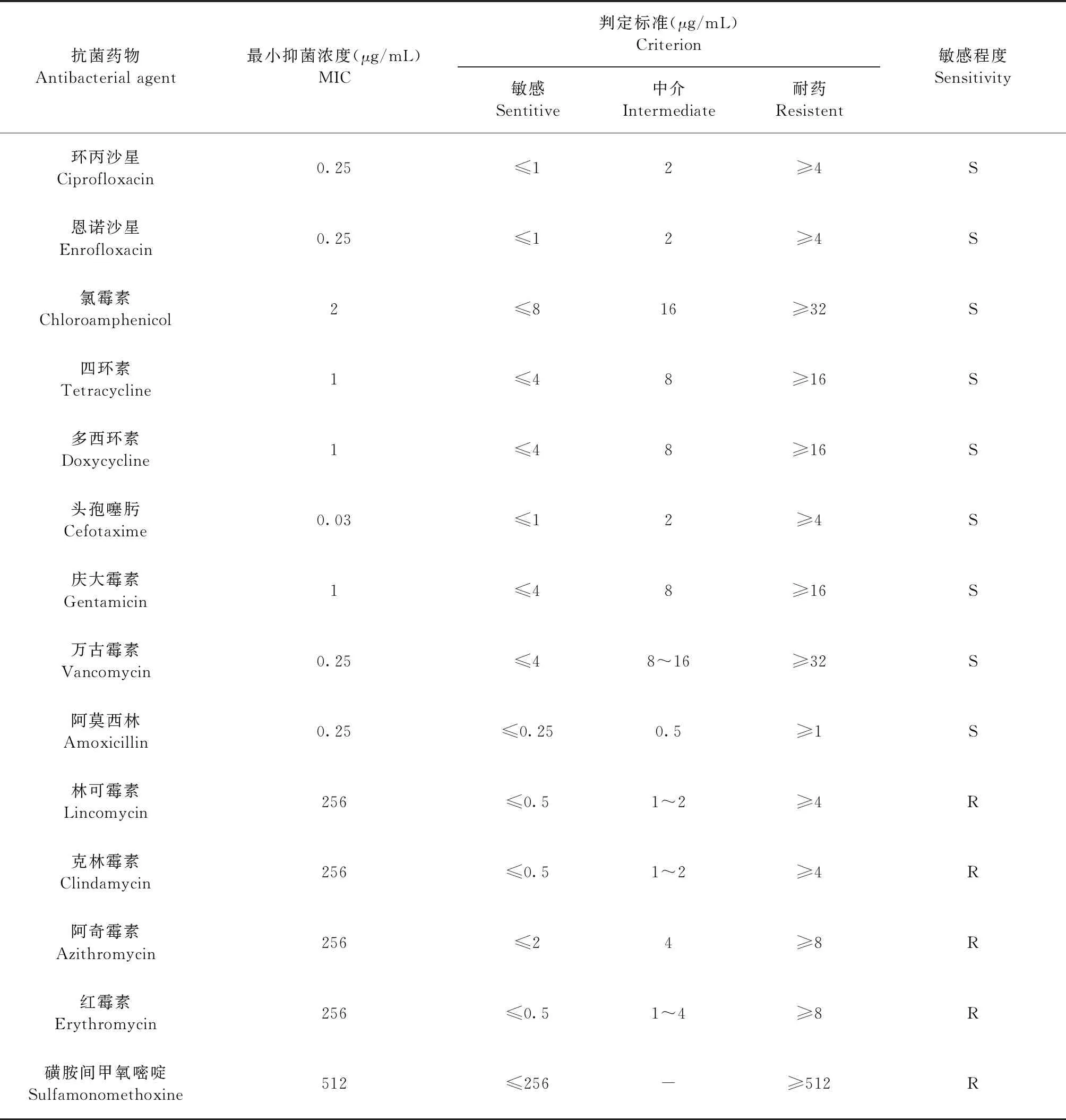
表2 SP-1藥敏試驗結果Table 2 Results of SP-1 drug sensitivity test
皮氏葡萄球菌于2002年被鑒定為一種新的血漿凝固酶陰性葡萄球菌,該細菌是人類皮膚的共生細菌[2]。與其他血漿凝固酶陰性葡萄球菌類似,皮氏葡萄球菌很少具有致病性,但偶爾也會在免疫系統受損的患者中引起感染[8]。近年來,德國、比利時、法國、韓國、意大利、巴西和墨西哥等國家相繼報道由皮氏葡萄球菌造成感染的病例,其中多數病例都是從人體血液中分離到該病原[9-10]。
2018年,印度學者首次從1只患有腹膜炎的貓體內分離到皮氏葡萄球菌,分離株對包括甲氧西林在內的36種抗菌藥物耐藥,分離株不能形成生物膜,但攜帶多個生物膜生成基因(icaA、IS257、nuc和mecA)[11]。本試驗從患有外耳炎的金毛犬耳道膿液樣品中分離到1株皮氏葡萄球菌,該菌株對林可霉素、克林霉素、阿奇霉素、紅霉素和磺胺間甲氧嘧啶表現出高度耐藥。因此,需要警惕該菌成為耐藥基因的貯存庫,通過人與寵物間的親密接觸,使耐藥基因在對人類危害較大的致病菌中水平傳播。目前,由血漿凝固酶陰性葡萄球菌引起的院內感染病例正在逐年增加,其中耐藥性葡萄球菌給臨床治療帶來巨大挑戰[3-4]。因此有必要對皮氏葡萄球菌的致病機制和耐藥機制進行深入的研究,防范該細菌對人類和動物可能造成的潛在危害。

