生物信息學分析TMEM8A在卵巢癌中的表達水平及其與患者預后的關系*
王 獻,劉 沖,郜趙偉,朱曉明,3△
1.空軍軍醫大學第二附屬醫院婦產科,陜西西安 710038;2.空軍軍醫大學第二附屬醫院檢驗科,陜西西安 710038;3.解放軍總醫院海南醫院婦產科,海南三亞 572013
卵巢癌是女性生殖系統三大惡性腫瘤之一,占女性所有惡性腫瘤的2.5%[1]。2020年統計顯示,全球卵巢癌新增約31.4萬,在所有癌癥中占1.6%;死亡人數約20.7萬,在所有癌癥中占2.1%,卵巢癌死亡率位居女性生殖系統三大腫瘤之首[2]。近年來,卵巢癌的診斷率和治療技術均有所提高,但仍有諸多問題亟待解決。因此,研究卵巢癌中表達水平顯著改變的基因,對卵巢癌患者的臨床診斷、預后監測及靶向治療藥物開發具有重要意義。
TMEM8A,或稱PGAP6,是一種對糖基磷脂酰肌醇(GPI)具有特異性的磷脂酶A2,在多種細胞表面表達,參與GPI錨成熟的脂質重塑步驟及通過維持富含cav1的質膜亞區穩定的數量,間接參與了RAC1從細胞質到質膜的易位,穩定了質膜上的RAC1[3-4]。筆者前期利用卵巢癌組織的轉錄組測序,發現TMEM8A在卵巢癌組織中表達水平升高。本文利用生物信息學分析TMEM8A表達在卵巢癌患者的預后價值、免疫細胞浸潤的關系和相關基因的篩選及功能富集分析,為探討TMEM8A在卵巢癌發生發展中的作用及臨床診療價值提供參考。
1 資料與方法
1.1TMEM8A表達差異分析 基于卵巢癌TCGA及GTEx數據庫,利用GEPIA2(http://gepia2.cancer-pku.cn/)分析TMEM8A在卵巢癌組織中表達水平的變化。|Log2FC|>1及P<0.01為差異有統計學意義。利用UALCAN(http://ualcan.path.uab.edu.)分析TMEM8A與卵巢癌患者年齡、腫瘤分級、腫瘤分期的相關性。
1.2TMEM8A預后價值分析 基于不同的GSE數據集,利用KMPlotter(http://www.kmplot.com/)分析TMEM8A與卵巢癌患者的總生存期(OS)進行相關性分析,自動選擇最優截斷點。利用GraphPad Prism 9.0繪制不同數據集生存分析森林圖。
1.3TMEM8A與免疫浸潤相關性分析 利用TIMER(http://timer.cistrome.org/)分析TMEM8A表達與卵巢癌組織免疫細胞浸潤的相關性及TMEM8A表達與免疫細胞浸潤預后價值。
1.4TMEM8A表達相關基因篩選及功能富集分析 利用LinkedOmics數據庫,篩選卵巢癌中與TMEM8A表達相關的基因(正相關及負相關基因Top50),并利用DAVID對基因進行GO及KEGG通路分析,利用R繪制氣泡圖對功能分析結果進行可視化。
1.5統計學處理 表達水平差異采用t檢驗,|Log2FC|>1及P<0.01視為差異有統計學意義。生存分析采用log-rank檢驗,以P<0.05為差異有統計學意義。免疫浸潤結果以P<0.05為差異有統計學意義。GO及KEGG通路分析結果,以P<0.05為差異有統計學意義。
2 結 果
2.1TMEM8A在卵巢癌中表達水平顯著升高 卵巢腫瘤組織中TMEM8A表達水平顯著高于正常組織,差異有統計學意義(P<0.01)(圖1A)。TMEM8A在Ⅲ期和Ⅳ期卵巢癌組織中的表達水平顯著低于Ⅱ期腫瘤(圖1B);TMEM8A表達水平與卵巢癌患者年齡呈現一定程度的正相關(圖1C),TMEM8A表達水平在不同腫瘤分級、不同種族、不同TP53突變狀態的患者之間差異無統計學意義(P>0.05)(圖1D、E、F)。
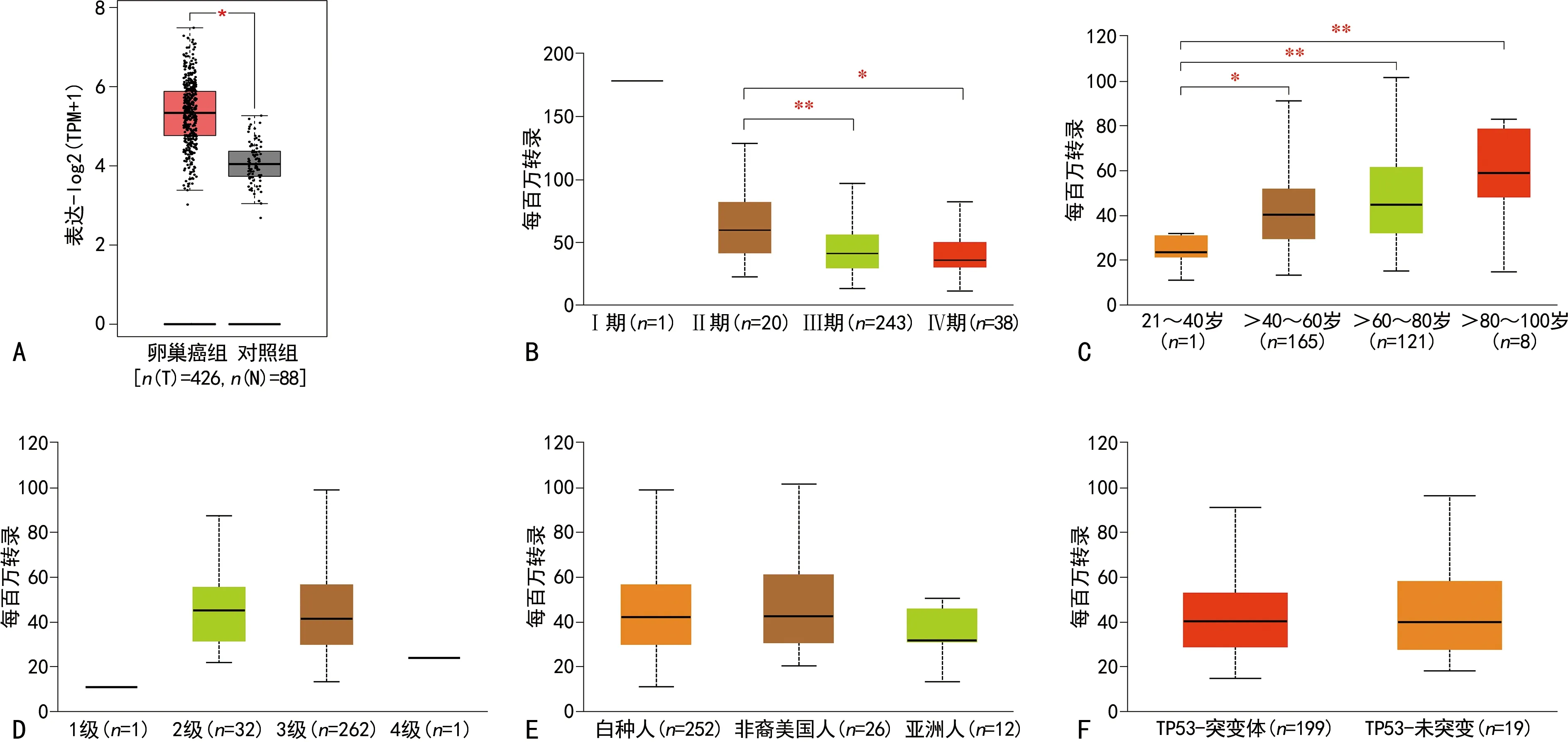
注:A為GEPIA2分析顯示TMEM8A在卵巢癌組織表達水平升高;B為TMEM8A在不同分期卵巢癌組織中的表達水平;C為TMEM8A在不同年齡段卵巢癌患者的表達水平;D為TMEM8A在不同分級卵巢癌中的表達水平;E為TMEM8A在不同種族卵巢癌患者的表達水平;F為TMEM8A在具有不同TP53突變狀態卵巢癌患者中的表達水平差異分析;*代表P<0.05,**代表P<0.01。
2.2TMEM8A在卵巢癌的預后價值分析 KMplotter分析結果顯示,TMEM8A高表達水平與卵巢癌患者預后差相關(HR=1.57,P<0.000 1),高表達水平組患者OS中位值為35個月;低表達組患者OS中位值為50.69個月(圖2A)。森林圖結果顯示,7組卵巢癌生存數據集中,TMEM8A高表達在6組中與預后差相關(HR>1),其中,在GSE19829與GSE276512比較,差異有統計學意義(P=0.033;P=0.003)(圖2B)。
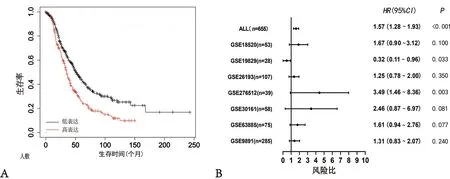
注:A為生存曲線圖顯示TMEM8A的預后價值;B為森林圖顯示TMEM8A的預后價值。
2.3TMEM8A在卵巢癌中的表達水平與免疫細胞浸潤相關性分析 TMEM8A與腫瘤組織免疫細胞浸潤的相關性分析顯示,腫瘤組織中TMEM8A表達水平與CD4+T細胞、調節性T細胞、中性粒細胞、單核細胞、腫瘤相關樹突狀細胞、自然殺傷細胞、癌癥相關成纖維細胞、內皮細胞浸潤水平呈正相關(P<0.05);與CD8+T細胞、CD4+Th1細胞、B細胞、單核細胞、漿細胞樣樹突狀細胞、常見淋巴祖細胞浸潤水平呈負相關(P<0.05),見表1。
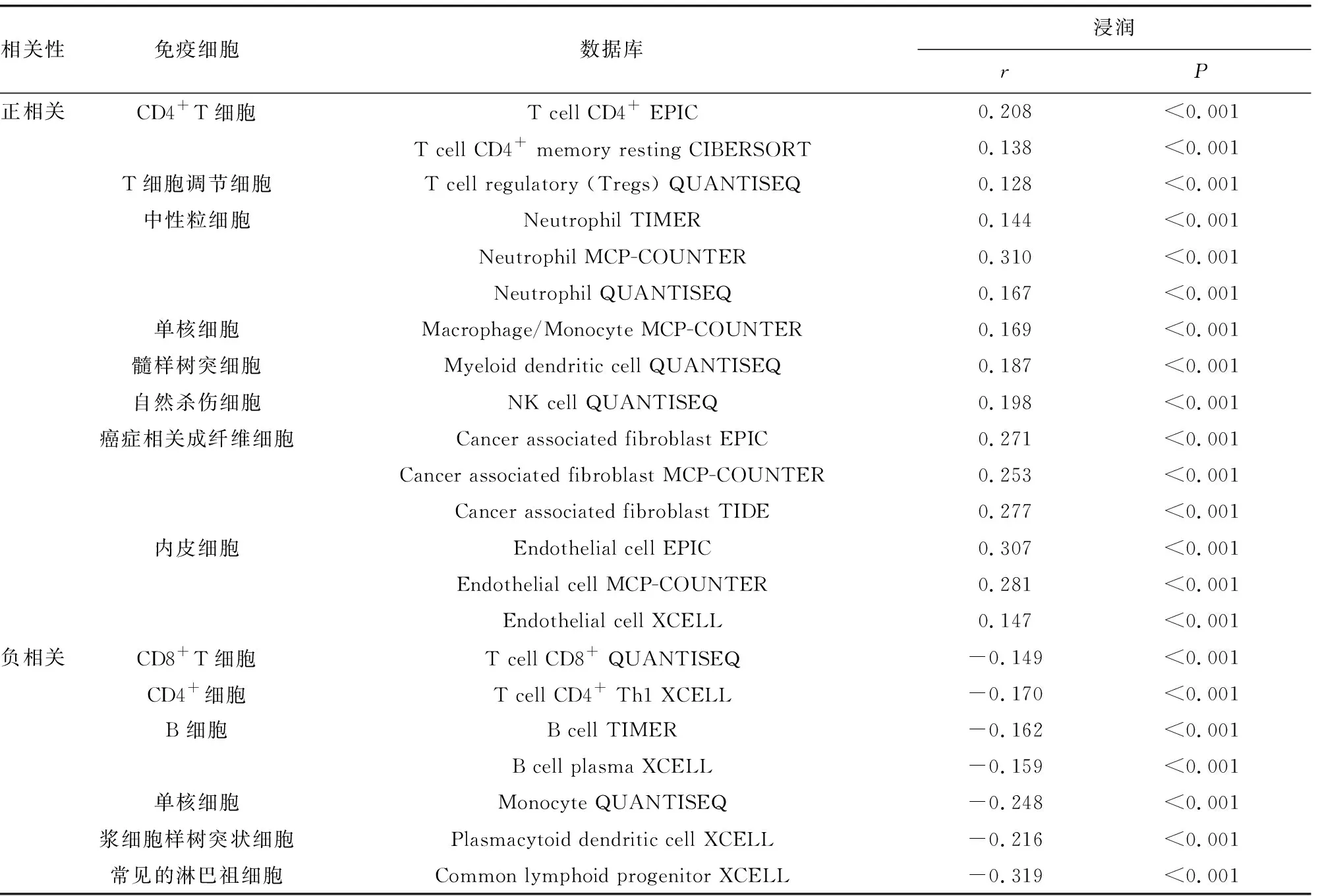
表1 TMEM8A表達與免疫細胞浸潤的相關性分析
2.4TMEM8A結合免疫細胞浸潤在卵巢癌的預后價值分析 在TMEM8A高表達的卵巢癌患者中,B細胞幼細胞高浸潤患者預后差(HR=2.84,P=0.003);中性粒細胞高浸潤患者預后差(HR=2.89,P<0.001)。在TMEM8A低表達的卵巢癌患者中,漿細胞高浸潤患者預后好(HR=0.56,P=0.017;HR=0.39,P<0.001);M1巨噬細胞高浸潤患者預后好(HR=0.55,P=0.027);M2巨噬細胞低浸潤患者預后差(HR=2.11,P=0.003);濾泡輔助T細胞高浸潤患者預后好(HR=0.49,P=0.005;HR=0.44,P=0.001)。見表2。
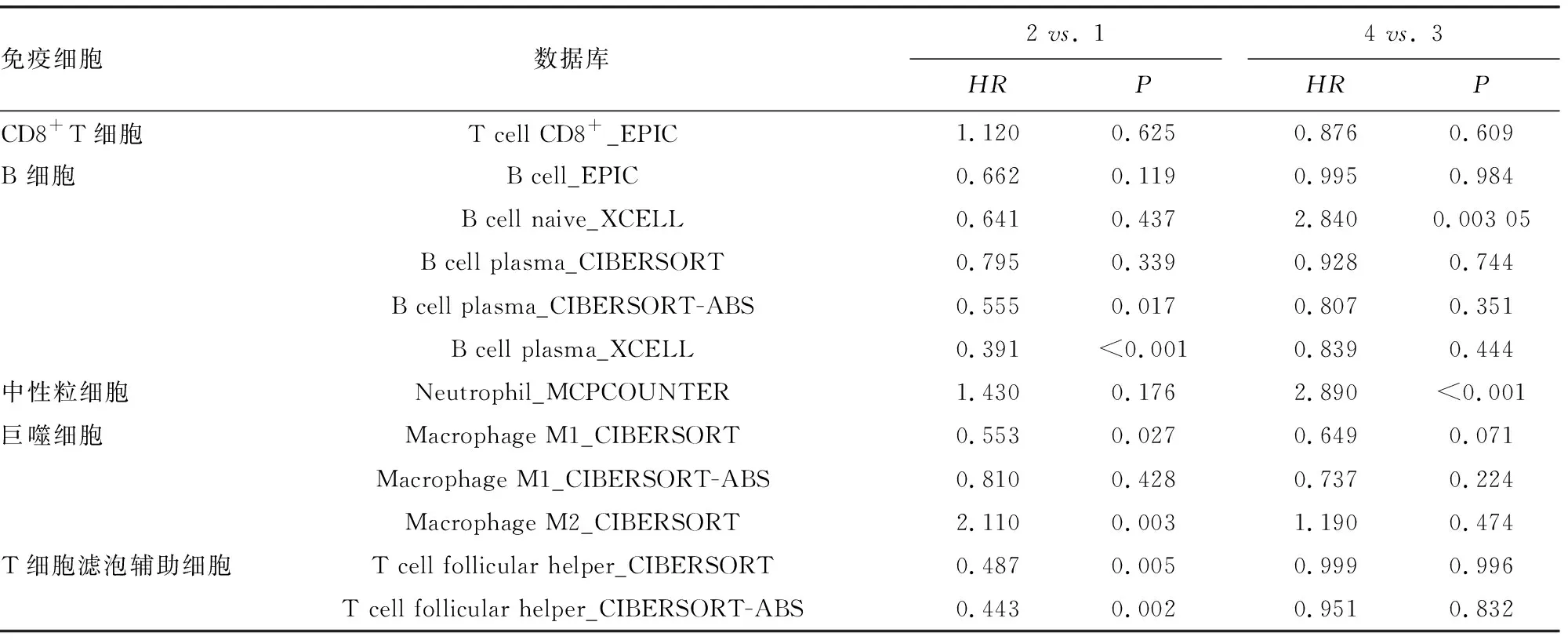
表2 TMEM8A表達結合免疫細胞浸潤在卵巢癌的預后分析
2.5TMEM8A表達相關基因篩選及功能富集分析 利用LinkedOmics數據庫篩選了TMEM8A表達水平呈正、負相關基因(Top50),TMEM8A與ITFG3(r=0.675,P<0.001)、PIGQ(r=0.672,P<0.001)、CLCN7(r=0.611,P<0.001)等基因表達水平呈正相關(圖3A),與PCBD2(r=-0.399,P<0.001)、MBLAC2(r=-0.390,P<0.001)等基因表達水平呈負相關(圖3B)。TMEM8A呈正相關基因主要參與病毒過程、蛋白質泛素化、鐵硫團簇組件等生物學過程;主要表達于溶酶體膜、雷帕霉素(TROC)復合物1和TROC復合體2;主要分子功能與連接酶活性、GTP酶激活劑活性、泛素蛋白連接酶結合有關(圖3C)。負相關基因主要參與小亞基核糖體核糖核酸的成熟、核轉錄mRNA分解代謝過程、病毒轉錄、信號識別顆粒依賴性共翻譯蛋白靶向膜、核糖體RNA加工、翻譯起始生物學過程;主要表達于細胞核與核漿;主要分子功能與聚(A)RNA結合相關(圖3D)。KEGG通路分析顯示(圖3E),正相關基因參與哺乳動物雷帕霉素(mTOR)信號通路(P=0.009);負相關基因參與核糖體形成(P=0.033)及新型冠狀病毒感染(COVID-19)(P=0.067)。
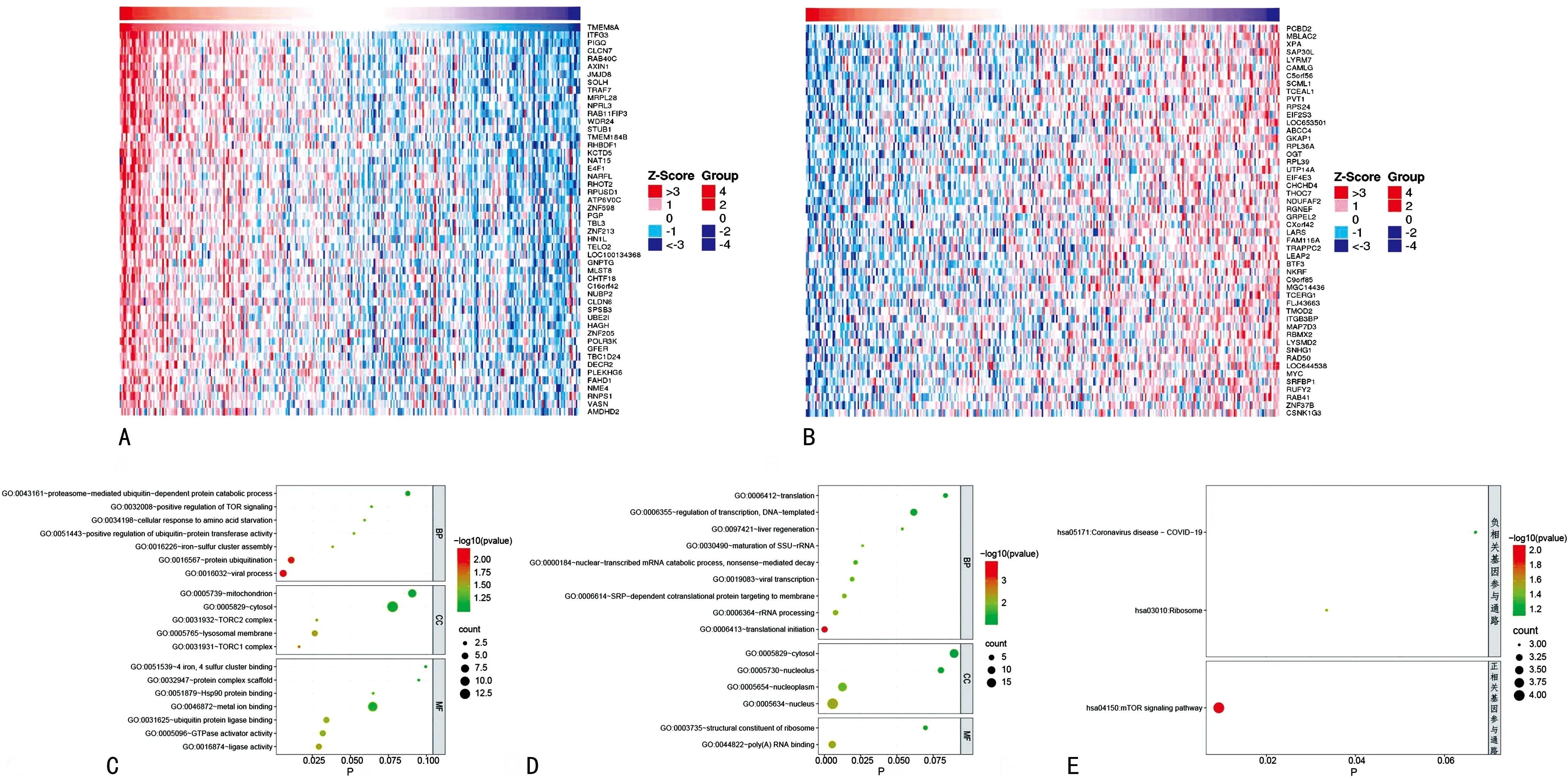
注:A為TMEM8A表達正相關基因熱圖;B為TMEM8A表達負相關基因熱圖;C為TMEM8A表達正相關基因GO分析;D為TMEM8A表達負相關基因GO分析;E為TMEM8A表達相關基因KEGG分析。
3 討 論
本研究旨在探索TMEM8A在卵巢癌中的表達水平變化及潛在預后價值。本研究發現,TMEM8A在卵巢癌組織中表達水平顯著升高;并且TMEM8A表達水平與年齡呈正相關;而在TNM分期中,Ⅱ期卵巢癌患者TMEM8A表達水平顯著高于Ⅲ期和Ⅳ期患者,TMEM8A表達隨著腫瘤分期的進展而降低的可能原因為:(1)TMEM8A的表達水平可能與卵巢癌腫瘤細胞的分化程度相關,高分化腫瘤細胞TMEM8A表達水平較高,而低分化腫瘤細胞中TMEM8A表達水平較低。如李靖等[5]研究顯示,SF3B1在胰腺癌患者中表達水平升高,但是與腫瘤分期呈負相關。(2)TMEM8A表達降低可能與其他腫瘤基因表達調控相關,在腫瘤進展中,一些腫瘤基因可能以反饋等效應影響TMEM8A的表達,從而降低其表達水平,但與TMEM8A功能機制相關的基因目前尚未明確,其確切的調控機制仍需更深入的研究。TMEM8A高表達水平的卵巢癌患者較TMEM8A低表達水平患者生存時間更短,提示TMEM8A表達水平可能成為卵巢癌患者的獨立的預后標志物。腫瘤組織中TMEM8A表達水平與CD4+T細胞、調節性T細胞、中性粒細胞、單核細胞、腫瘤相關樹突狀細胞、自然殺傷細胞、癌癥相關成纖維細胞、內皮細胞浸潤呈正相關(P<0.05);與CD8+T細胞、CD4+Th1細胞、B細胞、單核細胞、漿細胞樣樹突狀細胞、常見淋巴祖細胞浸潤呈負相關(P<0.05)。Treg細胞在免疫穩態調節方面發具有重要作用,Treg細胞可促進腫瘤細胞的免疫逃逸,促進腫瘤進展,腫瘤組織Treg細胞增多提示預后不良,研究顯示,Treg細胞可通過損害抗腫瘤免疫反應促進卵巢癌的進展,有研究表明TIGIT通過增強卵巢癌中的Tregs反應并介導了腫瘤免疫抑制[6-10]。因此,TMEM8A與Treg細胞浸潤呈正相關提示其可能在卵巢癌發生發展起促進作用。中性粒細胞參與急性損傷和修復、癌癥、自身免疫和慢性炎癥過程,并且可通過抑制免疫反應限制炎癥對組織的損害,但同樣可能抑制抗腫瘤免疫反應[11]。本研究發現在TMEM8A高表達卵巢癌患者中,中性粒細胞高浸潤的卵巢癌患者預后差,因而,TMEM8A高表達卵巢癌患者的中性粒細胞高浸潤提示預后不良。樹突狀細胞可監測機體的感染或惡性腫瘤,并激活特異性T淋巴細胞,引發特異性免疫反應;但腫瘤微環境的改變可導致其在腫瘤發展中起促進作用[12],TMEM8A在卵巢癌中表達與DC呈正相關提示其可能與腫瘤微環境改變相關。單核細胞是癌癥發生和發展的重要調節細胞,有研究證實淋巴細胞-單核細胞比值(LMR)是影響卵巢癌患者預后的獨立因素,高LMR的患者預后較好[13]。自然殺傷細胞是重要的抗腫瘤免疫細胞,其主要通過釋放穿孔素和顆粒酶誘導靶細胞凋亡介導腫瘤殺傷反應,但自然殺傷細胞活性受免疫抑制腫瘤微環境的限制,因此,腫瘤環境的自然殺傷細胞高浸潤可能存在反饋效應[14-15],TMEM8A與自然殺傷細胞相關性提示其可能與腫瘤微環境改變有關。癌癥相關成纖維細胞是卵巢癌微環境中的重要部分,其與癌細胞的相互作用促進癌癥的進展,而且,癌癥相關成纖維細胞還可以調節免疫細胞活性,抑制抗腫瘤免疫反應,因此,癌癥相關成纖維細胞在腫瘤組織的浸潤性提示可能參與腫瘤進展及抑制腫瘤免疫過程[16-17]。內皮細胞不僅可以促進腫瘤生長發育,也參與腫瘤轉移過程。另外,內皮細胞也是癌癥相關成纖維細胞的主要來源之一[18]。因此,TMEM8A與內皮細胞的浸潤相關性提示其可能參與卵巢腫瘤的進展、腫瘤免疫的抑制及癌癥相關成纖維細胞的形成。CD8+T細胞在清除細胞內感染、惡性細胞方面起著關鍵作用,并具有長期的免疫性保護,且有研究表明高CD8+T細胞浸潤患者較低CD8+T細胞浸潤患者的總生存期長[19- 20]。但是在慢性感染或癌癥的情況下,CD8+T細胞暴露于持久的抗原或炎癥信號會導致CD8+T細胞的功能逐漸惡化,這種狀態被稱為“衰竭”[21]。TMEM8A與CD8+T細胞的負相關性提示其可能參與CD8+T細胞消耗/衰竭過程。漿細胞樣樹突狀細胞是樹突狀細胞的一個亞群,能產生大量Ⅰ型干擾素(IFN-Ⅰ/α),具有調節免疫系統的先天和適應性成分的作用,是癌癥免疫的關鍵角色。MITCHELL等[22]研究表明,卵巢癌患者的漿細胞樣樹突狀細胞正常活性遭到破壞,可使其作用從免疫刺激轉變為免疫抑制,從而抑制抗腫瘤T細胞的功能。另外,本文分析顯示,TMEM8A高表達水平的卵巢癌患者中,B細胞幼細胞高浸潤患者預后差;TMEM8A低表達水平的卵巢癌患者中,漿細胞高浸潤患者預后好;濾泡輔助T細胞高浸潤患者預后好,KROEGER等[23]和LI等[24]相關研究亦有證實。在卵巢癌組織中,TMEM8A表達正相關基因主要參與病毒過程、蛋白質泛素化、鐵硫團簇組件等生物學過程。而負相關基因主要參與小亞基核糖體核糖核酸的成熟、核轉錄mRNA分解代謝過程、病毒轉錄、信號識別顆粒依賴性共翻譯蛋白靶向膜、核糖體RNA加工、翻譯起始等生物學過程。卵巢癌中TMEM8A與PIGQ、AXIN1、CLCN7基因表達水平呈正相關。PIGQ參與GPI生物合成的第一步,TMEM8A(PGAP6)是GPI的加工酶,它是一種主要定位于細胞表面的GPI特異性磷脂酶A2,通過調節Cripto-Nodal信號對胚胎發育中前后軸的形成起著至關重要的作用,GPI錨定蛋白在不同癌癥中發揮重要作用已經被證實,因而PIGQ與TMEM8A很可能通過共同參與GPI形成過程而參與腫瘤的發生發展[25]。CLCN7產物屬于CLC氯化物通道蛋白家族,氯離子通道在質膜和胞內細胞器中起重要作用,有研究表明,各種氯離子通道通過促進腫瘤-基質相互作用和促進癌癥轉移在卵巢癌發生中發揮作用[26]。AXIN1編碼的蛋白作為Wingless/Wnt信號通路的負調控因子,可誘導細胞凋亡,該基因的突變與肝細胞癌、肝母細胞瘤、卵巢子宮內膜腺癌和髓母細胞瘤相關。有研究表明,在惡性卵巢腫瘤中,Wingless/Wnt通路成分的表達增加,該信號通路可能在細胞轉化和腫瘤進展中具有促進作用[27-28]。
綜上所述,本文通過基于TCGA數據對TMEM8A(PGAP6)在卵巢癌中表達、生存分析、臨床分期分級、腫瘤免疫浸潤、以及相關基因的表達和生物分析等進行了探索,結果表明,TMEM8A在卵巢癌組織中表達水平顯著升高;TMEM8A高表達與卵巢癌患者預后差相關。然而,TMEM8A在卵巢癌發生發展中的作用機制尚待進一步實驗研究明確。

