兩種國產熒光定量PCR試劑與Roche定量試劑的比較*
楊鑫城,單幼蘭
重慶醫科大學附屬第二醫院感染病科,重慶400010
乙型肝炎(下稱乙肝)病毒(HBV)感染是一個全球性的公共健康問題,據世界衛生組織估計,2019年全世界約有2.96 億慢性乙肝患者[1]。我國是全球HBV感染率最高的國家,大約有9 000萬HBV感染者[2]。HBV具有高度傳染性,可以通過血液、性接觸或者母嬰傳播,感染后可導致急或慢性肝炎、肝硬化甚至肝癌。還有研究表明HBV感染不僅可以增加肝癌風險,還可以增加其他癌癥的發生率,例如胃癌、胰腺癌等[3]。乙肝核酸(HBV-DNA)定量測定在乙肝患者的臨床治療過程中有著極為重要的參考價值,準確定量血清中的HBV-DNA對醫生的診斷和用藥非常重要[4-5]。HBV-DNA還是直接反映HBV復制狀態及傳染性的最佳指標[6],HBV-DNA的含量能直接反映病毒在體內存在的數量、是否傳染,傳染性有多強。此外,國外報道稱,較高濃度的HBV-DNA與肝細胞癌的發病率和快速進展高度相關[7]。近年來,高靈敏度HBV-DNA技術因其檢測下限低和線性范圍廣等優勢,越來越受到臨床醫生的關注,許多專家和指南也將高靈敏度HBV-DNA檢測結果作為HBV核苷酸藥物治療終點的重要指標[8]。國內有很多不同廠家生產的HBV-DNA熒光定量聚合酶鏈反應(RT-qPCR)試劑盒,不同試劑盒的性能存在一定差異,導致不同醫院之間的結果難以進行比較[9]。因此,本文選用國內兩種HBV-DNA RT-qPCR試劑盒及目前國際廣泛應用的Roche試劑對71例臨床乙肝患者血清進行檢測,并對兩種試劑的一些性能參數進行驗證,比較檢測結果之間的差異性和相關性,探討各方法之間臨床應用價值,以選擇更適合本實驗室的試劑,現報道如下。
1 資料與方法
1.1一般資料 收集2019年10月至2020年3月在本院感染科實驗室做高靈敏度HBV-DNA定量檢測的門診及住院乙肝患者標本71例,標本以4 000 r/min的速度離心5 min,將血清分裝至無菌EP管中,于-20 ℃冰箱冷凍保存,最長保存時間不超過6個月。HBV-DNA標準品(1.0×108IU/mL,批號300022-201601)購自中國食品藥品檢定研究院,使用陰性血清10倍梯度稀釋至相應濃度值備用。
1.2儀器與試劑 核酸擴增儀為Applied Biosystem 公司提供的ABI-7500熒光定量分析儀和羅氏公司的Cobas AmpliPrep/Cobas Taqman 48系統;A試劑由上海復星醫學有限公司提供,采用臺灣圓點奈米技術股份有限公司提供的FD-SLA-32型全核酸自動提取儀提取核酸;B試劑由北京納捷診斷試劑有限公司提供,采用靜態核酸制備技術對核酸進行提取。
1.3方法 取用Roche定量試劑檢測過的71例血清標本,分別用A、B兩種試劑進行平行檢測,測定標本的HBV-DNA載量,所有操作均嚴格按照試劑盒和儀器說明書進行。
1.3.1A試劑檢測方法 在96孔預裝板第一列中加入300 μL標本,放入核酸提取儀進行提取,35 min后取提取結束的HBV-DNA 20 μL加入含有30 μL反應液的反應管中,低速離心后置RT-qPCR儀上進行檢測。其擴增條件為50 ℃反應2 min,94 ℃保溫5 min,94 ℃ 10 s、60 ℃ 45 s,5個循環,再按94 ℃ 10 s、60 ℃ 45 s,循環40次,擴增總時間約為80 min。
1.3.2B試劑檢測方法 將100 μL待測標本加入分裝有裂解液的PCR反應管中,輕輕吹打混勻,靜置 5 min,移至磁力架靜置3 min,吸棄上清液,加入250 μL漂洗液,靜置2 min,吸棄上清液。加入45 μL PCR反應液即可上機檢測。擴增條件為50 ℃反應2 min,95 ℃保溫5 min,再按95 ℃ 15 s、62 ℃ 45 s,循環50次,擴增過程需要90 min。
1.3.3Roche定量試劑檢測方法 取750 μL待測標本加入樣品管,移至Cobas AmpliPrep儀進行核酸提取,一個標本大概需要45 min可以提取完成,提取結束后轉移至Cobas Taqman 48儀進行擴增,擴增過程需要150 min。
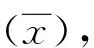
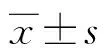
2 結 果
2.13種試劑檢出率及病毒載量分析 在檢測的71例血清標本中,A試劑檢出陽性標本49例,檢出率為69.01%;B試劑檢出陽性標本60例,檢出率為84.51%;Roche試劑檢出陽性標本44例,檢出率為61.97%,三者比較差異有統計學意義(χ2=9.327,P<0.05)。A試劑HBV-DNA病毒載量檢測結果為(2.73±0.82)Log10IU/mL,B試劑HBV-DNA病毒載量檢測結果為(3.38±0.84)Log10IU/mL,Roche試劑HBV-DNA病毒載量檢測結果為(3.10±0.88)Log10IU/mL。A、B試劑分別與Roche試劑定量結果比較,差異均無統計學意義(P=0.282、0.611)。而A試劑與B試劑定量結果比較,差異有統計學意義(P=0.039)。見表1。
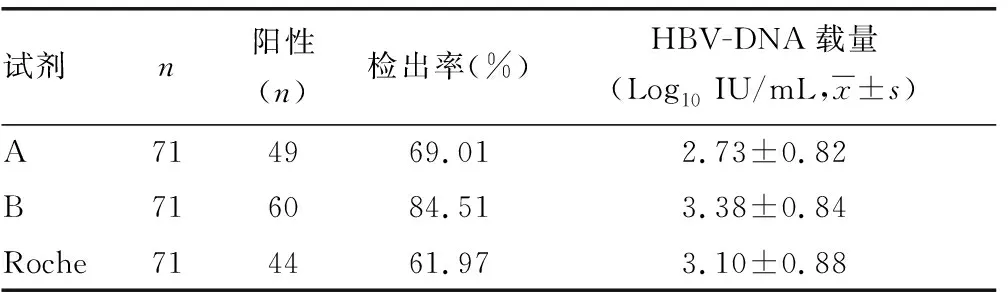
表1 三種試劑檢出率及病毒載量結果比較
2.2兩種試劑與Roche試劑檢測結果的陰陽性符合率比較 71例標本中,A試劑與Roche試劑的陽性符合率為90.91%(40/44),陰性符合率為66.67%(18/27),總符合率為81.69%;B試劑與Roche試劑的陽性符合率為97.72%(43/44),陰性符合率為37.04%(10/27),總符合率為74.65%。根據檢測結果,A試劑與Roche試劑的Kappa值為0.597,但差異無統計學意義(P=0.267),兩種試劑一致性中等;B試劑與Roche試劑的Kappa值為0.393,兩種試劑一致性一般,差異有統計學意義(P<0.05)。見表2。
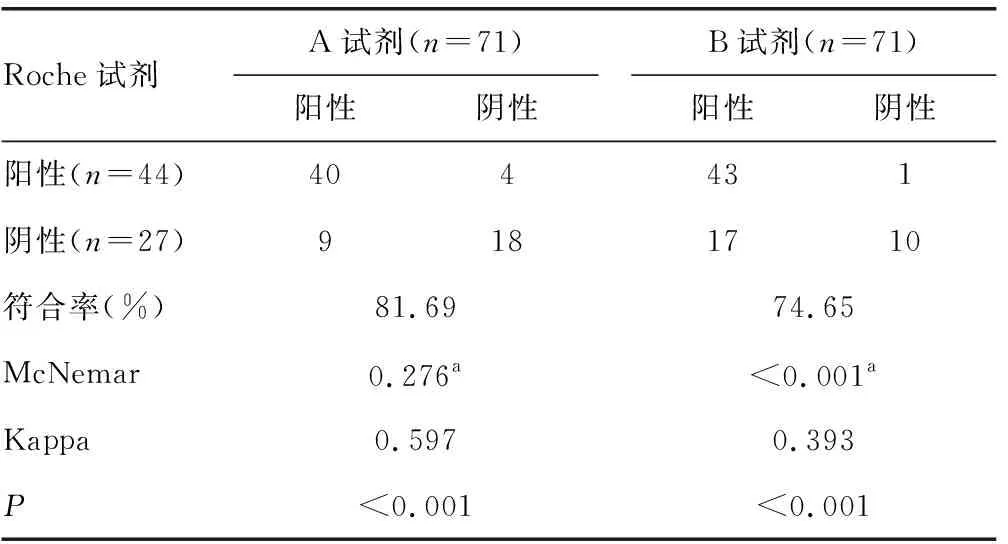
表2 A、B兩種試劑與Roche試劑檢測結果陰陽性符合率檢驗
2.3兩種試劑與Roche試劑檢測結果的相關性分析 3種試劑對71例血清標本進行檢測,其中32例標本的3種試劑檢測結果均有數值,其余至少有一種試劑未檢測出具體數值。對A、B試劑和Roche試劑檢測有數值的結果取對數值后進行相關性分析。A試劑與Roche、B試劑與Roche的分別為0.896、0.908(均P<0.05),A試劑與Roche、B試劑與Roche的相關線性回歸方程分別為Y=0.763X+0.590(R2=0.803)、Y=0.760X+1.100(R2=0.825)。見表3。

表3 A、B兩種試劑與Roche試劑的相關性分析
2.4A、B試劑的性能驗證
2.4.1最低檢測限及最低定量限 A試劑重復檢測8次濃度為20 IU/mL的標本,檢出率為100.00%,提示該試劑的最低檢測限為20 IU/mL,重復檢測8次濃度為100 IU/mL的標本,檢出率為100.00%且對數值結果偏差均在±0.4范圍內,提示該試劑的最低定量限為100 IU/mL;B試劑重復檢測8次濃度為20 IU/mL的標本,檢出率為100.00%且87.50%的對數值結果偏差在±0.4范圍內,提示該試劑的最低檢測限和最低定量限均為 20 IU/mL。
2.4.2線性范圍 A試劑數據處理后得到的回歸方程為:Y=-0.996X+8.925,R2=0.999。見圖1。通過最低定量限實驗及此實驗驗證可知,A試劑在1.0×102~1.0×108IU/mL濃度范圍內線性良好。
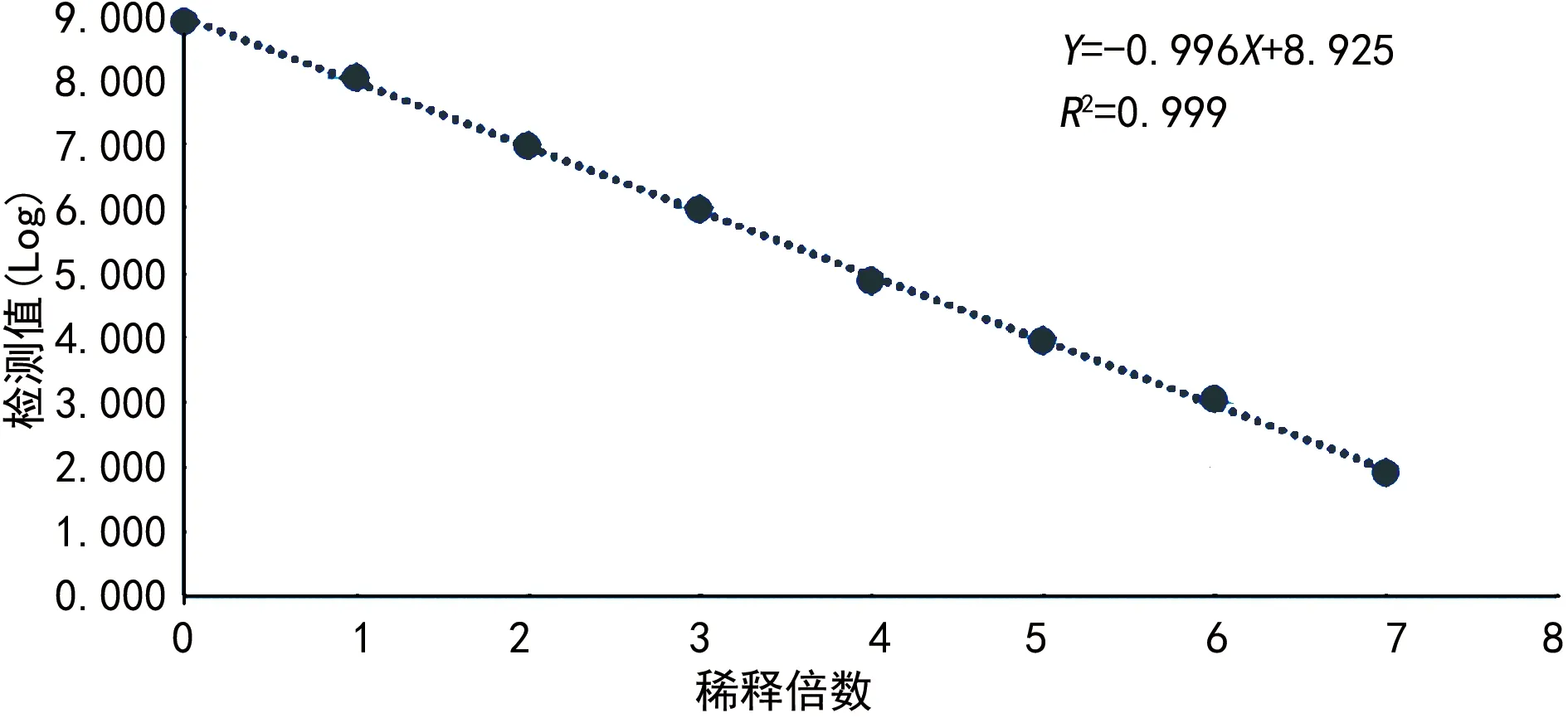
圖1 A試劑線性回歸直線
B試劑數據處理后得到的回歸方程為:Y=-0.985X+8.575,R2=0.999。見圖2。通過最低定量限實驗及此實驗驗證可知,B試劑在2.0×101~1.0×108IU/mL濃度范圍內線性良好。
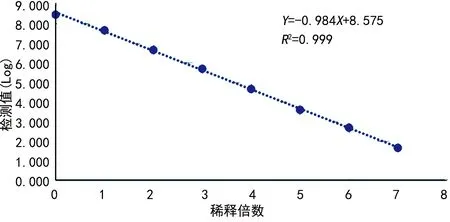
圖2 B試劑線性回歸直線
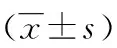
2.4.4正確度評價 根據偏倚=(實驗方法結果-參比方法結果)/參比方法結果×100.00%,A、B兩種試劑檢測均有數值的結果剔除離群值后計算偏倚分別為-6.69%,6.08%。兩種試劑偏倚均在±7.50%內,正確度良好,但B試劑與Roche試劑之間的偏倚絕對值更小,可比性更高。
3 討 論
盡管現在有很多有效的抗病毒藥物和疫苗,但是HBV感染仍然是世界范圍內一個重大的公共衛生挑戰。為了判斷HBV感染的階段或者HBV感染者肝臟炎性疾病的發生進展,需要進行HBV-DNA定量檢測。HBV-DNA定量檢測在判斷疾病活動性、制訂抗病毒治療方案、治療監測以及判斷治療終點中均起到重要作用[14]。目前,定量檢測HBV-DNA的方法有很多種,其中,熒光定量PCR是常用的檢測手段[15]。Roche試劑具有較高的靈敏度、精密度、重復性,被國際公認為是HBV-DNA定量的參比試劑[16],其最低檢測限為20 IU/mL,但價格昂貴,難以在基層醫院廣泛使用。A試劑核酸提取采用的是目前國內常用的磁珠分離技術,最低檢出限為20 IU/mL,雖然其最低檢測限與Roche試劑的一致,但其最低定量限為100 IU/mL,高于Roche試劑的最低定量限20 IU/mL,這意味著使用A試劑進行檢測時,100 IU/mL以下的病毒載量無法準確定量,甚至有無法檢出的可能性。而B試劑所采用的是一種簡稱“靜態核酸制備技術”的方法,標本處理和檢驗在一個PCR反應管中完成,其最低檢測限和最低定量限均為20 IU/mL,可以達到和Roche試劑同一個靈敏水平。在此次研究中,有2例標本A試劑的檢測結果偏低,比B試劑和Roche試劑低了3個數量級以上,原因可能與不同基因型病毒株感染或病毒發生變異造成的引物探針不能有效結合有關。因此,對于實驗室檢測結果與臨床癥狀嚴重不符的標本,有必要采用不同的試劑盒進行復核,以保證結果的準確性。
研究結果顯示,A、B試劑的檢出率均高于Roche試劑。不同試劑間檢測結果的差異考慮可能與試劑引物擴增序列,或者某些乙肝病毒發生前區變異有關[9],也可能與試劑的質量或操作誤差等有關[17]。此次結果與既往的部分報道[18-19]不一致,這些實驗發現國產試劑的陽性率低于進口試劑,而此次實驗發現,此兩種國產試劑的檢出率均高于Roche試劑。但此種差異是否是由于準確度或靈敏度所導致的還需要更進一步的研究。近年來國內也有不少針對國產高靈敏度HBV-DNA定量的方法學研究報道[20-21]。本實驗還將A、B試劑與Roche試劑病毒載量的結果進行了比較,發現A、B試劑與Roche試劑定量結果之間差異無統計學意義,說明兩種試劑定量結果與Roche試劑無顯著差別。這與周美美等[19]報道有所不同,說明近年來一些國產HBV-DNA試劑定量性能方面逐漸優化,可以和Roche試劑相媲美。而且本研究結果發現B試劑的定量結果稍高,這可能與其核酸提取的方式有關,其核酸提取和擴增過程均在一個反應管中進行,減少了HBV-DNA提取過程的各種損耗。本研究將兩種國產試劑與Roche試劑的檢測結果在陰陽性符合率方面做了比較,結果顯示,A、B試劑與Roche試劑的符合率分別為81.69%、74.65%。相比之下,B試劑與Roche試劑的符合率偏低,這是因為在Roche試劑44例陽性標本中,B試劑檢出了43例,僅有1例未檢出,而Roche試劑27例陰性標本中,B試劑檢出了17例陽性,陽性符合率達到了97.72%,陰性符合率僅有37.04%。分析認為可能是近年來一些國產熒光定量PCR試劑的靈敏度逐漸提高,可以檢測到Roche試劑無法檢測到的低濃度值,導致陰陽性符合率有較大的差異,期待后續補充完善相關實驗。在定量方面,A試劑與Roche試劑的r為0.896,B試劑與Roche試劑的r為0.908。說明兩種試劑的檢測結果與Roche都有良好的相關性,B試劑相對更好一些。此外,本研究結果表明,A、B試劑的最低檢測限均不大于30 IU/mL,符合《乙型肝炎病毒脫氧核糖核酸定量檢測試劑注冊技術審查指導原則》中限定HBV-DNA注冊試劑的最低檢測限[10]。極低水平的HBV-DNA在部分人群中有著重要的臨床意義[8],行HBV-DNA 檢測能從HBV表面抗原無反應性標本中有效發現低病毒載量的乙肝患者,特別是能有效檢出OBI和HBeAg(-)慢性乙型肝炎患者,防止血清學漏檢[22]。此外,本研究發現,A、B試劑檢測值與理論值之間線性良好,分別在1.0×102~1.0×108IU/mL和2.0×101~1.0×108IU/mL濃度范圍內成線性,r2≥0.995,符合要求。A、B試劑說明書所述的最高定量限分別1.0×109IU/mL和2.0×109IU/mL,但是本次實驗未取得濃度高于1.0×109IU/mL的標本,故僅驗證108IU/mL以下的線性。驗證的低、高濃度標本重復性、精密度、CV均符合要求,驗證通過,具有良好的重復性。本文還以Roche試劑為參比試劑,A、B試劑為實驗試劑,分別驗證了A、B試劑的正確度,平均偏倚均小于±7.5%,可以滿足臨床應用的要求。
通過比較可以發現B試劑的性能相對A試劑更加優越,B試劑核酸提取率較高,靈敏度和準確度也較高,重復性更好,且具有更寬的線性范圍,但是自動化程度相對較低。總體來說,近年來我國國產的乙肝定量試劑性能逐漸優化,定量結果方面與進口試劑有良好的相關性,可以滿足臨床患者治療監測的要求。各實驗室應綜合考慮,在保證檢驗質量的前提下,選擇符合自己實驗室的試劑。通過進行A、B試劑的性能驗證實驗及與Roche試劑對臨床標本的檢測結果比較可知,B試劑更適合本實驗室,選擇B試劑將可以檢測到更低水平的HBV-DNA,核酸獲取率也更高,能為臨床提供更準確的報告。

