miR-129-3p與LPAR3在肝癌細胞中的表達水平及其靶向關系研究*
賈明君,王義真,常聰穎,張銀閣
1.邢臺市第二醫(yī)院肝病一科,河北邢臺 054000;2.邢臺市第三醫(yī)院肝膽外科,河北邢臺 054000
肝癌是發(fā)生在肝臟的惡性腫瘤,與飲酒、病毒性肝炎、食用霉變食物相關,患者早期常無特殊癥狀,是我國常見的惡性腫瘤之一[1-2]。我國肝癌患者年齡為40~50歲,男性比女性多見,高發(fā)于東南沿海地區(qū),其病因和發(fā)病機制尚未明確[3-4]。研究表明表觀遺傳學尤其是微小RNA(miRNA)在肝癌的發(fā)生發(fā)展中發(fā)揮著重要的調控作用[5-6],如miR-129家族的miR-129-5p可通過靶向鈣調素依賴性蛋白激酶Ⅳ(CAMK4)抑制肝癌生長[7],或可通過抑制Wnt信號通路減弱肝癌細胞的增殖并促進其凋亡[8],但miR-129-3p在肝癌中的表達水平情況尚不清晰。溶血磷脂酸受體3(LPAR3)和PI3K信號通路參與多種癌癥進展,LPAR3異常表達參與調控了卵巢癌等癌癥的耐藥性[9-10],PI3K/AKT信號通路也參與了肝癌細胞的增殖、凋亡、侵襲等過程[11-12],但miR-129是否可以通過靶向調控LPAR3并影響PI3K/AKT信號通路尚不清晰。因此,本研究將通過多種肝癌細胞系分析miR-129-3p和LPAR3的表達水平,探究其靶向關系,并通過裸鼠荷瘤實驗確定miR-129-3p對腫瘤發(fā)展及PI3K/AKT信號通路的影響,為miR-129-3p在肝癌的作用提供分子機制和理論基礎。
1 材料與方法
1.1材料 人肝細胞及肝癌癌細胞株HL-7702、HepG2、BEL-7402、SMMC-7721購自中國科學院典型培養(yǎng)物保藏委員會細胞庫/中國科學院上海生命科學研究院細胞資源中心。
SPF級雌性裸鼠,(20±2)g,20只,購于北京科興中維生物技術有限公司[SYXK(京) 2019-0052],18~22 ℃,濕度50%~60%,氨濃度≤20 ppm,換氣次數(shù)10~20次/小時,適應性飼養(yǎng)1周分為對照組和miR-129-3p組。
1.2儀器與試劑 RPMI-1640及DMEM購于美國gibico公司,胎牛血清和青鏈霉素購于澳大利亞Ausbian公司;10 cm培養(yǎng)皿、15 mL離心管、1.5 mL EP管等試驗耗材購于美國Corning公司;miR-129-3p質粒購于廣州Ribobio公司;miR-129-3p、LPAR3、PI3K及AKT引物由生工生物工程(上海)股份有限公司設計并合成;ABI 7500 qPCR儀購于美國ABI公司;Western blot電泳儀購于美國bio-rad公司。
1.3方法
1.3.1qPCR檢測細胞及組織中miR-129-3p、LPAR3、PI3K、AKT表達 細胞采用1 mL Trizol 提取總RNA;腫瘤組織采用液氮中進行研磨,加入1 mL Trizol 提取總RNA;嚴格按照miRNA cDNA Synthesis Kit試劑盒逆轉錄試劑盒和SYBR Green PCR Master Mix Kit PCR試劑盒進行逆轉錄并通過qPCR儀進行表達水平檢測,所有操作在冰上進行并避免RNA酶污染。7500 Fast系統(tǒng)進行實時熒光定量PCR的條件:預變性95 ℃ 10 min,變性95 ℃ 10 s,退火60 ℃ 30 s,延伸72 ℃ 20 s,35個循環(huán),引物由生工生物工程(上海)股份有限公司設計并提供,分別使用U6和GHAPDH分別作為內參,以2-ΔΔCt計算miR-129-3p、LPAR3、PI3K、AKT相對表達水平。見表1。

表1 qPCR檢測中不同基因的引物序列

續(xù)表1 qPCR檢測中不同基因的引物序列
1.3.2熒光報告酶實驗 MIRDB生物信息學軟件預測miR-129-3p在LPAR3上的結合關系,熒光素酶報告實驗驗證miR-129-3p與LPAR3基因的靶向關系,由廣州Ribobio公司構建并提供LPAR3野生型(WT)和突變型(MUT)報告基因質粒,并分別與miR-129-3p mimic或NC質粒轉染至細胞中。轉染48 h后,按照Dual Luciferase reporter Assay System說明書分別檢測螢火蟲熒光素酶活性和海腎熒光素酶活性,以螢火蟲熒光素酶/海腎熒光素酶比值表示熒光素酶相對活性,實驗重復3次。
1.3.3細胞培養(yǎng)及轉染條件 各組細胞培養(yǎng)條件:RPMI-1640/DMEM完全培養(yǎng)液(內含10%胎牛血清、青霉素100 μg/mL、鏈霉素100 μg/mL ),置CO2培養(yǎng)箱內,5% CO2,37 ℃靜置培養(yǎng);細胞轉染:用胰酶消化細胞后重選,嚴格按照轉染試劑盒l(wèi)ipo3000(11668-027,Invitrogen公司)說明書將NC和miR-129-3p質粒進行轉染,6~8 h后,更換成完全培養(yǎng)基重新加入完全培養(yǎng)基,置于5% CO2培養(yǎng)箱中37 ℃培養(yǎng),用于后續(xù)各組實驗。
1.3.4裸鼠荷瘤實驗 將野生型人肝癌細胞HEPG2和轉染miR-129-3p的細胞調整至2×107個/毫升的細胞懸液。將所得細胞懸液以1 mL無菌注射器接種于20只裸鼠右側腋下皮下,注入細胞懸液每只裸鼠注射0.2 mL。對照組(n=10)注射野生型HEPG2細胞,miR-129-3p組裸鼠(n=10)注射轉染miR-129-3p的HEPG2細胞,7 d后測量腫瘤體積,建模成功的判斷標準:皮下瘤塊體積≥0.5 cm3,腫瘤生長達到標準的入組進入后續(xù)分組及實驗,成瘤后每3天用游標卡尺測量皮下瘤塊的長短徑,計算腫瘤體積=長徑×短徑2×1/2,連續(xù)21 d,繪制兩組裸鼠腫瘤生長曲線及每只裸鼠腫瘤生長曲線。
1.3.5Western blot 檢測蛋白表達 取適量腫瘤組織液氮下研磨,加入1 mL RIPA蛋白裂解液冰上提取細胞總蛋白,使用BCA法測定蛋白濃度。加入5×SDS的蛋白上樣緩沖液95 ℃ 10 min煮沸后備用。將樣品分別加入不同的泳道進行聚丙烯酰胺凝膠電泳,濃縮膠電壓80 V 10 min,分離膠電壓120 V 1.5 h,后轉至PVDF膜,用5%脫脂奶粉封閉。加入特異性一抗LPAR3 Antibody(1∶1 000,PA5-27074,Thermer fisher,美國),PI3K Antibody(1∶1 000,ab125633,abcam,英國),AKT(1∶1 000,ab8805,abcam,英國)和GAPDH(1∶10 000,ab8245,abcam,英國)于4 ℃冰箱過夜。TBST洗膜3次,每次5 min,加入特異性的羊抗兔二抗(1:2 000),孵育1 h。TBST洗膜3次,每次5 min,采用ECL化學發(fā)光液曝光顯影,使用Photoshop圖像分析軟件系統(tǒng)進行半定量分析。
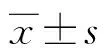
2 結 果
2.1miR-129-3p在肝組織和癌旁組織中的表達比較 如表2所示與對照組正常肝細胞相比,肝癌細胞HepG2、BEL-7402、SMMC-7721中miR-129-3p相對表達水平顯著降低,差異有統(tǒng)計學意義(P<0.01)。
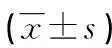
表2 不同細胞系中miR-129-3p 和 LPAR3相對表達水平的比較
2.2miR-129-3p與LPAR3的靶向關系確定 生物信息學軟件MIRDB預測LPAR3為miR-129-3p具有靶向關系,進一步通過熒光報告實驗證實了在HL-7702、HepG2、BEL-7402、SMMC-7721 4種細胞系中miR-129-3p與LPAR3均具有靶向關系,差異具有統(tǒng)計學意義(P<0.01),見圖1。

注:A為HL-7702細胞;B為HepG2細胞;C為BEL-7402細胞;D為SMMC-7721細胞。
2.3miR-129-3p對裸鼠腫瘤生長的抑制作用 兩組裸鼠荷瘤后精神狀態(tài)均較好、活動頻繁、飲食飲水量正常。荷瘤第7天對小鼠進行篩選,各組有10只裸鼠腫瘤體積≥0.5 cm3且大小均一,成瘤率為71%,腫瘤體積未達到實驗標準的未入組本試驗。如圖2所示,miR-129-3p組裸鼠腫瘤體生長速度顯著低于對照組,腫瘤積顯著低于對照組,由此可見腫瘤生長受到顯著抑制,差異有統(tǒng)計學意義(P<0.01)。

注:A為腫瘤生長曲線;B為小鼠活體成像。
2.4腫瘤組織miR-129-3p、LPAR3、PI3K、AKT的表達水平 與對照組相比,miR-129-3p相對表達水平顯著升高,LPAR3、PI3K、AKT顯著降低,差異有統(tǒng)計學意義(P<0.01),見表3。
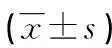
表3 qPCR檢測腫瘤組織miR-129-3p、LPAR3、PI3K、AKT相對表達水平
2.5腫瘤組織LPAR3、PI3K、AKT蛋白的相對表達水平 與對照組相比,miR-129-3p組腫瘤組織LPAR3、PI3K、AKT顯著降低,差異有統(tǒng)計學意義(P<0.01),見表4。
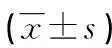
表4 腫瘤組織LPAR3、PI3K、AKT相對表達水平
3 討 論
肝癌是肝臟惡性腫瘤,可分為原發(fā)性和繼發(fā)性兩大類。原發(fā)性肝臟惡性腫瘤起源于肝臟的上皮或間葉組織,是我國高發(fā)的危害極大的惡性腫瘤;繼發(fā)性肝癌與原發(fā)性肝癌相比較較為少見,繼發(fā)性或稱轉移性肝癌系指全身多個器官起源的惡性腫瘤侵犯至肝臟,一般多見于胃、膽道、胰腺、結直腸、卵巢、子宮、肺、乳腺等器官惡性腫瘤的肝轉移[13-14]。MiRNA是多種癌癥發(fā)生發(fā)展的重要調控分子,尤其是參與了肝臟細胞分化和組織發(fā)育過程中的基因的轉錄后調控過程[15-16]。研究表明miR-129對肝臟疾病發(fā)展中具有調控作用,如miR-129-5p在非酒精性脂肪肝(NAFLD)患者中顯著異常表達,并且異常表達的MiR-129-5p在NAFLD患者可能是一種潛在的診斷生物標志物[17],也有研究通過在碳CCl4大鼠模型證實了升高的miR-129-5p可通過PEG3的NF-κB信號通路減輕肝纖維化[18]。本研究通過3種肝癌細胞系及對照細胞系證實了miR-129-3p在3種肝癌細胞中均出現(xiàn)顯著低表達,提示miR-129-3p可能對肝癌細胞具有抑制作用,因此本實驗進行了裸鼠荷瘤實驗進一步探究過表達miR-129-3p是否會干預肝癌細胞在小鼠體內的增殖,結果證實轉染miR-129-3p的肝癌細胞在小鼠體內增殖顯著降低,腫瘤生長受到顯著抑制,由此提示:miR-129-3p對肝癌的發(fā)生發(fā)展具有顯著的抑制作用。
LPAR3主要位于細胞的細胞質中,編碼G蛋白耦聯(lián)受體家族以及EDG蛋白家族的一個成員。該蛋白作為溶血磷脂酸的細胞受體發(fā)揮作用,并介導溶血磷脂酸誘發(fā)的鈣動員。該受體主要與G(q/11)α蛋白結合可通過吸附miRNA影響基因表達,尤其可以激活RAS/MAPK和PI3K/AKT通路[10-19]。研究表明上調的miR-15b通過靶向LPAR3抑制PI3K/AKT通路,進而緩解卵巢癌[20],但是miR-129-3p是否可以靶向LPAR3進而調控PI3K/AKT從而發(fā)揮抑制腫瘤作用上不明確,因此本研究首先通過生物信息學分析軟件DBmiR預測了miR-129-3p與LPAR3具有調控作用,本研究進一步在3種肝癌細胞和1種對照細胞中通過熒光報告實驗證實了miR-129-3p與LPAR3的靶向作用,由此證實在細胞水平上,miR-129-3p與LPAR3的調控作用。為了進一步在體內實驗中證實這種靶向調控關系,本文通過裸鼠實驗,分別荷瘤野生型HepG2和轉染miR-129-3p的HepG2細胞,證實了在過表達miR129-3p的小鼠腫瘤組織中,LPAR3出現(xiàn)了顯著低表達,這與細胞學實驗結果一致,進一步在體內實驗證明了miR-129-3p與LPAR3的靶向作用。由于LPAR3可以調控PI3K/AKT信號通路活性[20-21],本研究探究了腫瘤組織中的PI3K/AKT表達水平,結果證實低表達LPAR3會抑制PI3K和AKT的mRNA及蛋白表達水平,由此推測在肝癌細胞中,miR-129的高表達會靶向LPAR3基因,調控PI3K/AKT信號通路,實現(xiàn)抑制腫瘤發(fā)展的作用。
綜上所述,本研究通過細胞學實驗和體內裸鼠荷瘤實驗證實了miR-129-3p在肝癌細胞中低表達,miR-129-3p可以通過靶向LPAR3,抑制PI3K/AKT信號通路,實現(xiàn)抑制腫瘤的發(fā)生發(fā)展的作用。本研究可以進一步獲取臨床樣本,探究miR-129-3p對LPAR3的靶向作用及下游信號通路的調控作用,完善miR-129-3p的調控機制和信號通路。

