海馬齒對不同鹽度水質(zhì)的碳匯作用以及不同形態(tài)氮利用的研究*
劉旭佳 何緒剛 賴俊翔 黃國強(qiáng) 侯 杰 熊向英 劉 京
海馬齒對不同鹽度水質(zhì)的碳匯作用以及不同形態(tài)氮利用的研究*
劉旭佳1,2,3,4何緒剛2①賴俊翔1,5黃國強(qiáng)6侯 杰2熊向英1, 3劉 京4
(1. 廣西科學(xué)院 廣西海洋科學(xué)院 廣西近海海洋環(huán)境科學(xué)重點(diǎn)實(shí)驗(yàn)室 廣西南寧 530007; 2. 華中農(nóng)業(yè)大學(xué)水產(chǎn)學(xué)院 湖北武漢 430070; 3. 廣西海洋研究所有限責(zé)任公司 廣西北海 536000; 4. 北部灣大學(xué)海洋學(xué)院 廣西海洋生物多樣性養(yǎng)護(hù)重點(diǎn)實(shí)驗(yàn)室 廣西欽州 535011; 5. 北部灣海洋產(chǎn)業(yè)研究院 廣西防城港 538000; 6. 廣西中醫(yī)藥大學(xué)海洋藥物研究院 廣西南寧 530200)
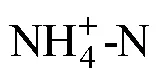
鹽度; 海馬齒; 碳匯; 氮
海馬齒(), 屬番杏科海馬齒屬, 主要生長在海邊沙地或鹽堿地帶的多年生匍匐性肉質(zhì)耐鹽堿高等植物, 具有非常強(qiáng)的生長能力與較廣的生態(tài)適應(yīng)特征。由于可在不同鹽度環(huán)境中進(jìn)行水培(張艷琳等, 2009; 曾碧健等, 2017; 劉煒等, 2021), 海馬齒依靠發(fā)達(dá)根系吸附水體中懸浮顆粒物, 降低養(yǎng)殖水體氮磷含量(楊芳等, 2019), 通過吸收氮磷同化為自身生物量并形成碳匯, 被應(yīng)用在立體生態(tài)養(yǎng)殖系統(tǒng)中具有較高的生物安全性與景觀生態(tài)服務(wù)功能(李衛(wèi)林等, 2019; 楊芳等, 2019)。海馬齒近年來被廣泛應(yīng)用于生態(tài)修復(fù)領(lǐng)域, 比如養(yǎng)殖廢水、海水養(yǎng)殖池塘以及養(yǎng)殖網(wǎng)箱養(yǎng)殖區(qū)水質(zhì)修復(fù)應(yīng)用(曾碧健等, 2016; 王進(jìn)進(jìn), 2017; Boxman, 2018; 楊芳等, 2019; Zhang, 2022)。
植物生存的土壤環(huán)境中, 80%以上氮素為有機(jī)氮形式, 其中氨基酸態(tài)氮占20%~40%(馬林, 2004)。池塘養(yǎng)殖過程中會(huì)產(chǎn)生很多溶解態(tài)有機(jī)質(zhì)、無機(jī)氮等物質(zhì), 養(yǎng)殖過程輸出的溶解性有機(jī)物(DOM)主要由殘餌、糞便以及代謝產(chǎn)物釋放的蛋白質(zhì)樣熒光產(chǎn)物(酪氨酸和色氨酸)組成, 這種DOM可高度降解(Nimptsch, 2015)。國內(nèi)有研究報(bào)道湖泊中水溶性有機(jī)質(zhì)(WSOM)主要是類色氨酸物質(zhì)(馮偉瑩等, 2016; 張博等, 2018), 因此研究海馬齒對色氨酸的利用具有重要的現(xiàn)實(shí)意義。近年來, 許多學(xué)者關(guān)注鹽度對海馬齒生長的研究, 主要針對耐鹽機(jī)理、形態(tài)結(jié)構(gòu)變化響應(yīng)、生長以及生理生化指標(biāo)等(Lokhande, 2010; 李衛(wèi)林等, 2019; 劉煒等, 2021)。目前關(guān)于海馬齒在不同鹽度水質(zhì)中的有機(jī)元素積累以及對無機(jī)氮與色氨酸利用情況未見報(bào)道。因此, 本文主要研究不同鹽度條件下海馬齒有機(jī)元素含量、積累速率以及根際與無機(jī)氮、色氨酸吸收關(guān)系, 探討海馬齒碳匯作用以及根際對不同形態(tài)氮的利用, 同時(shí)為海馬齒在不同鹽度水域修復(fù)中的應(yīng)用提供科學(xué)數(shù)據(jù)參考。
1 材料與方法
1.1 實(shí)驗(yàn)材料與培養(yǎng)
海馬齒于2021年6月11日在廣西北海市竹林鹽場蝦塘邊采摘, 帶回實(shí)驗(yàn)室, 地上部分保留10 cm左右, 每株海馬齒2~3個(gè)莖節(jié)淹沒在250 mL錐形瓶中水里進(jìn)行單株水培。6月11日至30日, 進(jìn)行鹽度0、10、20、30、35水培馴化, 鹽度30海水取自廣西海洋研究所有限責(zé)任公司竹林增養(yǎng)殖基地的砂濾天然海水, 通過添加超純水(PTB-375G, 成都沛億)進(jìn)行低鹽水調(diào)配, 鹽度35通過添加海鹽(Instant Ocean?Aquarium Systems, Inc.)進(jìn)行配制。每天提高或者降低鹽度2~3。實(shí)驗(yàn)過程水溫范圍28.5~31.2 °C。水培過程添加霍格蘭營養(yǎng)液(Phygene, 福州)。每5日更換相應(yīng)鹽度的新水。
1.2 實(shí)驗(yàn)設(shè)計(jì)
選擇生長均勻的海馬齒, 鮮重為(3.16±0.26) g/ind., 每個(gè)鹽度組選擇18株海馬齒, 并進(jìn)行單獨(dú)編號(hào), 海馬齒水培時(shí)間為6月11日至9月1日, 共82 d, 在實(shí)驗(yàn)開始和終末時(shí), 將5個(gè)鹽度處理組海馬齒各取9株, 60 °C烘干至恒重, 記錄單株海馬齒干重, 然后粉碎過80目篩, 測定海馬齒有機(jī)碳、有機(jī)氮和有機(jī)磷含量。
每個(gè)鹽度處理組分為對照組、對照抑菌組、海馬齒根際菌組、海馬齒抑菌組, 每組設(shè)3個(gè)重復(fù)試樣。抑菌組通過添加氨芐青霉素200 mg/L, 頭孢噻肟100 mg/L用于抑制細(xì)菌生長。每個(gè)鹽度組培養(yǎng)水經(jīng)過0.45 μm濾膜過濾, 添加初始濃度霍格蘭營養(yǎng)液, 然后經(jīng)過高壓滅菌鍋121 °C, 20 min滅菌, 待冷卻后在超凈工作臺(tái)進(jìn)行分裝, 每個(gè)錐形瓶分裝300 mL水, 立刻使用硅膠塞密封, 將相對應(yīng)鹽度培養(yǎng)的海馬齒插在硅膠塞中央孔, 最后用凡士林密封。對照組用無孔硅膠塞密封, 所有錐形瓶用錫箔紙包裹遮光。
對照組代表細(xì)菌和非生物因子作用, 對照抑菌組代表非生長因子的作用, 海馬齒根際菌組代表海馬齒、根際菌、細(xì)菌和非生物因子作用, 海馬齒抑菌組代表海馬齒和非生物因子的作用。對照組減去海馬齒根際菌組代表海馬齒根際菌聯(lián)合作用, 對照抑菌組減去海馬齒抑菌組代表海馬齒單獨(dú)作用。
1.3 樣品測定
1.3.1 海馬齒植株有機(jī)碳、有機(jī)氮和有機(jī)磷測定 有機(jī)碳、有機(jī)氮采用元素分析儀(VarioEL III CHONS analyzer, Germany)測定。有機(jī)磷采用灰化法測定(Zhou, 2003)。
1.3.3 色氨酸測定 采用對二甲氨基苯甲醛比色測定法, 在酸性條件下, L-色氨酸與對二甲氨基苯甲醛產(chǎn)生縮合反應(yīng), 生成藍(lán)色希夫堿化合物, 然后加入亞硝酸鈉進(jìn)行重氮化反應(yīng)藍(lán)色繼續(xù)加深, 在一定范圍內(nèi)與L-色氨酸濃度成線性相關(guān), 593 nm分光光度法定量測定(李陽, 2009)。
1.3.4 海馬齒根與根際培養(yǎng)水細(xì)菌測定 剪取S0、S10、S20、S30、S35處理組的海馬齒新根, 剪刀用75%乙醇進(jìn)行消毒處理。將5個(gè)鹽度處理組海馬齒根際5日培養(yǎng)水各取1 L(分別標(biāo)記為SW1、SW2、SW3、SW4、SW5), 分別經(jīng)過0.45 μm、0.22 μm濾膜過濾。細(xì)菌樣品放入液氮中保存。
將每個(gè)樣品剪碎, 用E. Z. N. A Water DNA Extraction Kit試劑盒(Omega Bio-Tek, USA)提取DNA。對16S rDNA基因可變區(qū)V3~V4區(qū)進(jìn)行PCR擴(kuò)增, 所用引物序列為細(xì)菌特異性引物: 341F(5′-CCT AYGGGRBGCASCAG-3′)和806R(5′-GGACTACNNG GGTATCTA AT-3′)。PCR產(chǎn)物使用2%濃度的瓊脂糖凝膠電泳檢測, 送百邁克生物信息公司(北京)進(jìn)行基于Illumina HiSeq2500測序平臺(tái), 利用雙末端測序的方法, 構(gòu)建小片段文庫進(jìn)行測序。
1.4 數(shù)據(jù)分析
所有結(jié)果數(shù)據(jù)以平均值±標(biāo)準(zhǔn)差表示, 采用EXCEL進(jìn)行分析作圖, 并對不同處理組之間的數(shù)據(jù)進(jìn)行LSD方差檢驗(yàn), 以< 0.05作為差異顯著標(biāo)準(zhǔn)。
細(xì)菌群落數(shù)據(jù)分析首先使用Trimmomatic v0.33軟件, 對測序得到的Raw Reads進(jìn)行過濾; 然后使用cutadapt 1.9.1軟件進(jìn)行引物序列的識(shí)別與去除, 得到不包含引物序列的高質(zhì)量Reads; 使用FLASH v1.2.7軟件, 通過overlap對每個(gè)樣品高質(zhì)量的Reads進(jìn)行拼接, 得到的拼接序列即Clean Reads; 使用UCHIME v4.2軟件, 鑒定并去除嵌合體序列, 得到最終有效數(shù)據(jù)(effective reads)。使用Usearch軟件對Reads在97.0%的相似度水平下進(jìn)行聚類、獲得OTU。以SILVA為參考數(shù)據(jù)庫使用樸素貝葉斯分類器對特征序列進(jìn)行分類學(xué)注釋, 得到每個(gè)特征對應(yīng)的物種分類信息。
2 結(jié)果與分析
2.1 不同鹽度條件下海馬齒干重變化
不同鹽度處理組海馬齒初重與終末干重變化見圖1。6月11日5個(gè)鹽度組海馬齒植株初始干重間無顯著差異(d=4,=1.452,=0.226)。實(shí)驗(yàn)終末時(shí), 5個(gè)鹽度處理組之間海馬齒干重差異顯著(d=4,=14.896,=0.000), 其中S10鹽度處理組顯著高于其余處理組(0.05), S35鹽度處理組顯著低于其余處理組(0.05), 其余組間差異不顯著(0.05)。
2.2 不同鹽度條件下海馬齒植株有機(jī)碳、有機(jī)氮、有機(jī)磷含量
實(shí)驗(yàn)開始時(shí), 不同鹽度處理組海馬齒有機(jī)碳、有機(jī)氮、有機(jī)磷含量見表1。不同鹽度處理組海馬齒有機(jī)碳、有機(jī)氮、有機(jī)磷含量間差異不顯著(d=4,=1.381,=0.249; d=4,=1.160,=0.336; d=4,=0.966,=0.431)。實(shí)驗(yàn)結(jié)束時(shí), 不同鹽度處理組有機(jī)碳含量差異顯著(d=4,=20.189,=0.000; d=4,=43.571,=0.000; d=4,=41.459,=0.000)。S10處理組有機(jī)碳含量顯著高于其余處理組(0.05), S0處理組顯著高于S30、S35處理組(<0.05), 且S30處理組顯著高于S35處理組(<0.05)。S0、S10處理組有機(jī)氮含量顯著高于其余處理組(<0.05), 且S20、S30處理組有機(jī)氮含量顯著高于S35處理組(<0.05)。S0、S10處理組有機(jī)磷含量顯著高于其余處理組(<0.05), 且S20處理組有機(jī)磷含量顯著高于S30、S35處理組(<0.05)。
不同鹽度處理組海馬齒干重有機(jī)碳、有機(jī)氮、有機(jī)磷積累速率見表2。不同鹽度處理組海馬齒干重有機(jī)碳、有機(jī)氮、有機(jī)磷積累速率差異顯著(d=4,=14.307,=0.000; d=4,=26.854,=0.000; d=4,=37.016,=0.000)。S10處理組海馬齒干重有機(jī)碳積累速率顯著高于其余處理組(0.05), S35處理組顯著低于其余四個(gè)處理組(<0.05)。S0、S10處理組海馬齒干重有機(jī)氮積累速率高于其余處理組(0.05), S35處理組顯著低于其余四個(gè)處理組(<0.05)。S0、S10處理組海馬齒干重有機(jī)磷積累速率高于其余處理組(0.05), S30與S35處理組無顯著差異(0.05)。
2.3 不同鹽度條件下海馬齒吸收無機(jī)氮情況
不同鹽度條件下海馬齒利用氮情況見圖2~8, 圖中縱坐標(biāo)代表單株培養(yǎng)錐形瓶水體中營養(yǎng)鹽質(zhì)量。所有實(shí)驗(yàn)組培養(yǎng)水體中銨態(tài)氮含量隨時(shí)間變化見圖2。可以看出, S0處理組除對照抑菌組5 d出現(xiàn)降低外, 對照組、海馬齒根際菌組、海馬齒抑菌組在1、3、5 d時(shí)均呈現(xiàn)增加現(xiàn)象; S10鹽度處理組, 海馬齒根際菌組在3、5 d時(shí)銨態(tài)氮含量明顯增加, 其他組銨態(tài)氮含量基本低于初始含量; S20鹽度處理組, 銨態(tài)氮含量跟S10處理組變化相似, 同時(shí)海馬齒根際菌組在3、5 d時(shí)銨態(tài)氮含量更高; S30、S35鹽度處理組, 海馬齒根際菌組在3、5 d時(shí)的銨態(tài)氮含量均顯著增加, 對照抑菌組與海馬齒抑菌組銨態(tài)氮含量則明顯降低。海馬齒根際菌聯(lián)合作用與海馬齒作用銨態(tài)氮利用量見圖3。可以看出, S0、S10處理組海馬齒根際菌聯(lián)合作用、海馬齒單獨(dú)作用下均不利用銨態(tài)氮, S20、S30與S35處理組的海馬齒抑菌情況下會(huì)利用少量銨態(tài)氮。
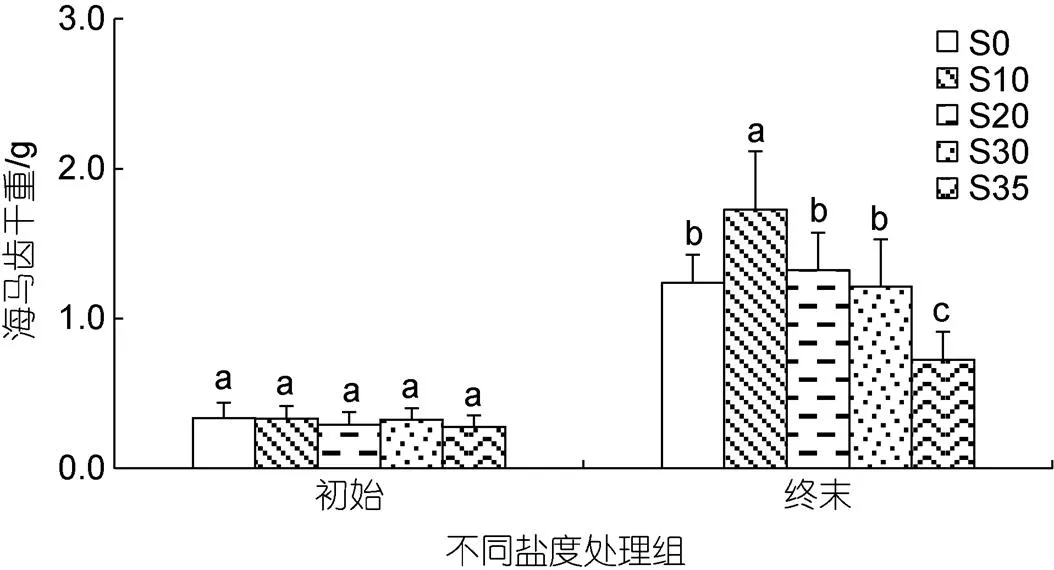
圖1 不同鹽度條件下初始與終末海馬齒干重

表1 不同鹽度處理組海馬齒有機(jī)碳、有機(jī)氮、有機(jī)磷含量
注: 同一行中不同小寫字母代表不同鹽度處理組之間差異顯著(0.05)
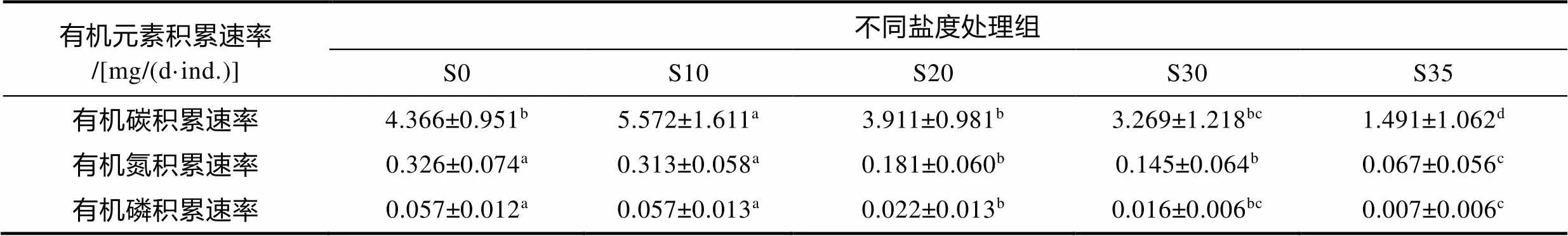
表2 不同鹽度處理組海馬齒中有機(jī)碳、有機(jī)氮、有機(jī)磷積累速率
注: 同一行中不同小寫字母代表不同鹽度處理組之間差異顯著(0.05)
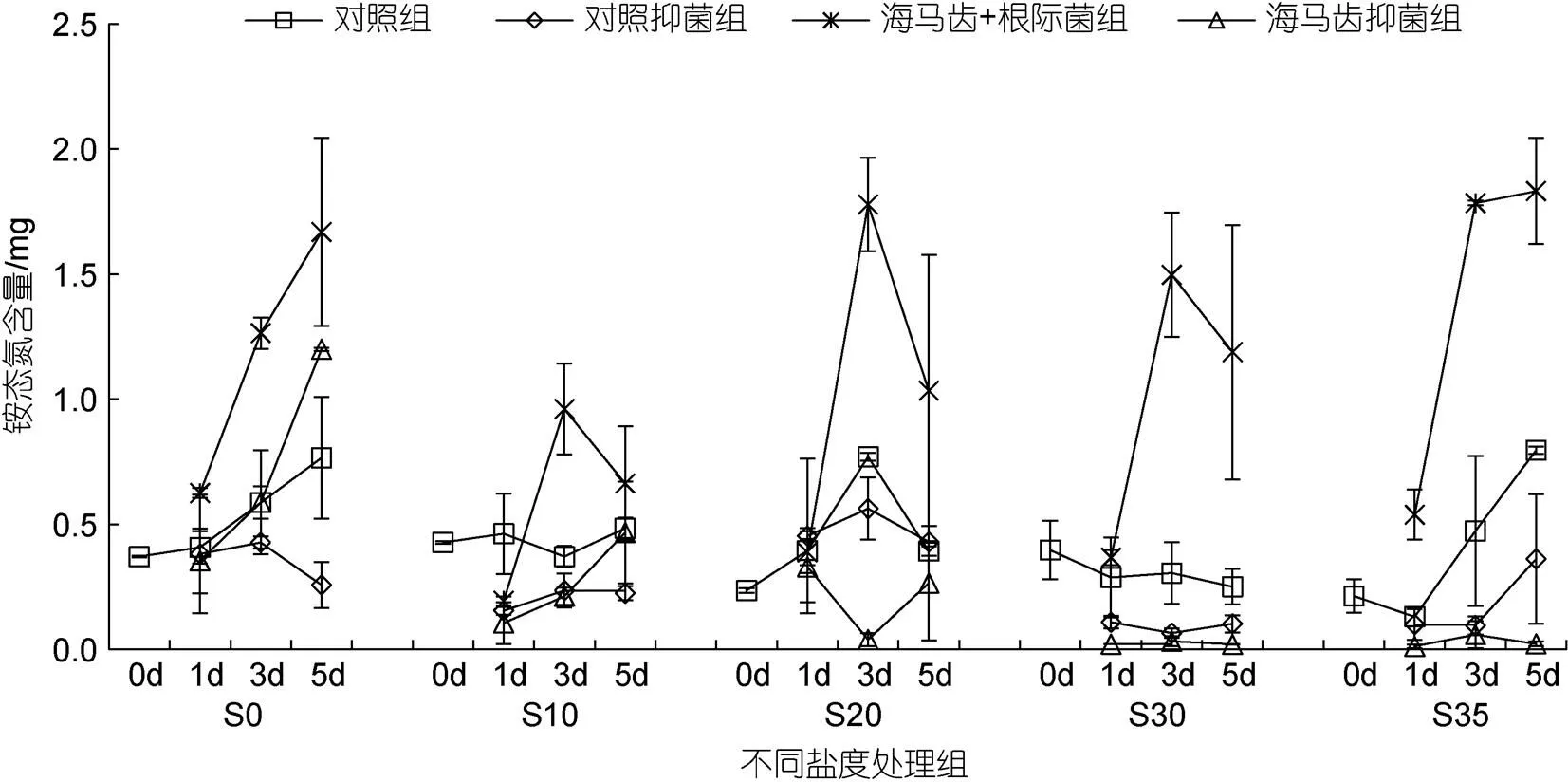
圖2 所有實(shí)驗(yàn)組培養(yǎng)水體中銨態(tài)氮含量隨時(shí)間變化
所有實(shí)驗(yàn)組培養(yǎng)水體中硝態(tài)氮含量隨時(shí)間變化見圖4。5個(gè)鹽度處理組中, 海馬齒根際菌組的硝態(tài)氮含量在3、5 d時(shí)均顯著下降。海馬齒抑菌組整體上在3、5 d時(shí)也表現(xiàn)下降趨勢, 但含量整體要高于海馬齒根際菌組。海馬齒根際菌聯(lián)合作用與海馬齒作用硝態(tài)氮利用量見圖5。可以看出, S10鹽度處理組抑菌情況下在3、5 d時(shí)不利用硝態(tài)氮, 其余處理組海馬齒根際菌聯(lián)合作用與海馬齒單獨(dú)作用均會(huì)利用大量硝態(tài)氮, 海馬齒根際菌聯(lián)合情況下利用量明顯高于海馬齒單獨(dú)作用。
所有實(shí)驗(yàn)組培養(yǎng)水體中磷酸鹽含量隨時(shí)間變化見圖6。5個(gè)鹽度處理組中, 海馬齒根菌組與海馬齒抑菌組的磷酸鹽含量均呈現(xiàn)出整體下降現(xiàn)象, 其中S20處理組下降最顯著。海馬齒根際菌聯(lián)合作用與海馬齒作用無機(jī)磷利用量見圖7。可以看出, S20鹽度處理組海馬齒根際菌聯(lián)合、海馬齒抑菌組, 1、3、5 d磷酸鹽利用量最高; S10處理組海馬齒根際菌組、海馬齒抑菌組1、3 d利用量最低。
所有實(shí)驗(yàn)組培養(yǎng)水體中色氨酸含量隨時(shí)間變化見圖8。5個(gè)鹽度處理組中, 海馬齒根際菌組色氨酸含量均表現(xiàn)急劇下降; S0、S10處理組海馬齒抑菌組色氨酸含量也出現(xiàn)急劇下降, 而S20、S30、S35處理組海馬齒抑菌組色氨酸含量下降幅度則小很多。海馬齒根際菌聯(lián)合作用與海馬齒作用色氨酸利用量見圖9。可以看出, 5個(gè)鹽度處理組海馬齒根際菌聯(lián)合作用下均吸收色氨酸; S0、S10處理組海馬齒抑菌組利用量較高, S20、S30、S35鹽度處理組利用量比較少。
2.4 不同鹽度條件下海馬齒根際與根際培養(yǎng)水細(xì)菌群落結(jié)構(gòu)
高通量測序及其數(shù)據(jù)分析結(jié)果顯示: 5個(gè)鹽度處理組海馬齒根際S0、S10、S20、S30、S35, 與5個(gè)鹽度海馬齒根際培養(yǎng)水SW10、SW10、SW20、SW30、SW35的細(xì)菌歸屬于25門類、60綱、161目、290科、497屬、532種。表4是10個(gè)樣品細(xì)菌門水平細(xì)菌組成與比率。
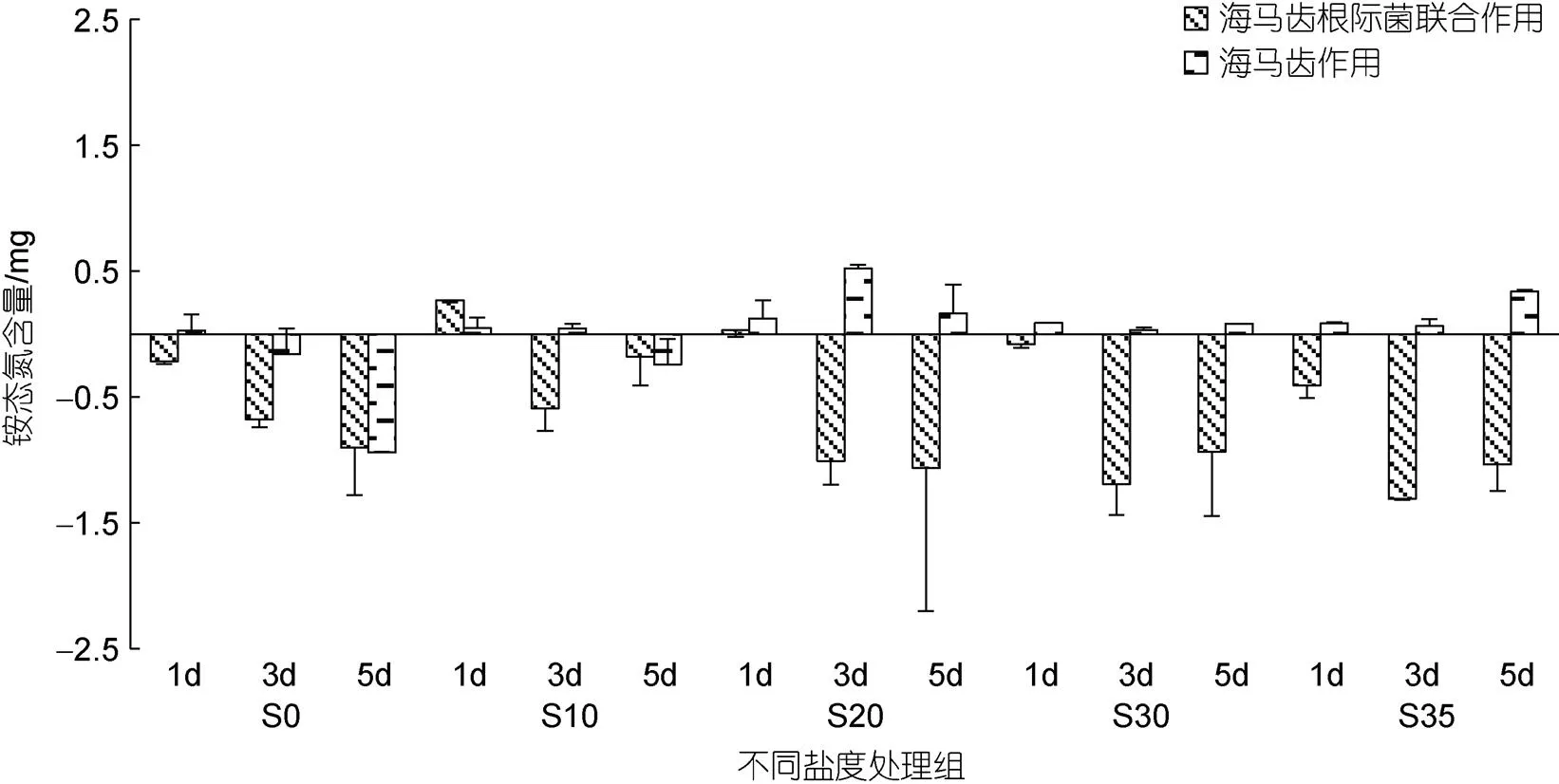
圖3 海馬齒根際菌聯(lián)合作用與海馬齒作用利用銨態(tài)氮含量
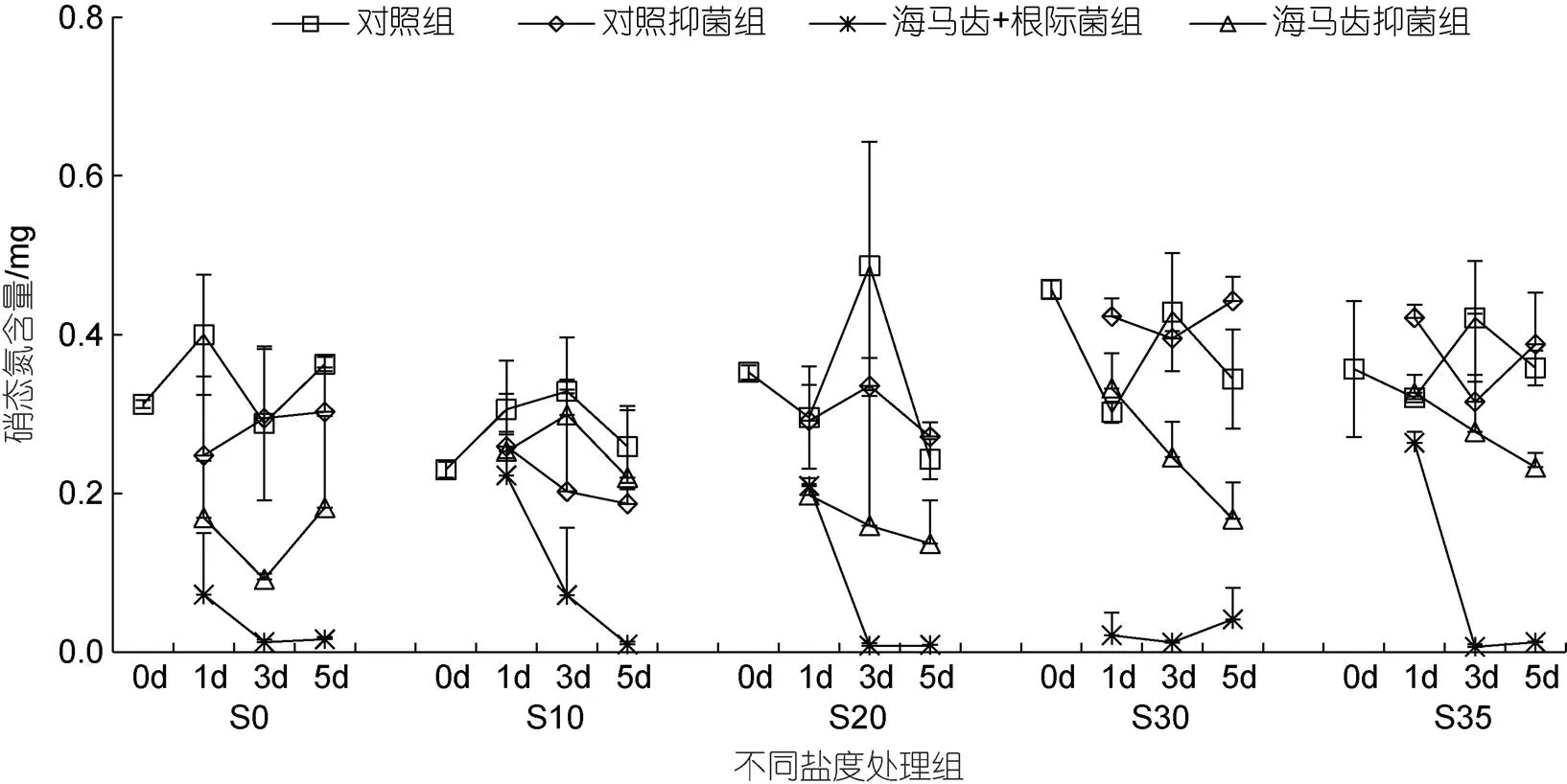
圖4 所有實(shí)驗(yàn)組培養(yǎng)水體中硝態(tài)氮含量隨時(shí)間變化
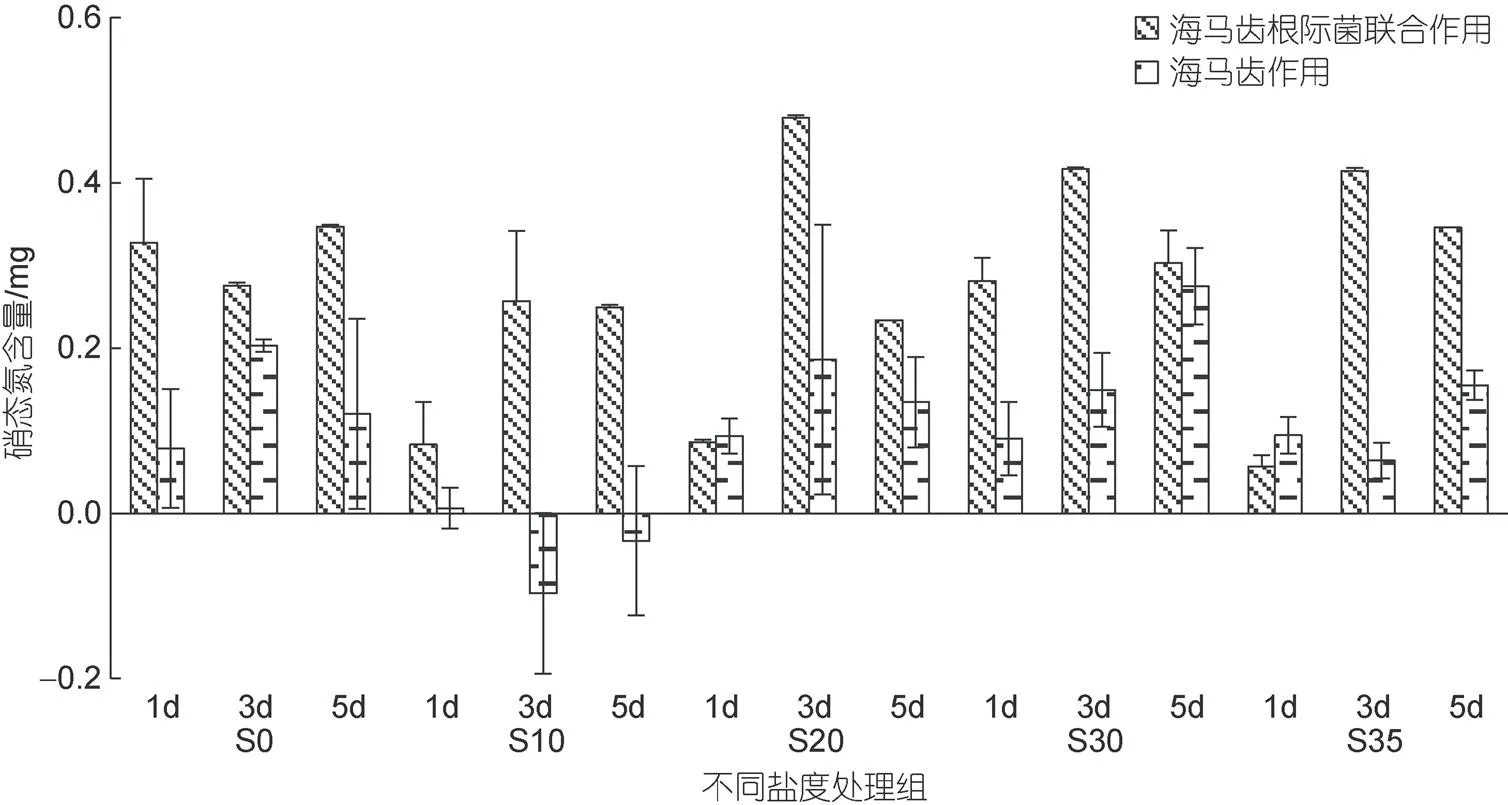
圖5 海馬齒根際菌聯(lián)合作用與海馬齒作用利用硝態(tài)氮含量
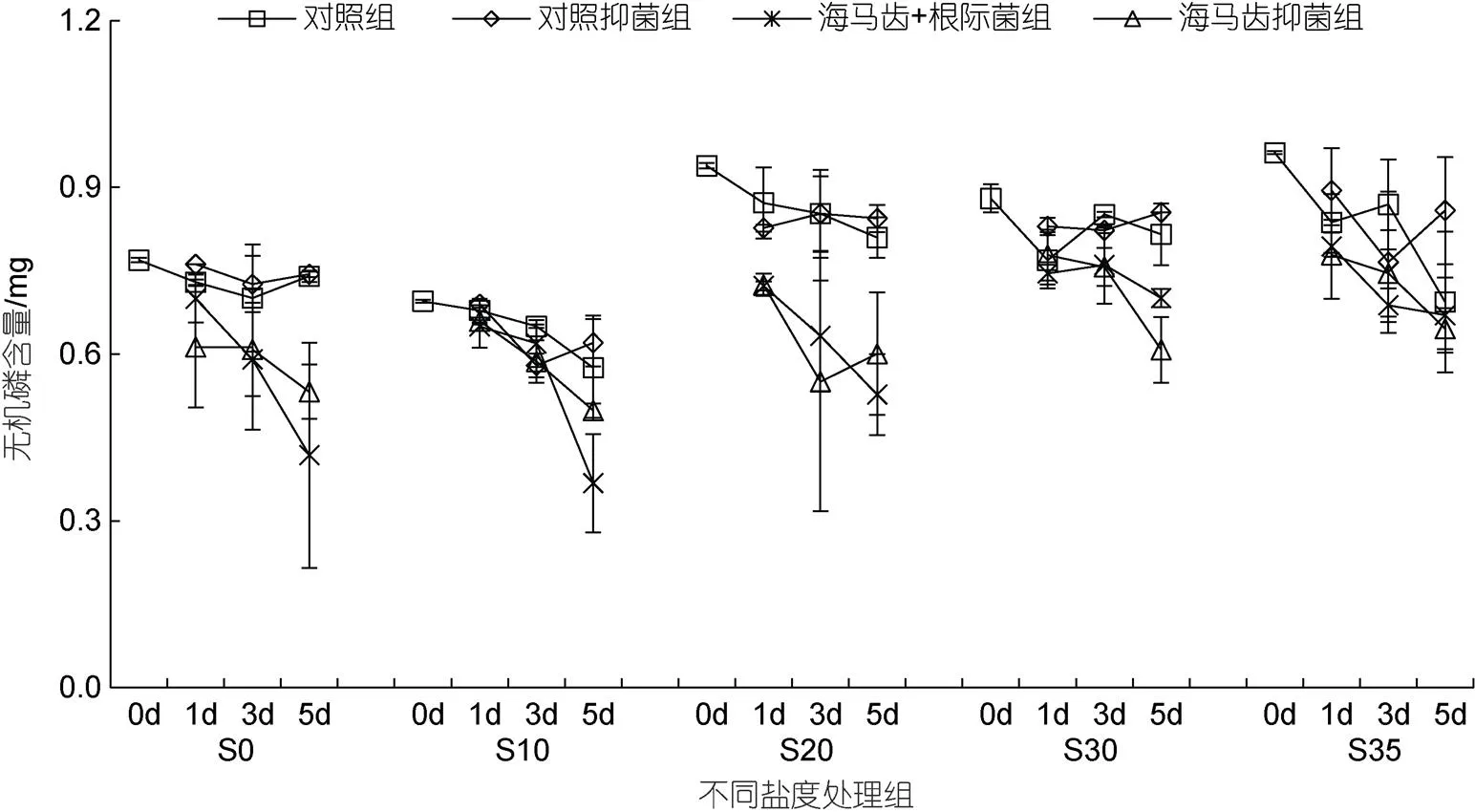
圖6 所有實(shí)驗(yàn)組培養(yǎng)水體中磷酸鹽含量隨時(shí)間變化
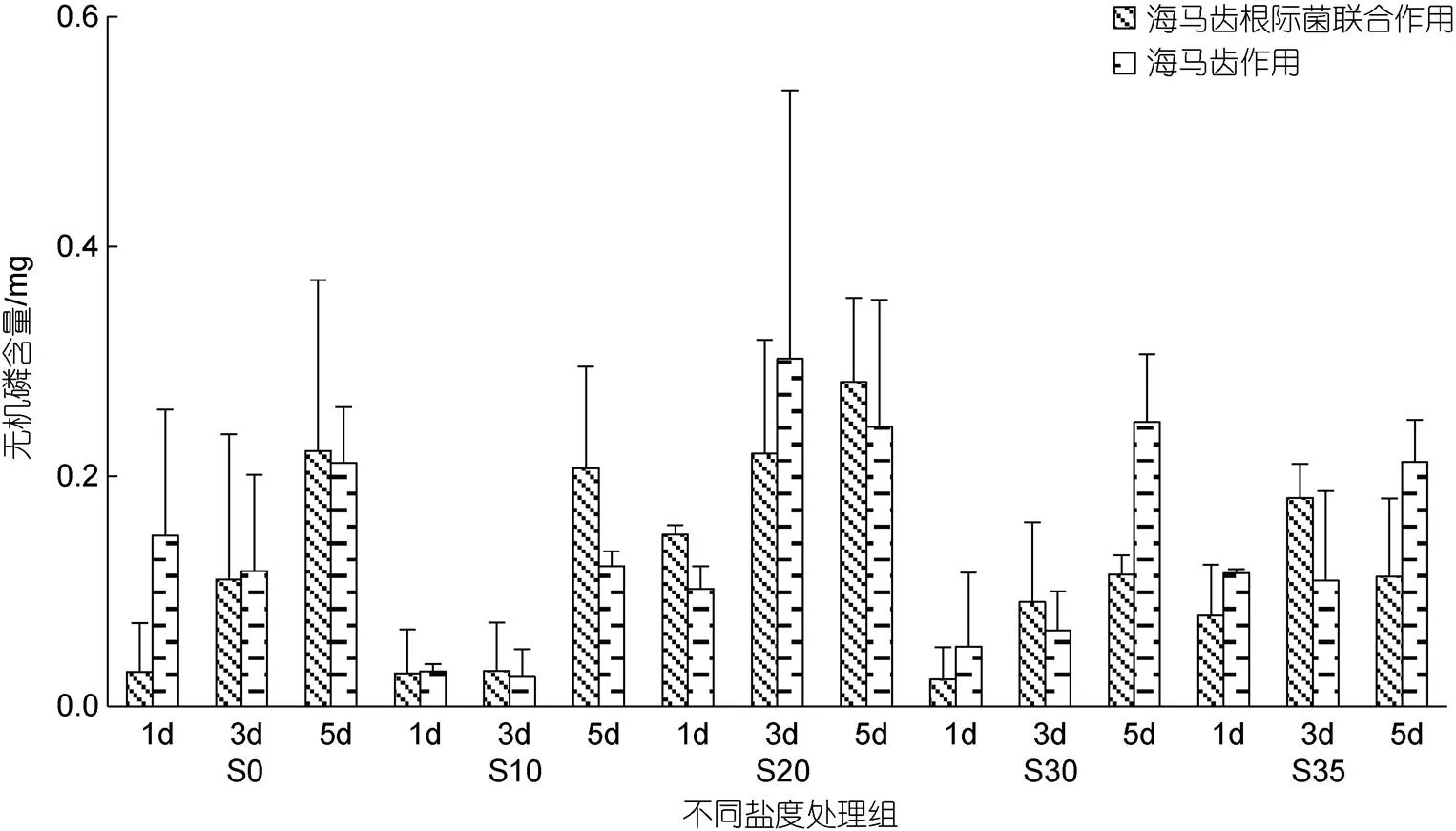
圖7 海馬齒根際菌聯(lián)合作用與海馬齒作用利用磷酸鹽含量
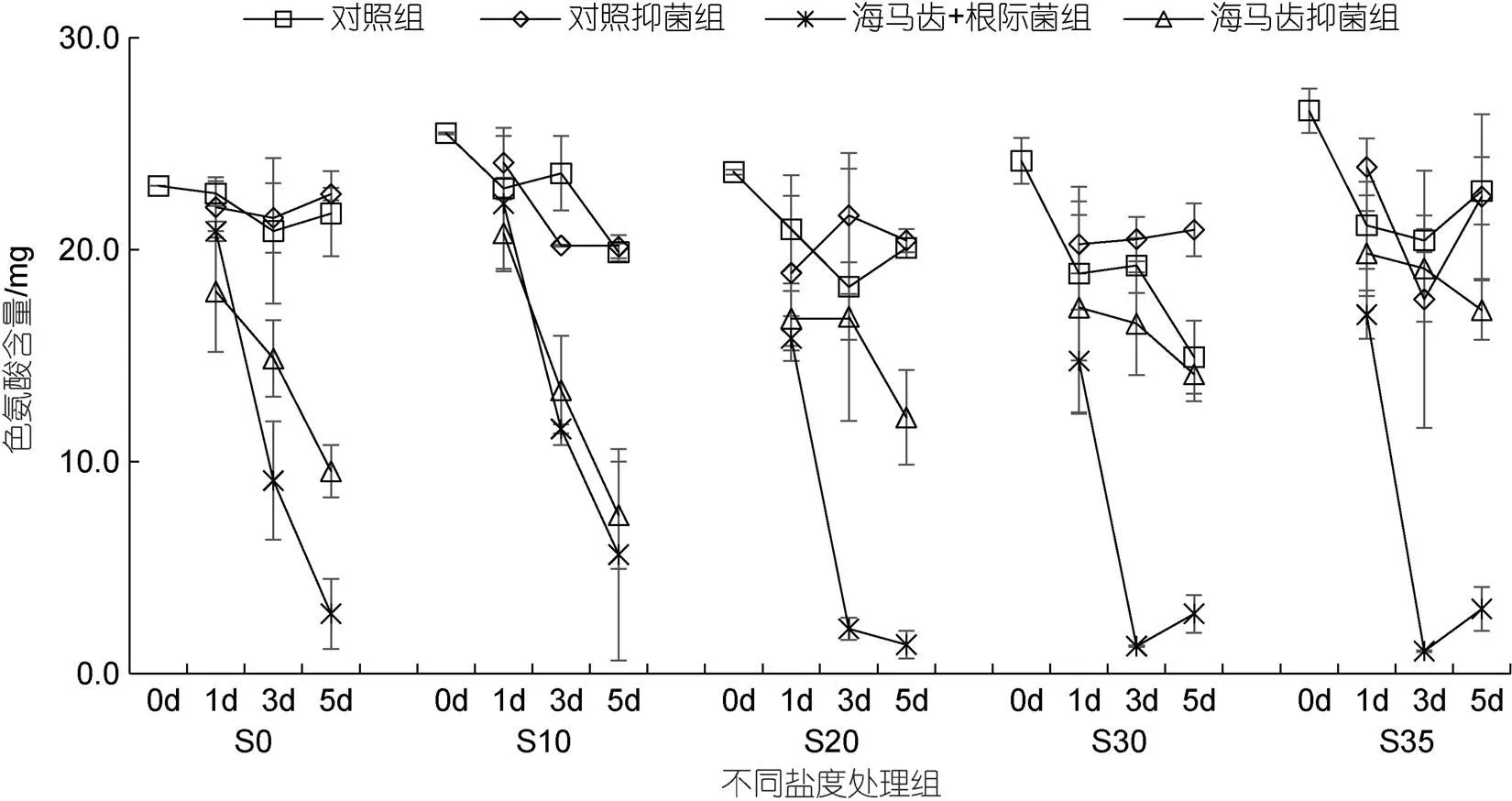
圖8 所有實(shí)驗(yàn)組培養(yǎng)水體中色氨酸含量隨時(shí)間變化
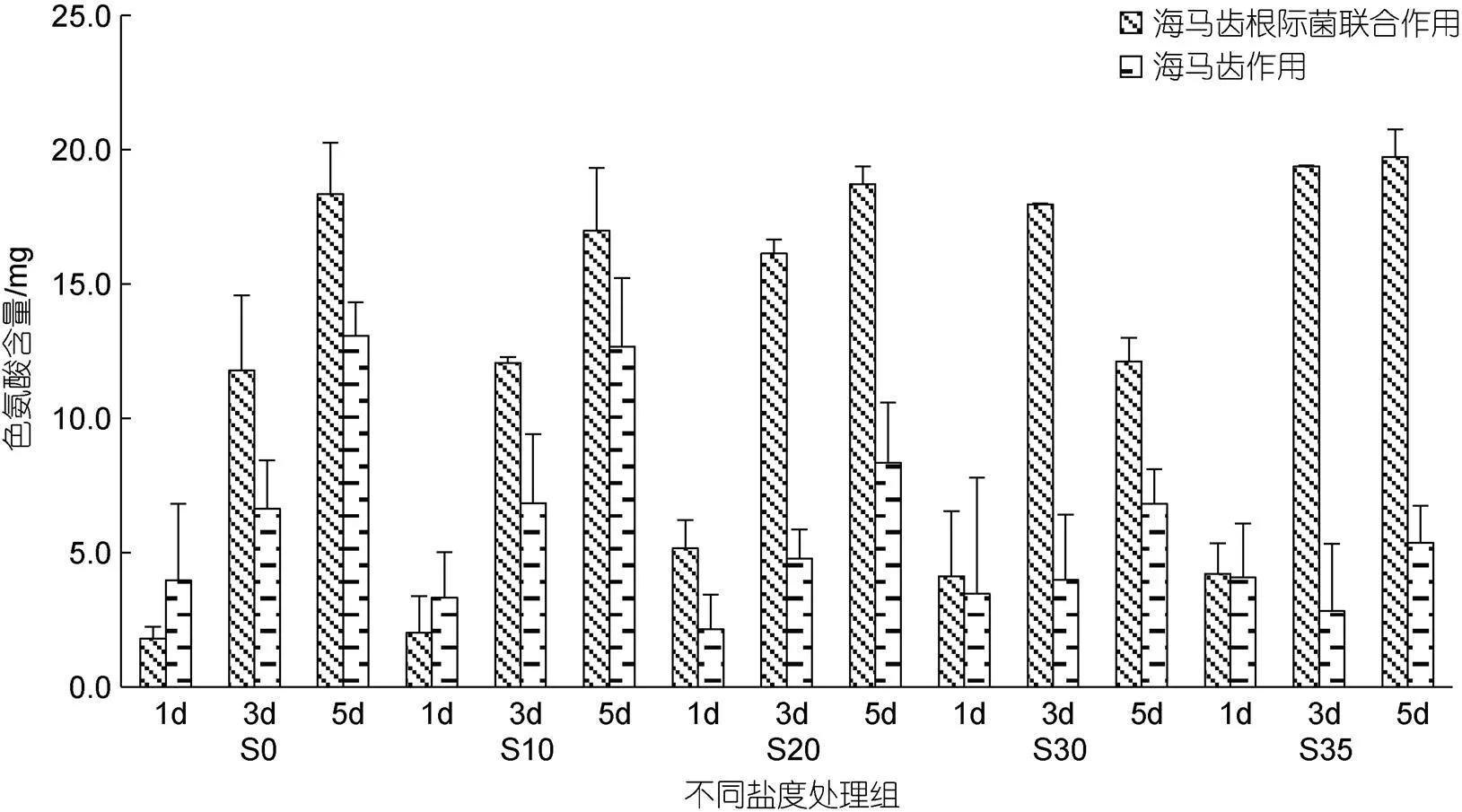
圖9 海馬齒根際菌聯(lián)合作用與海馬齒作用利用色氨酸含量
根際區(qū)與根際培養(yǎng)水優(yōu)勢菌數(shù)量差異很大(表3)。根際區(qū)優(yōu)勢菌有變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、藍(lán)藻門(Cyanobacteria)、擬桿菌門(Bacteroidetes)。根際培養(yǎng)水的優(yōu)勢菌有變形菌門(Proteobacteria)、厚壁菌門(Firmicutes)、藍(lán)藻門(Cyanobacteria)、酸桿菌門(Acidobacteria)、放線菌門(Actinobacteria)、擬桿菌門(Bacteroidetes)。
硝化細(xì)菌類群和比率見表4。根際區(qū)硝化菌數(shù)量明顯低于根際培養(yǎng)水。根際區(qū)硝化細(xì)菌除S30鹽度組外, 其他鹽度處理組相差不大。根際培養(yǎng)水硝化細(xì)菌SW30最低, SW20含量最高。共發(fā)現(xiàn)兩個(gè)菌屬氨氧化細(xì)菌(ammonia oxidizing bacteria, AOB): 亞硝化單胞菌屬()和亞硝化螺桿菌屬()。檢測到一個(gè)亞硝酸鹽氧化菌(nitrite oxidizing bacteria, NOB), 主要是硝化螺菌屬()。
反硝化細(xì)菌類群和比率見表5。根際區(qū)反硝化菌數(shù)量明顯低于根際培養(yǎng)水, 且根際區(qū)、根際培養(yǎng)水反硝化細(xì)菌數(shù)量均顯著高于硝化細(xì)菌。共發(fā)現(xiàn)放線菌門2個(gè)菌屬, 厚壁菌門3個(gè)菌屬, 擬桿菌門1個(gè)菌屬, 變形菌門7個(gè)菌屬的反硝化細(xì)菌。根際菌中乳桿菌屬()、不動(dòng)桿菌屬()、蒼白桿菌()含量較高。
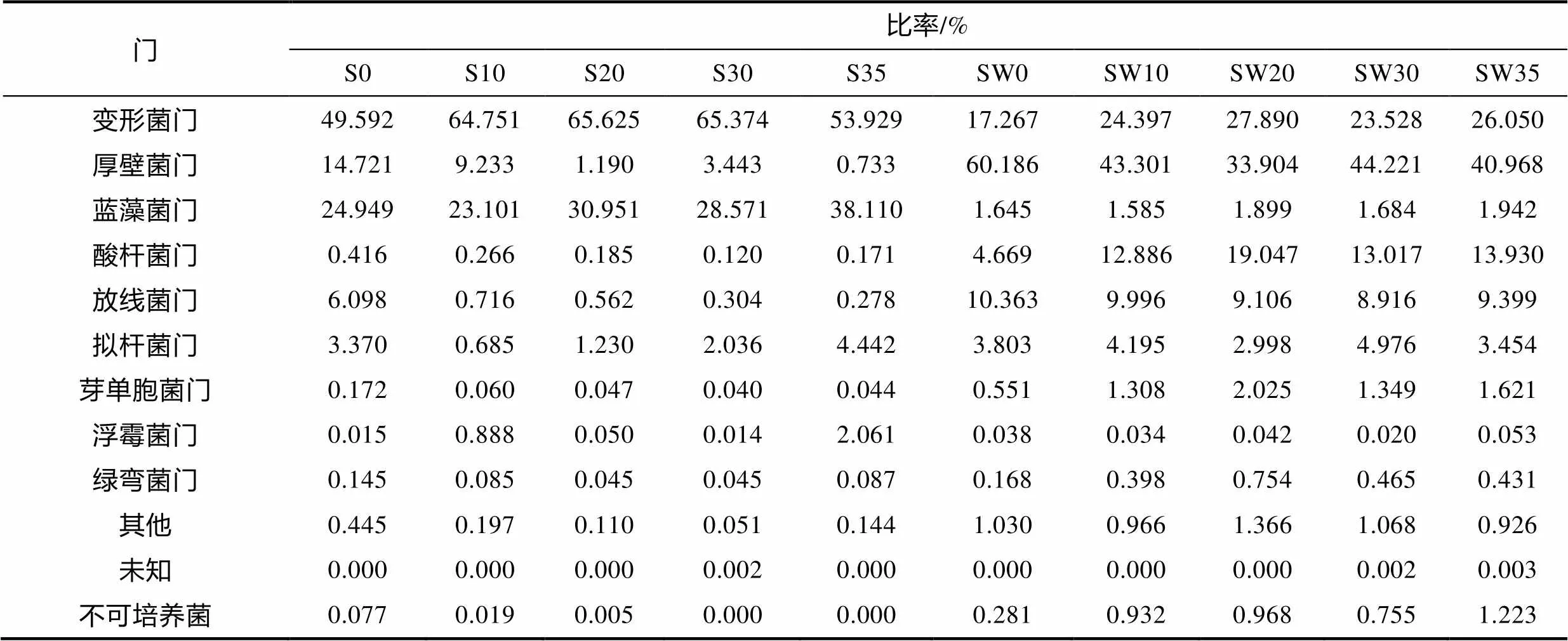
表3 海馬齒根際與根際培養(yǎng)水門水平細(xì)菌類群組成和比率
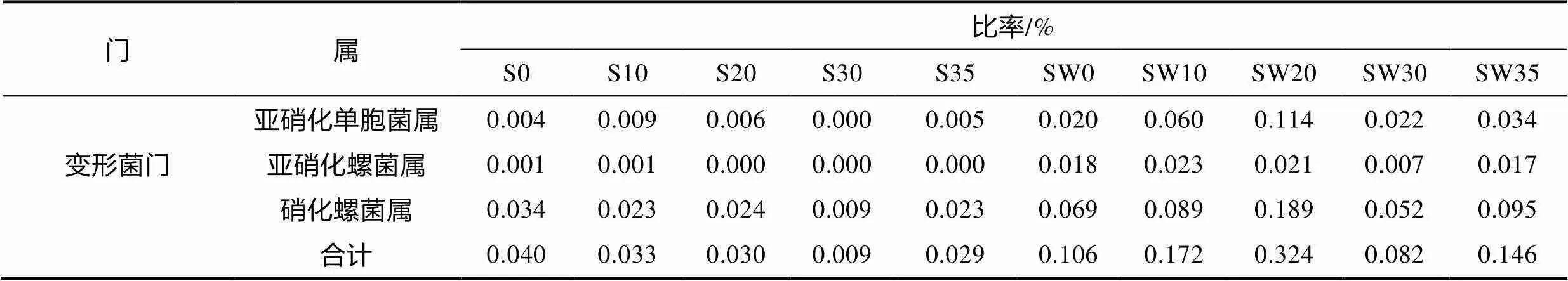
表4 海馬齒根際與根際培養(yǎng)水硝化細(xì)菌類群組成和比率
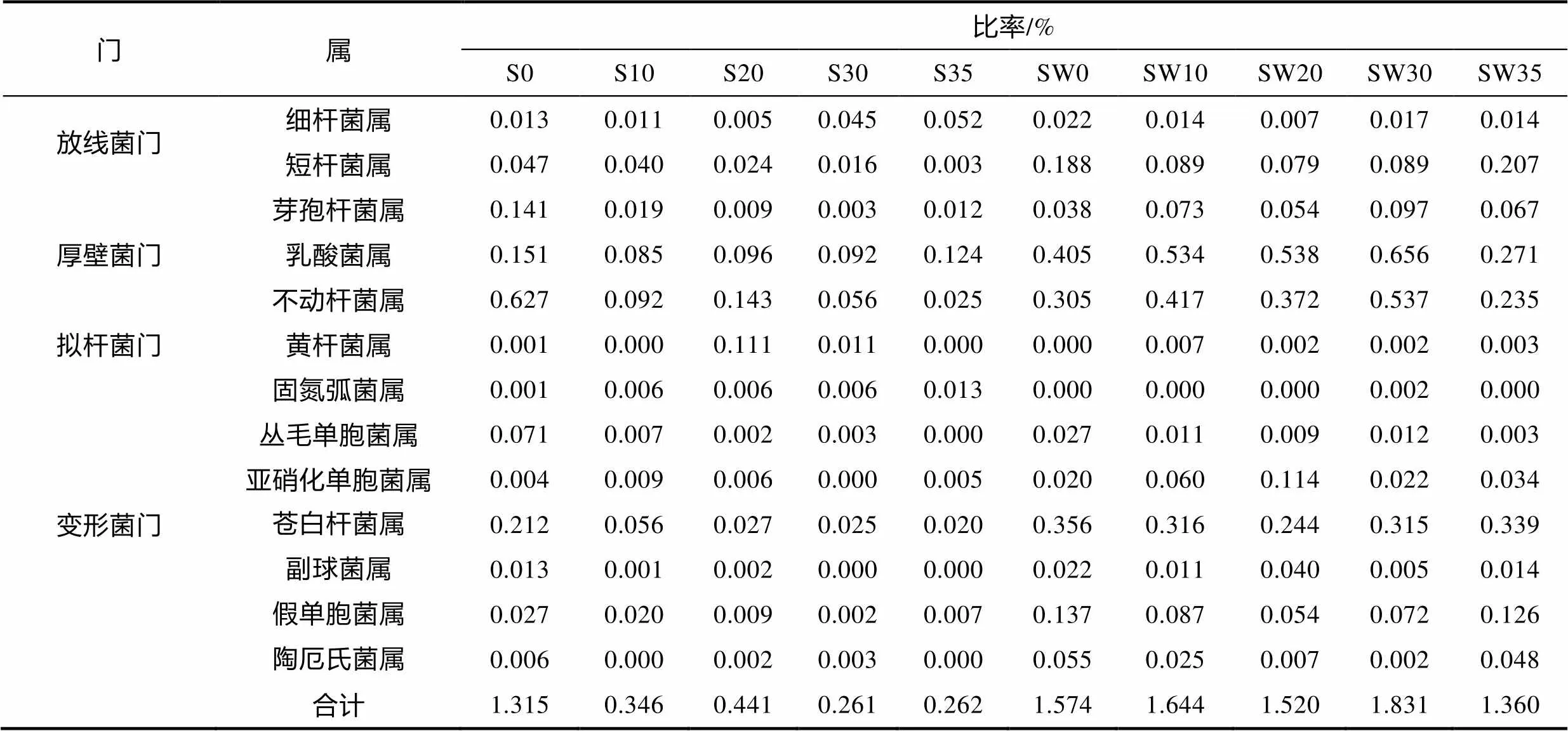
表5 海馬齒根際與根際培養(yǎng)水反硝化細(xì)菌類群組成和比率
3 討論
3.1 不同鹽度條件下海馬齒生長
經(jīng)過近3個(gè)月培養(yǎng), 鹽度10條件下海馬齒干重、有機(jī)碳含量以及積累速率最高, 有機(jī)氮、有機(jī)磷含量以及積累速率與鹽度0之間均無顯著差異, 且顯著高于其余鹽度處理; 鹽度35條件下海馬齒干重、有機(jī)元素含量以及積累速率則最低, 說明一定鹽度下海馬齒可以快速生長并積累較高的有機(jī)元素, 高鹽環(huán)境對海馬齒生長造成脅迫, 從而導(dǎo)致營養(yǎng)元素積累最少。水培過程中通過觀察海馬齒株高變化以及根系絨毛結(jié)構(gòu), 可以看出S0、S10低鹽度處理組的海馬齒生長最為迅速, 主要是由于根系絨毛長、數(shù)量多以及吸水量較高的原因。國內(nèi)許多研究人員開展了鹽度對海馬齒生長影響的研究(張艷琳等, 2009; 曾碧健等, 2017; 李衛(wèi)林等, 2019; 劉煒等, 2021), 其一致結(jié)論是低鹽促進(jìn)海馬齒生長, 高鹽對其生長產(chǎn)生抑制, 外在表現(xiàn)為海馬齒出現(xiàn)葉片肉質(zhì)、莖節(jié)短、生長緩慢、甚至死亡等現(xiàn)象。李衛(wèi)林等(2019)研究鹽度對水培海馬齒生長和生理生化因子的影響, 指出在鹽度0~20, 海馬齒生長幾乎不受影響, 高鹽度25~35, 海馬齒生長受到明顯脅迫, 鹽度35條件上部分海馬齒莖節(jié)腐爛潰敗, 苗種成活率下降。劉煒等(2021)研究明確指出, 鹽度10條件下, 海馬齒干物質(zhì)積累量較高, 生長最快, 這與本實(shí)驗(yàn)結(jié)論完全一致; 但該作者的實(shí)驗(yàn)中出現(xiàn)鹽度30導(dǎo)致海馬齒死亡的情況, 這與曾碧健等(2017)文章結(jié)果相似。本實(shí)驗(yàn)中海馬齒在馴化與實(shí)驗(yàn)過程中, 鹽度0~35范圍均未出現(xiàn)死亡, 這與水培過程中添加色氨酸有重要關(guān)系, 具體分析見討論3.3。除此之外, 與海馬齒來源地有很大相關(guān)性, 本實(shí)驗(yàn)中海馬齒取自廣西北海蝦塘旁的灘涂區(qū)域, 土壤中鹽分本來就很高, 同時(shí)海馬齒水培時(shí)間長達(dá)82 d, 均是高鹽水質(zhì)條件下海馬齒能夠基本維持生長的原因。
本實(shí)驗(yàn)計(jì)算了不同鹽度海馬齒積累有機(jī)碳、有機(jī)氮和有機(jī)磷含量, 其中鹽度10條件下海馬齒有機(jī)質(zhì)積累速率最高, 有機(jī)碳、有機(jī)氮與有機(jī)磷積累速率分別為(5.572±1.611)、(0.313±0.058)、(0.057±0.013) mg/(d·ind.), 可以看出, 海馬齒固碳作用顯著, 若將海馬齒應(yīng)用于養(yǎng)殖水體修復(fù), 將是一種實(shí)現(xiàn)藍(lán)碳增匯的綜合養(yǎng)殖模式, 同時(shí)可為評估海馬齒移除養(yǎng)殖水體營養(yǎng)元素提供可靠數(shù)據(jù)參考。
3.2 不同鹽度條件下海馬齒吸收無機(jī)氮含量
海馬齒發(fā)達(dá)根部可為根際微生物培養(yǎng)提供附著位點(diǎn), 同時(shí)海馬齒光合作用產(chǎn)生的O2輸送到根際區(qū), 形成好氧的表層與厭氧的亞層微環(huán)境, 可為脫氮微生物主要是硝化菌與反硝化菌提供優(yōu)勢條件。胡綿好(2009)等對鳳眼蓮-固定化氮循環(huán)細(xì)菌聯(lián)合作用對富營養(yǎng)化水體進(jìn)行原位修復(fù), 研究結(jié)果表明植物-微生物處理系統(tǒng)可以顯著提高水體中氮循環(huán)微生物數(shù)量, 且對總氮與銨態(tài)氮去除率為77.2%和49.2%。Zhang等(2022)研究養(yǎng)殖廢水中不同濃度磺胺對海馬齒吸收氮磷的影響中指出, 隨著磺胺濃度增加, 28 d后海馬齒鮮重、根系活力明顯下降, 葉片中抗氧性酶活力降低, 對廢水氮磷吸收下降, 水體中微生群落結(jié)構(gòu)改變,而根際菌受的影響較小。本研究中單株海馬齒培養(yǎng)瓶為封閉狀態(tài), 根際氮利用實(shí)驗(yàn)為5 d, 時(shí)間較短, 對海馬齒植株以及體內(nèi)抗氧化體系影響較小; 且磺胺與本實(shí)驗(yàn)中氨芐青霉素、頭孢噻肟的抑菌原理不同, 楊芳等(2014)用氨芐青霉素, 頭孢噻肟可以完全抑制海馬齒根際與培養(yǎng)水體中的細(xì)菌, 因此本實(shí)驗(yàn)中抑菌條件可以代表海馬齒單獨(dú)作用, 但是海馬齒與根際菌是互相依托關(guān)系, 對根際菌抑制也有可能抑制海馬齒單獨(dú)作用下利用氮能力, 具體機(jī)制還有待后續(xù)進(jìn)一步研究。
本實(shí)驗(yàn)結(jié)果顯示, 海馬齒在不抑菌情況下, 不同鹽度處理組培養(yǎng)水中硝態(tài)氮均出現(xiàn)大幅降低, 而銨態(tài)氮濃度則明顯增加, 根據(jù)細(xì)菌高通量分析測序結(jié)果, 不同鹽度處理的海馬齒根際培養(yǎng)水中均存在較高豐度的反硝化細(xì)菌, 高鹽條件有利于反硝化細(xì)菌生長(仇元, 2016; 王芬等, 2020)。通過分析, 海馬齒實(shí)驗(yàn)瓶中硝態(tài)氮變化至少有3個(gè)反應(yīng)過程, 異化硝酸鹽還原為銨(dissimilatory nitrate reduction to ammonium, DNRA)被海馬齒利用; 硝態(tài)氮經(jīng)過反硝化作用被逐步還原為一氧化氮、氧化亞氮和氮?dú)鈴亩鴮?dǎo)致硝態(tài)氮減少; 硝化過程也會(huì)生成部分硝態(tài)氮, 整體上呈現(xiàn)出硝態(tài)氮下降的結(jié)果。銨態(tài)氮變化至少也有3個(gè)反應(yīng)過程, 海馬齒自身消耗代謝產(chǎn)生; 色氨酸被吸收利用后的氧化脫氨; 直接被吸收, 由于產(chǎn)生的含量遠(yuǎn)大于消耗部分, 因此最后呈現(xiàn)出大量增加的結(jié)果。海馬齒在抑菌情況下, 培養(yǎng)水中硝態(tài)氮也出現(xiàn)大幅降低, 只有鹽度20、30、35處理組的海馬齒會(huì)利用少量銨態(tài)氮, 最高值出現(xiàn)在S20鹽度處理組, 第3 d利用量為0.52 mg。一般情況下, 銨態(tài)氮與硝態(tài)氮同時(shí)存在時(shí), 植物會(huì)優(yōu)先吸收銨態(tài)氮, 硝態(tài)氮必須依次經(jīng)過硝酸還原酶與亞硝酸還原酶作用才能還原為銨態(tài)氮, 才能被利用合成氨基酸、蛋白質(zhì)以及其他高分子化合物;另一種觀點(diǎn)認(rèn)為, 硝態(tài)氮才是植物的重要氮源, 只有當(dāng)硝態(tài)氮不足時(shí), 才會(huì)吸收銨態(tài)氮(巫曉杰等, 2011)。仇元(2016)研究海馬齒生態(tài)浮床植物根際脫氮過程, 結(jié)果表明海馬齒高鹽30培養(yǎng)過程中水體7 d后氨氮從0.328 mg/L降低0.181 mg/L, 亞硝態(tài)氮從0上升到0.027 mg/L, 硝態(tài)氮從56.88 mg/L降到33.94 mg/L, 說明海馬齒主要利用的是硝態(tài)氮, 這與其初始營養(yǎng)鹽設(shè)置高也有很大關(guān)系, 充足的氮濃度滿足植物氮吸收與同化, 而氮儲(chǔ)存能力也會(huì)加快其吸收速率。
不同鹽度下海馬齒根際均會(huì)吸收不同濃度磷酸鹽, S20鹽度處理組吸收量最大, 海馬齒根際菌聯(lián)合作用吸收最大值出現(xiàn)在第5 d為(0.28±0.07) mg、海馬齒單獨(dú)作用吸收最大值出現(xiàn)在第3 d為(0.30±0.23) mg。植物吸收磷通常與根形態(tài)、根系分泌物、體內(nèi)磷轉(zhuǎn)運(yùn)等因素有關(guān), 同時(shí)會(huì)受到特異基因表達(dá)的調(diào)控(李廷軒等, 2017)。本實(shí)驗(yàn)結(jié)果表明海馬齒根際菌聯(lián)合作用與海馬齒單獨(dú)作用都可以直接吸收磷酸鹽, 且海馬齒單獨(dú)作用吸收量也會(huì)高于聯(lián)合作用, 說明海馬齒根系與磷相關(guān)代謝菌對無機(jī)磷吸收都有競爭, 但具體吸收機(jī)理以及海馬齒根系與細(xì)菌聯(lián)合機(jī)制還需要進(jìn)一步深入研究。
3.3 不同鹽度條件下海馬齒吸收色氨酸
色氨酸是植物體內(nèi)生長素生物合成重要的前體物, 同時(shí)作為動(dòng)物飼料添加劑(孫育平等, 2016)在養(yǎng)殖過程會(huì)溶失在養(yǎng)殖水體中, 因此研究色氨酸吸收轉(zhuǎn)化對于構(gòu)建海馬齒浮床立體生態(tài)養(yǎng)殖系統(tǒng)具有重要實(shí)踐意義。色氨酸作為植物生長素合成的前體物質(zhì),在植物生長過程中發(fā)揮重要作用。色氨酸可以明顯促進(jìn)玉米、甘藍(lán)的生長與養(yǎng)分吸收(陳振德等, 1997; 陳明昌等, 2005)。本實(shí)驗(yàn)中鹽度35條件下海馬齒除了形態(tài)差異外, 并未出現(xiàn)植株死亡, 與添加色氨酸有很大關(guān)系, 實(shí)驗(yàn)過程中發(fā)現(xiàn)添加色氨酸后第2 d, 海馬齒植株根部可以促生很多白色新根, 色氨酸可能改變海馬齒根際及植株體內(nèi)的生長激素水平。
通過分析推測, 海馬齒培養(yǎng)水體中色氨酸大量消耗至少存在兩個(gè)反應(yīng)過程, 一是海馬齒與根際菌均可以直接利用色氨酸, 甚至存在強(qiáng)烈競爭, 吸收后進(jìn)行運(yùn)轉(zhuǎn)、分配和代謝; 二是直接代謝釋放, 最終導(dǎo)致色氨酸大幅下降。不抑菌的實(shí)驗(yàn)瓶中, 色氨酸含量均表現(xiàn)出顯著降低, 不同鹽度處理組海馬齒根際菌聯(lián)合作用(單株)在5 d時(shí)間內(nèi)可以代謝25 mg左右的色氨酸。抑菌條件下, 色氨酸可以以分子形式直接進(jìn)入海馬齒, 海馬齒單獨(dú)作用吸收色氨酸含量在鹽度S0、S10時(shí)最高, 高鹽環(huán)境則會(huì)對色氨酸吸收產(chǎn)生一定抑制, 因此說明在鹽度0~35條件下, 有細(xì)菌存在時(shí)海馬齒對色氨酸利用具有絕對競爭優(yōu)勢(崔曉陽, 2007), 3 d時(shí)色氨酸被消耗殆盡。海馬齒單獨(dú)作用時(shí)對色氨酸的利用則處于弱勢, 海馬齒根系利用色氨酸與無機(jī)氮差異顯著, 從數(shù)值來看, 鹽度0~35范圍海馬齒對色氨酸第5 d利用量(5.36~13.08 mg)遠(yuǎn)高于硝態(tài)氮(-0.033~0.275 mg)、銨態(tài)氮(-0.942~0.340 mg)。因此, 在無機(jī)氮與色氨酸共存的抑菌情況下, 海馬齒對色氨酸利用量遠(yuǎn)高于無機(jī)氮。
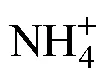
4 結(jié)論
海馬齒在鹽度10培養(yǎng)條件下生長最佳, 干物質(zhì)含量、有機(jī)元素含量與積累速率最高。不同鹽度抑菌培養(yǎng)條件下, 色氨酸與無機(jī)氮共存時(shí)均能被能被海馬齒利用, 色氨酸利用量遠(yuǎn)高于硝態(tài)氮、銨態(tài)氮; 不抑菌條件下銨態(tài)氮?jiǎng)t表現(xiàn)出增加的結(jié)果。海馬齒具有明顯碳匯作用, 可以用海馬齒浮床形式應(yīng)用于不同鹽度范圍的池塘或者水域進(jìn)行水質(zhì)修復(fù)。
馬林, 2004. 植物對氨基酸的吸收和利用[J]. 西南科技大學(xué)學(xué)報(bào)(自然科學(xué)版), 19(1): 102-107.
王進(jìn)進(jìn), 2017. 海馬齒生態(tài)浮床對高位池養(yǎng)殖效果的研究[D]. 廣州: 中山大學(xué).
王芬, 段洪利, 劉亞飛, 等, 2020. 人工濕地處理含鹽富營養(yǎng)化水的植物根際與非根際菌群分析[J]. 環(huán)境工程學(xué)報(bào), 14(7): 1844-1851.
仇元, 2016. 海馬齒生態(tài)浮床植物根際脫氮過程及影響因素的研究[D]. 廈門: 廈門大學(xué).
馮偉瑩, 朱元榮, 吳豐昌, 等, 2016. 太湖水體溶解性有機(jī)質(zhì)熒光特征及其來源解析[J]. 環(huán)境科學(xué)學(xué)報(bào), 36(2): 475-482.
劉煒, 常佳楠, 張建琳, 等, 2021. 鹽度對濱海修復(fù)種海馬齒生長及熒光參數(shù)的影響[J]. 熱帶亞熱帶植物學(xué)報(bào), 29(3): 269-275.
孫育平, 裘金木, 王國霞, 等, 2016. 低蛋白質(zhì)飼料中添加色氨酸對凡納濱對蝦飼料表觀消化率、消化酶活和全蝦氨基酸組成的影響[J]. 水生生物學(xué)報(bào), 40(4): 720-727.
巫曉杰, 申玉春, 葉寧, 等, 2011. 海馬齒對氮、磷吸收利用速率的初步研究[J]. 中國農(nóng)學(xué)通報(bào), 27(20): 92-96.
李衛(wèi)林, 羅冬蓮, 楊芳, 等, 2019. 鹽度對水培海馬齒生長和生理生化因子的影響[J]. 廈門大學(xué)學(xué)報(bào)(自然科學(xué)版), 58(1): 63-69.
李廷軒, 葉代樺, 張錫洲, 等, 2017. 植物對不同形態(tài)磷響應(yīng)特征研究進(jìn)展[J]. 植物營養(yǎng)與肥料學(xué)報(bào), 23(6): 1536-1546.
李陽, 2009. 直接發(fā)酵法生產(chǎn)L-色氨酸的研究[D]. 福州: 福建師范大學(xué).
楊芳, 李凱, 黃凌風(fēng), 等, 2014. 海馬齒根際降解可溶性蛋白質(zhì)的研究[J]. 廈門大學(xué)學(xué)報(bào)(自然科學(xué)版), 53(1): 142-148.
楊芳, 楊妙峰, 鄭盛華, 等, 2019. 東山灣海馬齒生態(tài)浮床原位修復(fù)效果研究[J]. 漁業(yè)研究, 41(3): 225-233.
張艷琳, 范偉, 蔡元保, 等, 2009. 海馬齒對不同比例淡海水組培的生長和生理響應(yīng)[J]. 西北植物學(xué)報(bào), 29(6): 1240-1245.
張博, 王書航, 姜霞, 等, 2018. 太湖五里湖水體懸浮物中水溶性有機(jī)質(zhì)(WSOM)的熒光光譜組分鑒別及其與氮形態(tài)的關(guān)系[J]. 湖泊科學(xué), 30(1): 102-111.
陳明昌, 程濱, 張強(qiáng), 等, 2005. 土施L-蛋氨酸、L-苯基丙氨酸、L-色氨酸對玉米生長和養(yǎng)分吸收的影響[J]. 應(yīng)用生態(tài)學(xué)報(bào), 16(6): 1033-1037.
陳振德, 黃俊杰, 何金明, 等, 1997. 土施L-色氨酸對甘藍(lán)產(chǎn)量和養(yǎng)分吸收的影響[J]. 土壤學(xué)報(bào), 34(2): 200-205.
胡綿好, 袁菊紅, 常會(huì)慶, 等, 2009. 鳳眼蓮-固定化氮循環(huán)細(xì)菌聯(lián)合作用對富營養(yǎng)化水體原位修復(fù)的研究[J]. 環(huán)境工程學(xué)報(bào), 3(12): 2163-2169.
莫良玉, 吳良?xì)g, 陶勤南, 2002. 高等植物對有機(jī)氮吸收與利用研究進(jìn)展[J]. 生態(tài)學(xué)報(bào), 22(1): 118-124.
崔曉陽, 2007. 植物對有機(jī)氮源的利用及其在自然生態(tài)系統(tǒng)中的意義[J]. 生態(tài)學(xué)報(bào), 27(8): 3500-3512.曾碧健, 岳曉彩, 黎祖福, 等, 2016. 生態(tài)浮床原位修復(fù)對海水養(yǎng)殖池塘浮游動(dòng)物群落結(jié)構(gòu)的影響[J]. 海洋與湖沼, 47(2): 354-359.
曾碧健, 竇碧霞, 黎祖福, 等, 2017. 海洋鹽生植物海馬齒()對環(huán)境鹽度脅迫的耐受性及營養(yǎng)價(jià)值綜合評價(jià)[J]. 海洋與湖沼, 48(3): 568-575.
霍常富, 孫海龍, 范志強(qiáng), 等, 2007. 根系氮吸收過程及其主要調(diào)節(jié)因子[J]. 應(yīng)用生態(tài)學(xué)報(bào), 18(6): 1356-1364.
BOXMAN S E, NYSTROM M, ERGAS S J,, 2018. Evaluation of water treatment capacity, nutrient cycling, and biomass production in a marine aquaponic system [J]. Ecological Engineering, 120: 299-310.
LOKHANDE V H, NIKAM T D, PENNA S, 2010. Biochemical, physiological and growth changes in response to salinity in callus cultures ofL. [J]. Plant Cell, Tissue and Organ Culture (PCTOC), 102(1): 17-25.
NIMPTSCH J, WOELFL S, OSORIO S,, 2015. Tracing dissolved organic matter (DOM) from land-based aquaculture systems in North Patagonian streams [J]. Science of the Total Environment, 537: 129-138.
ZHANG C Y, WANG D, HE W H,, 2022.-mediated removal of nitrogen and phosphorus affected by sulfadiazine in Aquaculture Wastewater [J]. Antibiotics, 11(1): 68.
ZHOU Y, ZHANG F S, YANG H S,, 2003. Comparison of effectiveness of different ashing auxiliaries for determination of phosphorus in natural waters, aquatic organisms and sediments by ignition method [J]. Water Research, 37(16): 3875-3882.
EFFECT OF SALINITY ON CARBON SEQUESTRATION BYAND UTILIZATION OF NITROGEN IN DIFFERENT FORMS
LIU Xu-Jia1, 2, 3, 4, HE Xu-Gang2, LAI Jun-Xiang1, 5, HUANG Guo-Qiang6, HOU Jie2, XIONG Xiang-Ying1, 3, LIU Jing4
(1. Guangxi Key Laboratory of Marine Environmental Science, Guangxi Academy of Marine Sciences,Guangxi Academy of Sciences, Nanning 530007, China; 2. College of Fisheries, Huazhong Agriculture University, Wuhan 430070, China; 3.Guangxi Institute of Oceanology Co. LTD, Beihai 536000, China; 4. Guangxi Key Laboratory of Marine Biodiversity Conservation, Oceanography institute, Beibu Gulf University, Qinzhou 535011, China; 5. Beibu Gulf Marine Industry Research Institute, Fangchenggang 538000, China; 6. Institute of Marine Drug, Guangxi University of Chinese Medicine, Nanning 530200, China)
salinity;; carbon sequestration; nitrogen
Q945
10.11693/hyhz20220500139
*國家自然科學(xué)基金項(xiàng)目, 31960225號(hào), 31972797號(hào); 廣西自然科學(xué)基金, 2021GXNSFAA196074號(hào); 北海市科技開發(fā)項(xiàng)目, 201995045號(hào), 202082035號(hào); 防城港市科技開發(fā)項(xiàng)目, 防科AB20014027號(hào)。劉旭佳, 博士, 副研究員, E-mail: lxu0312@126.com
何緒剛, 教授, 博士生導(dǎo)師, E-mail: xgh@mail.hzau.edu.cn
2022-05-25,
2022-09-07

