一株蹄形藻(Kirchneriella sp.)的生長和油脂積累潛力評價*
沈宏孝 李 濤 李愛芬①
一株蹄形藻(sp.)的生長和油脂積累潛力評價*
沈宏孝1李 濤2, 3①李愛芬1①
(1. 暨南大學水生生物研究中心 廣東廣州 510632; 2. 中國科學院南海海洋研究所 中國科學院熱帶海洋生物資源與生態重點實驗室 廣東省海洋藥物重點實驗室 廣東廣州 510301; 3. 南方海洋科學與工程廣東省實驗室(廣州) 廣東廣州 511458)
優質產油藻種是實現微藻油脂產業化生產的基礎, 蹄形藻可以積累高含量的儲藏性三酰甘油, 但其是否具有微藻油脂開發潛力, 目前仍然缺少系統的評價。利用形態學和分子技術對分離自暨南大學南湖的一株微藻進行鑒定, 通過設置4種硝酸鈉濃度(3.6、9.0、18.0和36.0 mmol/L), 測定生物質濃度、總脂含量、脂肪酸組成、光合效率等指標, 評價該藻株的產油能力, 并利用現有模型, 計算生物柴油的質量參數。經鑒定該藻株為蹄形藻JNU-3201 (sp. JNU-3201), 在整個培養周期內, 其碳水化合物含量(干重)均低于20%, 蛋白質含量呈降低趨勢, 總脂含量逐漸增加, 說明脂類是該藻的主要儲能物質; 主要脂肪酸包括油酸(C18︰1)、棕櫚酸(C16︰0)和亞油酸(C18︰2); 該藻株的生長和油脂含量明顯受氮素水平影響, 在最低氮濃度條件下(3.6 mmol/L), 獲得最高總脂含量(46.92%±1.52%, 干重), 在最高氮濃度條件下(36.0 mmol/L), 獲得最高生物質濃度[(6.53±0.11) g/L], 在18.0 mmol/L條件下, 獲得最高總脂產量[(2.43±0.06) g/L]; 降低氮濃度, 單不飽和脂肪酸相對含量顯著增加, 但藻細胞光合色素的含量明顯降低, 且熱和熒光損失的能量比例增加, 經模型預測該藻生物柴油的十六烷值、運動黏度、比重、密度、碘值等均符合BD 100(S10)和EN 14214標準。綜上所述, 蹄形藻JNU-3201 (sp. JNU-3201)是一株具有開發潛力的產油藻株, 可以作為生物柴油的生產原料。
蹄形藻JNU-3201; 氮濃度; 總脂; 脂肪酸; 生物柴油質量參數
產油微藻生長速度快, 環境適應性強, 可作為生物柴油生產的替代原料(Chisti, 2007), 然而, 高成本使得微藻生物柴油的規模化生產難以實現(Feng, 2021), 選育性狀優良的產油藻株是解決高成本問題的可行策略。綠藻是產油微藻最大的候選類群, 綠藻的平均總脂含量可達干重25%以上, 脂肪酸組成合理, 適宜作為生物柴油的生產原料(Hu, 2008)。蹄形藻(sp.)屬于綠藻門、綠藻綱、環藻目、硒藻科, 廣泛存在于自然界的各種水體中, 具有較強的環境適應能力, 研究表明, 蹄形藻可以積累高含量的儲藏性脂類(鄭和龍, 2019), 是一種具有微藻油脂生產潛力的藻株。
評價一株微藻是否具有生物柴油的開發潛力, 除了評價其總脂含量(產量)和生長速率外, 脂肪酸組成和光能轉化效率等指標同樣重要(Hu, 2008)。油脂的脂肪酸組成可以影響生物柴油的穩定性和理化特性(Wu, 2014), 微藻吸收的光能一部分用于光化學反應Y(II), 一部分以非光化學淬滅[non-photochemical quenching, Y(NPQ)]形式耗散, 即調節性的光保護機制耗散為熱, 剩余能量以非光誘導的非光化學猝滅[non-photoinduced non-photochemical quenching, Y(NO)]形式耗散, 即熱量和發出熒光, 擁有更高比例Y(II)和更少比例Y(NPQ)+Y(NO)的產油微藻在光能利用效率方面更具優勢, 可以作為產油潛力藻種的評價指標之一。
許多種類的微藻在營養充足條件下, 細胞內的碳水化合物和蛋白質占主要比例, 而脂類以膜脂為主, 其干重含量通常不超過20%, 只有在營養脅迫條件下, 細胞改變碳流分配轉而大量合成儲藏性脂類, 才能表現出其特有的脂類積累潛力(Liu, 2012)。低氮脅迫是一種高效的誘導脂質積累的策略(Shen, 2016)。蘇怡等(2017)將BG-11培養基中氮濃度由1.5 g/L降低為0.5 g/L時, 獲得了更高的油脂產量。佐夫色綠藻()在氮缺乏時總脂產率由68.1 mg/(L·d)提高到87.1 mg/(L·d) (Feng, 2012)。此外, 氮濃度也可以影響微藻的脂肪酸組成, 從而影響生物柴油的特性(Najafabadi, 2015)。Yaakob等(2021)報道缺氮條件會導致飽和脂肪酸和單不飽和脂肪酸比例增加。上述研究表明, 評價一株微藻是否可以作為生物柴油的生產原料, 應該適當設置一些脅迫因素誘導油脂積累, 從而評估其最大油脂積累能力。
本研究以分離自暨南大學明湖的一株淡水單細胞綠藻JNU-3201為研究對象, 首先利用形態和分子技術鑒定該藻種的種屬, 隨后設置不同濃度的硝酸鹽處理組進行一次性培養, 探討該藻生長、色素含量、光合效率、主要生化組成(總脂、可溶性蛋白、總碳水化合物)及脂肪酸組成的變化, 評估其油脂積累能力, 并利用現有模型對該藻生物柴油的主要參數進行預測, 研究結果為該藻能否作為微藻油或者生物柴油的生產原料提供理論依據。
1 材料與方法
1.1 實驗材料及保種
蹄形藻JNU-3201, 分離自暨南大學明湖(113°36′E, 23°14′N), 現保存于暨南大學水生生物研究中心。
保種: 蹄形藻JNU-3201培養于含有適量改良BG-11培養基的三角瓶, 棉花、紗布、牛油紙封口, 室溫[(25±1) °C]放置。每隔30 d左右, 更換新鮮的改良BG-11培養基。改良BG-11培養基配方如下: 18.0 mmol/L NaNO3, 0.175 mmol/L K2HPO4·3H2O, 0.304 mmol/L MgSO4·7H2O, 0.245 mmol/L CaCl2·2H2O, 0.241 mmol/L NaCO3, 11.7 μmol/L FeCl3·6H2O, 31.1 μmol/L檸檬酸, 11.7 μmol/L EDTANa2·2H2O, 46.1 μmol/L H3BO3, 9.15 μmol/L MnCl2·4H2O, 0.77 μmol/L ZnSO4·7H2O, 1.62 μmol/L Na2MoO4·2H2O, 9.15 μmol/L Co(NO3)2·6H2O, 0.32 μmol/L CuSO4·5H2O (Andersen, 2005)。
1.2 培養條件及實驗設置
蹄形藻JNU-3201置于改良BG-11中培養7 d后, 采用3 500 r/min離心收集藻細胞, 重懸浮于不同氮濃度的改良BG-11培養基后進行一次性培養。培養裝置為柱狀光生物反應器(3.0 cm × 60 cm, 300 mL), 接種密度OD750=1.00±0.05, 設置4種NaNO3濃度, 分別為3.6、9.0、18.0和36.0 mmol/L, 通入1% CO2的空氣, 培養溫度為(25±1) °C, 24 h持續單側光照射, 光強為300 μmol photons/(m2·s), 培養周期18 d, 每組設置3個平行樣(=3)。
1.3 藻種鑒定
使用光學顯微鏡BX53 (Olympus, 東京, 日本)進行形態學觀察, 利用CTAB法(Chen, 2014)進行DNA的提取, 引物序列為A(5′-ACCTGGTTGATCCT GCCAGT-3′)和B(5′-TGATCCTTCTGCAGGTTCACC TAC-3′), PCR產物回收和純化后, 委托北京擎科生物科技有限公司進行測序, 使用MEGA 7軟件, 應用最大似然法 (Maximum Likelihood, ML)構建系統進化樹。
1.4 生物量測定
取5 mL藻液置于預先烘干至恒重的濾膜上, 抽濾, 隨后將濾膜置于100 °C烘箱烘至恒重, 計算公式:生物量(單位: g/L)=200×(1–0), 其中,1是帶有生物質的濾膜重量,0是空的濾膜重量。
1.5 細胞密度測定
取藻液1 mL, 用超純水適度稀釋, 使用細胞計數板(柏奧易杰, 北京, 中國)在顯微鏡下計數, 每個樣品重復計數8次, 計算其平均值作為該樣品的細胞密度(單位: cells/mL)。
1.6 色素含量測定
取藻液1 mL, 3 500 r/min離心5 min后棄上清, 加入5 mL無水甲醇, 避光70 °C水浴20 min, 冷卻至室溫, 3 500 r/min離心5 min, 上清液測定470、652和665 nm波長下的吸光值, 利用以下公式計算色素含量。
chl a= (16.72×665–9.16×652)/(×), (1)
chl b= (34.09×652–15.28×665)/(×), (2)
總葉綠素chl=chl a+chl b, (3)
總類胡蘿卜素car=(1 000×470–1.63×chl a–104.96
×chlb)/[221×(×)], (4)
其中,chl a是葉綠素含量(單位: mg/g),chl b是葉綠素含量(單位: mg/g),chl是總葉綠素含量(單位: mg/g),car是總類胡蘿卜素含量(單位: mg/g),470是470 nm處的吸光度值,652是652 nm處的吸光度值,665是665 nm處的吸光度值,是稀釋倍數,是生物量(單位: g/L)。
1.7 葉綠素熒光參數測定
藻液暗適應20 min, 利用脈沖調制式葉綠素熒光儀XE-PAM (Walz, Effectnich, 德國)測定光系統Ⅱ的實際光合效率Y(II)、調節性光保護機制的熱耗散Y(NPQ)、被動熱耗散和熒光能Y(NO)。先打開測量光[<0.1 μmol photons/(m2·s)]照射30 s, 隨后開啟飽和脈沖光[4 000 μmol photons/(m2·s)]照射0.8 s, 測得最大熒光m, 打開光化光[300 μmol photons/(m2·s)]照射10 min, 測得, 再次打開飽和脈沖光[4 000 μmol photons/(m2·s)]照射0.8 s, 測量m′。
Y(II)=(m′–)/m′, (5)
Y(NO)=/m, (6)
Y(NPQ)=/m′–/m, (7)
其中,m是所有PSII中心關閉的情況下, 樣品暗適應后的最大熒光值;m′是在所有PSⅡ中心關閉的情況下, 照射樣品后的最大熒光值;是打開光化光之后測得的熒光值。
1.8 主要生化組成測定及產率計算
稱取100 mg藻粉, 利用兩步有機溶劑抽提法進行總脂的提取(第一步為甲醇︰二甲亞砜=9︰1, 第二步為正己烷︰乙醚=1︰1), 利用重量法測定總脂含量(Khozin, 2005)。稱取脫脂藻渣10 mg, 利用0.5 mol/L的NaOH溶液進行可溶性蛋白的提取, 采用Lowry法測定可溶性蛋白含量(Lowry, 1951)。稱取脫脂藻渣10 mg, 利用0.5 mol/L的H2SO4溶液, 進行總碳水化合物的提取, 采用苯酚-硫酸法測定總碳水化合物含量(Dubois, 1956)。
總脂產率=(生物量×總脂含量)/培養時間, (8)
可溶性蛋白產率=(生物量×可溶性蛋白含量) /培養時間, (9)
總碳水化合物產率=(生物量×總碳水化合物含量)/培養時間. (10)
1.9 脂肪酸組成測定
稱取25 mg干藻粉, 加入2 mL H2SO4︰無水甲醇︰甲苯(體積比為2︰88.2︰9.8)混合溶液, 80 °C的水浴1.5 h, 隨后加入1 mL純水和1 mL正己烷震蕩分層, 取上層有機相用氮氣吹干, 同時加入1 mL十七烷酸甲酯, 利用GC-2014氣相色譜儀(Shimadzu, 日本)進行測定(Khozin-Goldberg, 2005), 色譜條件為: 以高純氮氣為載氣, DB-5毛細管柱, 進樣口溫度260 °C, 60 °C保留2 min, 30 °C/min升溫至120 °C, 1.5 °C/min升溫至250 °C保留2 min, 檢測器為FID。
1.10 物柴油參數測定
使用Biodiesel Analyzer (Version 2.2)計算生物柴油質量參數, 包括: 十六烷值、運動黏度、比重、密度、碘值、氧化穩定性, 計算公式如下:
N=46.3+(5.458/V)–(0.225×V), (Knothe, 2006) (11)
V=∑(560×)/, (Talebi, 2014) (12)
V=∑(254××)/, (Talebi, 2014) (13)
ln=∑Ni(–12.503+(2.496×lnwi)–0.178×D),
(Ramírez-Verduzco, 2012) (14)
=∑N(0.8463+(4.9/wi)+0.0118×D),
(Ramírez-Verduzco, 2012) (15)
其中,N是十六烷值,V是皂化值(單位: mg KOH/g),V是碘值(單位: g I2/100 g),是運動黏度(單位: mm2/s),是密度(單位: g/cm3),是油樣中特定脂肪酯的百分比,是脂肪酯的相對分子質量,是脂肪酯中雙鍵的數量,N是生物柴油中給定脂肪酸的百分比,wi是脂肪酸的分子量,D是給定脂肪酸中雙鍵的數量。
1.11 數據分析
使用Origin 9.0進行科研制圖, 使用SPSS 22.0對數據進行單因素方差分析,<0.05表示顯著性差異。
2 結果
2.1 綠藻JNU-3201的形態特征和種屬鑒定
綠藻JNU-3201在光學顯微鏡呈馬蹄形, 其長度為4~6 μm, 寬度為1~2 μm, 無聚集生長現象(圖1a, 1b)。構建基于18s rRNA序列的系統進化樹, 該藻株與肥壯蹄形藻(ACOI 3125)親緣關系最近(圖1c), 初步將其鑒定為蹄形藻(sp.), 隸屬于綠藻門(Chlorophyta)、綠藻綱(Chlorophyceae)、環藻目(Sphaeropleales)、硒藻科(Selenastraceae)、蹄形藻屬(sp.)。
2.2 不同氮濃3度對蹄形藻JNU-3201生長的影響
不同氮濃度下蹄形藻JNU-3201的生長表現出顯著差異。隨氮濃度增加, 蹄形藻JNU-3201生物量逐漸增加(圖2a), 培養結束時, 36.0 mmol/L組生物量最高[(6.53±0.11) g/L], 3.6 mmol/L組生物量[(2.93±0.06) g/L]顯著低于另外3個實驗組(<0.05)。3.6、9.0和18.0 mmol/L組的細胞密度在第6天后基本不再增加, 36.0 mmol/L組第8天后不再增加(圖2b)。初始氮濃度越低, 培養物顏色變化越明顯(圖2c), 3.6和9.0 mmol/L組培養前3天顏色由深綠色變為淺綠色, 培養結束時變為橙黃色, 而18.0和36.0 mmol/L組的培養物顏色始終保持綠色。

圖1 蹄形藻JNU-3201顯微圖片(a, b)與基于18s rRNA的系統進化樹(c)
注: 圖中加粗字體表示本研究所用藻株的編號

圖2 不同氮濃度條件下蹄形藻JNU-3201生長變化
注: a: 生物量; b: 細胞數目; c: 培養物顏色; 圖2a中a1~c1代表第6天生物量的顯著性差異, a2~d2代表第18天生物量的顯著性差異; 圖2b中a1~d1代表第6天細胞密度的顯著性差異, a2~c2代表第18天細胞密度的顯著性差異; 圖2c中培養物顏色由綠到黃, 代表藻細胞受氮脅迫程度增加
2.3 不同氮濃度對蹄形藻JNU-3201色素含量變化的影響
隨著初始氮濃度增加, 總葉綠素含量和總類胡蘿卜素含量增高。培養前2天, 9.0、18.0和36.0 mmol/L組總葉綠素含量和總類胡蘿卜素含量增加, 第2天總葉綠素含量達到最高值, 分別為(22.88±1.82)、(25.37± 1.87)和(28.19±2.03) mg/g, 同時總類胡蘿卜素含量也達到最高值, 分別為(6.17±0.44)、(6.14±0.52)和(6.70±0.33) mg/g。隨后逐漸下降, 3.6和9.0 mmol/L組總葉綠素含量和總類胡蘿卜素含量比18.0和36.0 mmol/L組降低速度更快(圖3a, 3b)。氮濃度越低, 類胡蘿卜素/葉綠素越高(圖3c), 說明類胡蘿卜素比例不斷提高, 表觀現象反映于培養物顏色變為橙色(圖2c)。

圖3 不同氮素水平下蹄形藻JNU-3201的色素含量
注: a: 總葉綠素; b: 總類胡蘿卜素; c: 總類胡蘿卜素/總葉綠素; 圖3a中a1~c1代表第6天總葉綠素含量的顯著性差異, a2~c2代表第18天總葉綠素含量的顯著性差異; 圖3b中a1~c1代表第6天總類胡蘿卜素含量的顯著性差異, a2~c2代表第18天總類胡蘿卜素含量的顯著性差異; 圖3c中a1~c1代表第6天總類胡蘿卜素/總葉綠素的顯著性差異, a2~c2代表第18天總類胡蘿卜素/總葉綠素的顯著性差異
2.4 不同氮濃度對蹄形藻JNU-3201光合特性的影響
葉綠素熒光參數可以表征藻細胞光合效率的變化。如圖4所示, 隨著培養時間的延續, 蹄形藻JNU-3201在4種氮濃度條件下的Y(Ⅱ)比例逐漸減少, 3.6 mmol/L組Y(Ⅱ)比例的降速明顯快于18.0和36.0 mmol/L組。3.6和9.0 mmol/L組Y(NO)比例的增加速度較快, 表明氮濃度低, 光能偏向于被動耗散為熱量和發出熒光(圖2c)。培養12天后, 18.0和36.0 mmol/L組Y(NPQ)比例顯著增加, 表明氮充足條件可以減少培養后期藻細胞光系統的損傷。
2.5 不同氮濃度對蹄形藻JNU-3201三大物質含量及產量的影響
不同氮濃度條件下, 培養前3天藻細胞優先積累碳水化合物, 3.6 mmol/L組碳水化合物的積累速率高于其他處理組(圖5b), 培養第3~6天, 9.0、18.0、36.0 mmol/L組碳水化合物繼續積累, 培養第6天各濃度組碳水化合物含量達到最高值, 之后逐漸降低(圖5b)。培養開始后, 3.6 mmol/L組蛋白質含量迅速下降, 培養第0~3天, 9.0、18.0和36.0 mmol/L組蛋白質含量增加, 差異不顯著, 3天后各濃度組蛋白質含量持續下降, 培養第3~6天, 下降速度較快, 6天后下降速度變慢, 氮濃度越低, 蛋白質含量下降越快(圖5c)。前3天脂質含量降低, 3天后脂質含量迅速增加, 3~18天脂質持續積累(圖5a), 培養至18天, 3.6、9.0、18.0和36.0 mmol/L組總脂含量(干重)分別為46.92%±1.52%、42.25%±2.12%、39.66%±7.61%和37.31%±5.52%, 表明降低氮濃度有利于蹄形藻JNU- 3201積累脂質。隨培養進行, 各濃度組總脂產量逐漸增加, 培養至18天, 18.0 mmol/L組總脂產量最高為(2.43±0.06) g/L。隨培養進行, 3.6、9.0、18.0 mmol/L組總碳水化合物和可溶性蛋白產量逐漸降低, 36.0 mmol/L組總碳水化合物和可溶性蛋白產量先增加后降低, 第12天總碳水化合物和可溶性蛋白產量都達到最大值, 分別為(1.28±0.01)和(1.98±0.01) g/L。
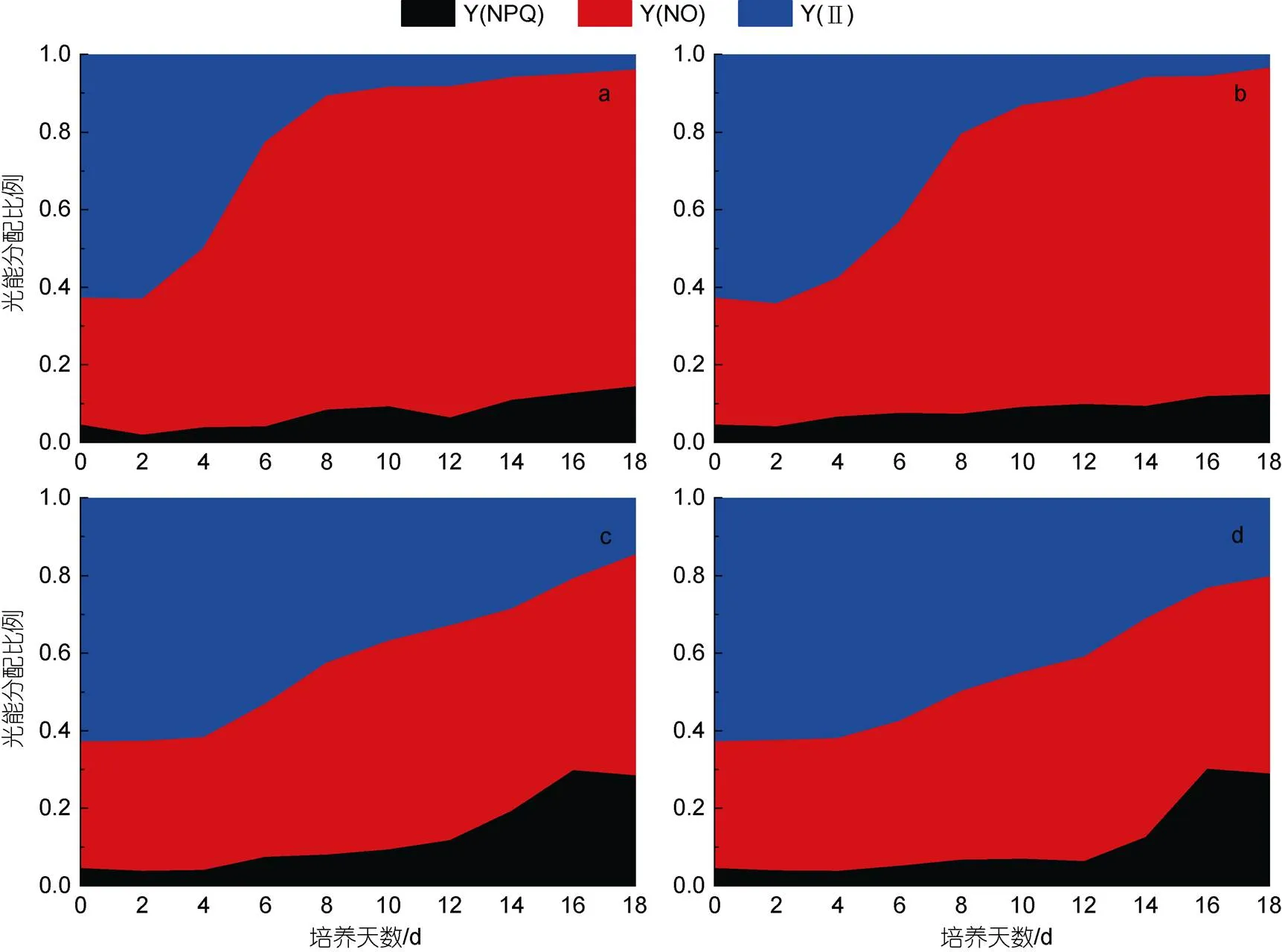
圖4 不同氮素濃度條件下蹄形藻JNU-3201光能分配比例的變化
注: a: 氮素濃度3.6 mmol/L; b: 氮素濃度9.0 mmol/L; c: 氮素濃度18.0 mmol/L; d: 氮素濃度36.0 mmol/L; 測定點: 0、2、4、6、8、10、12、14、16、18 天
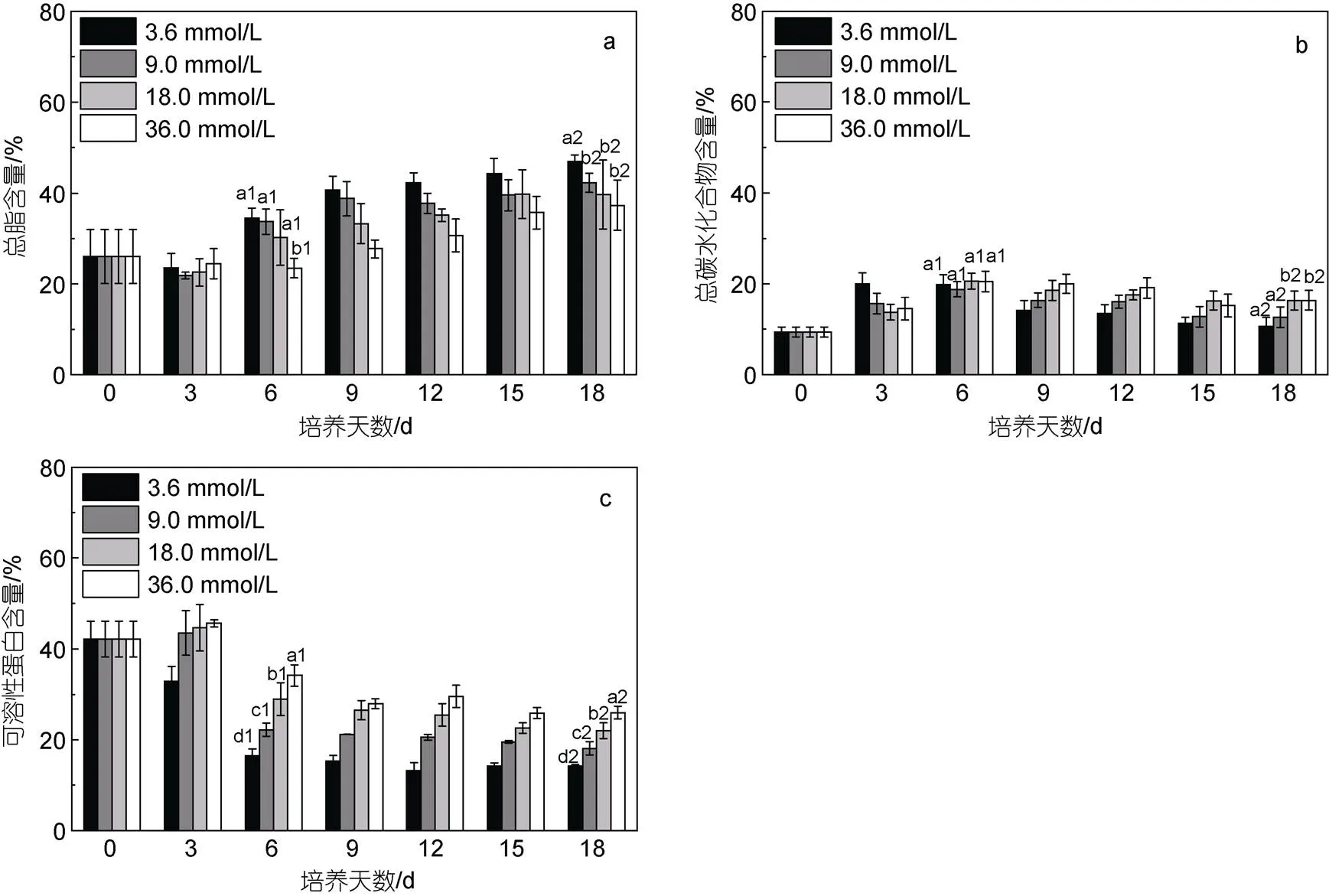
圖5 蹄形藻JNU-3201總脂、總碳水化合物、可溶性蛋白含量變化(干重)
注: a: 總脂; b: 總碳水化合物; c: 可溶性蛋白; 圖5a中a1~b1代表第6天總脂含量的顯著性差異, a2~b2代表第18天總脂含量的顯著性差異; 圖5b中a1代表第6天總碳水化合物含量無顯著性差異, a2~b2代表第18天總碳水化合物含量的顯著性差異; 圖5c中a1~d1代表第6天可溶性蛋白含量的顯著性差異, a2~d2代表第18天可溶性蛋白含量的顯著性差異
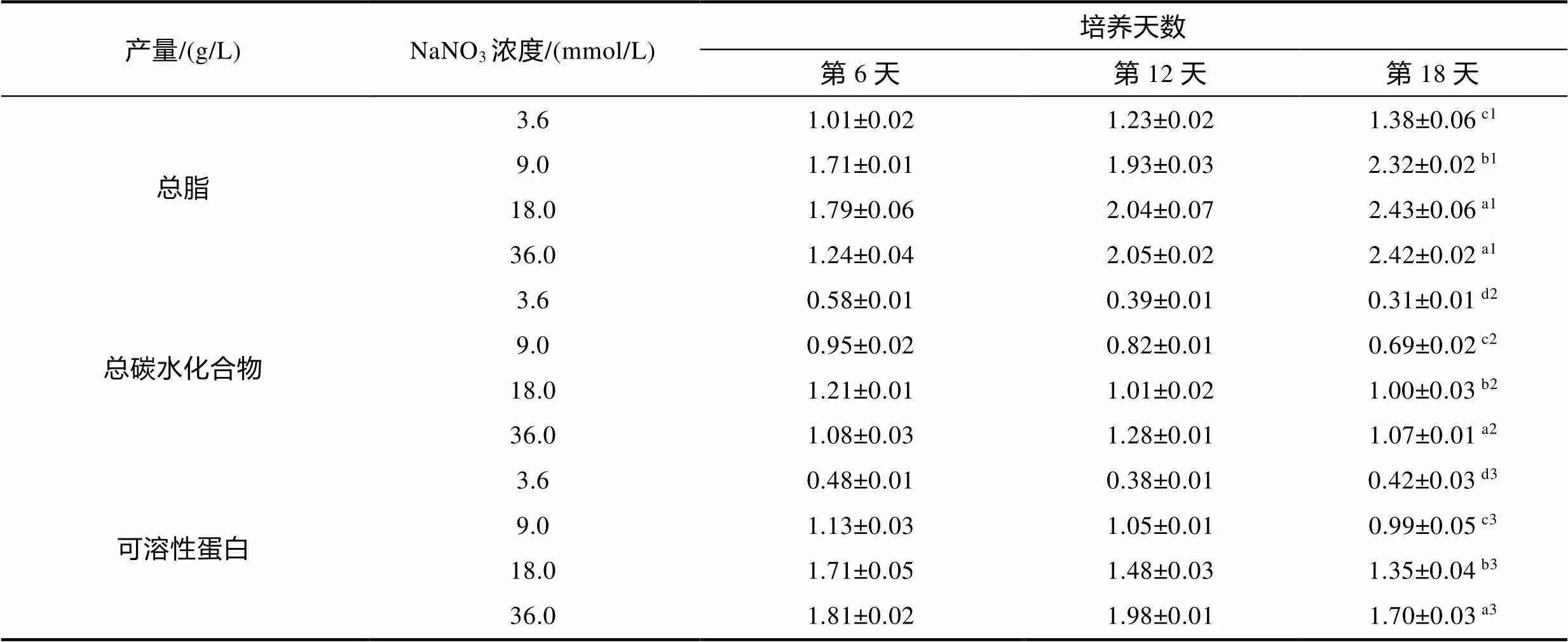
表1 不同氮素水平下蹄形藻JNU-3201的總脂產量、總碳水化合物產量、可溶性蛋白產量
注: a1~c1代表第18天總脂產量的顯著性差異; a2~d2代表第18天總碳水化合物產量的顯著性差異; a3~d3代表第18天可溶性蛋白產量的顯著性差異
2.6 不同氮濃度對蹄形藻JNU-3201脂肪酸的影響
蹄形藻JNU-3201的主要脂肪酸包括棕櫚酸(C16︰0)、油酸(C18︰1)亞油酸(C18︰2), 含量最高的脂肪酸為油酸(C18︰1)(表2), 培養至9天, 9.0、18.0和36.0 mmol/L組油酸含量分別為總脂肪酸(total fatty acid, TFA)的56.5%±1.1%、56.1%±1.2%和58.2%±1.2%, 之后逐漸下降。隨培養進行, 3.6 mmol/L組油酸含量不斷增加, 培養至18天, 3.6 mmol/L組油酸含量最高, 為58.8%±1.2% TFA。3.6和9.0 mmol/L組的棕櫚油酸(C16︰1)含量低于對照組(18.0 mmol/L), 36.0 mmol/L組棕櫚油酸含量高于18.0 mmol/L組, 培養至18天, 4組氮濃度下C16和C18脂肪酸占比之和均超過95%。3.6 mmol/L組單不飽和脂肪酸含量最高(61.5%±0.6% TFA), 9.0 mmol/L組飽和脂肪酸含量最高(24.4%± 0.2% TFA)。
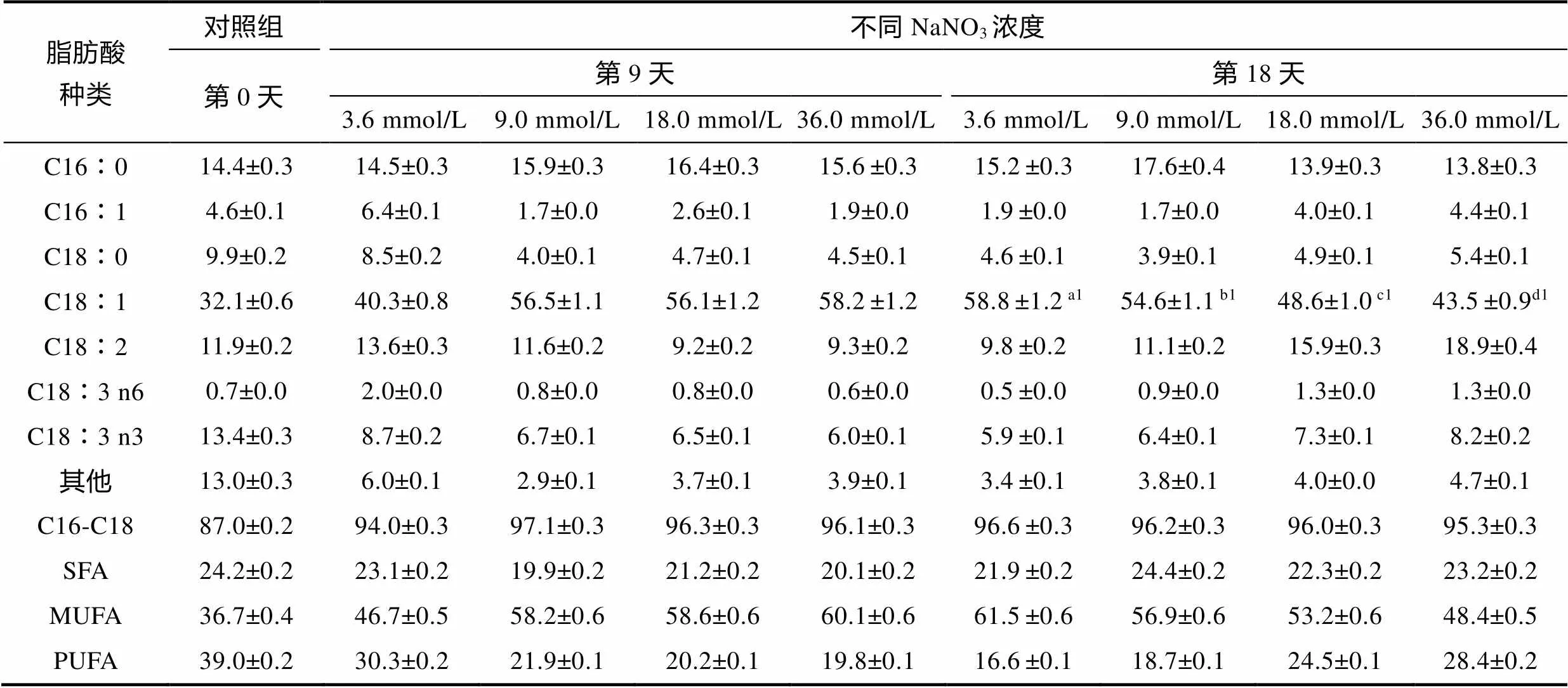
表2 不同氮素水平下蹄形藻JNU-3201脂肪酸組成
注: SFA: 飽和脂肪酸; MUFA: 單不飽和脂肪酸; PUFA: 多不飽和脂肪酸; a1~d1代表第18天油酸的顯著性差異。
2.7 不同氮濃度對蹄形藻JNU-3201生物柴油參數的影響
根據蹄形藻JNU-3201的脂肪酸組成, 利用Biodiesel Analyzer軟件對其生物柴油質量參數進行預測, 并與中國生物柴油標準BD100 (S10)和歐盟生物柴油標準EN 14214對比, 預測結果如表3所示。隨初始氮濃度增加, 十六烷值和運動黏度降低, 均符合EN14214和BD100 (S10)標準。不同氮濃度組比重相同, 均是0.88 kg/L, 符合EN 14214標準。密度和氧化穩定性符合BD100 (S10)標準, 隨氮濃度增加, 氧化穩定性水平降低, 碘值增加, 符合EN 14214標準。

表3 不同氮素水平下蹄形藻JNU-3201生物柴油性能評價
注: BD 100: 中國生物柴油標準(中華人民共和國國家質量監督檢驗檢疫總局, 2017); S10: 硫含量不超過10 mg/kg; EN 14214: 歐盟生物柴油標準(European Committee for Standardization, 2008); –: 未給出標準值; a1代表十六烷值無顯著性差異; a2代表運動黏度無顯著性差異; a3代表比重無顯著性差異; a4代表密度無顯著性差異; a5~d5代表碘值的顯著性差異; a6~d6代表氧化穩定性的顯著性差異。
3 討論
3.1 蹄形藻JNU-3201的生長特性
蹄形藻是一種分布廣泛的淡水單細胞綠藻, 經常被發現于湖泊、水庫、池塘、沼澤和稻田等水體, 最近一些研究表明該種藻具有較強的環境適應能力和較快的生長速率。Hussian等(2018)從埃及曼扎拉湖(Lake Manzala)中分離出31株綠藻, 發現蹄形藻為顯著優勢種。鄭和龍(2019)報道蹄形藻的細胞分裂速率顯著高于尖狀柵藻、斜生柵藻和小球藻。Dextro (2021)的研究表明蹄形藻比索羅金小球藻()具有更強的競爭力。上述特性有利于蹄形藻在戶外培養時減少雜藻污染的機會。蹄形藻JNU-3201在氮濃度3.6~36.0 mmol/L條件下均能正常生長, 說明其具有較強的氮濃度適應范圍。許多微藻在較高的氮濃度條件下, 細胞生長受到嚴重抑制。石巖峻等(2004)研究結果表明較高的氮濃度下微小原甲藻()生物量、比生長速率以及細胞密度均最低, 不利于其生長。本研究表明蹄形藻JNU-3201的生物量與氮濃度呈正相關, 這與許多以往報道一致(Breuer, 2012; Zhu, 2014; Delgado, 2021)。蹄形藻JNU-3201在氮濃度36.0 mmol/L取得最高生物量為(6.53±0.11) g/L, 與以往報道的自養藻種生物量相比, 處于相對中上水平。
不同氮濃度培養條件下, 微藻的生長情況呈現顯著差異, 高氮組獲得了比低氮組更高的細胞密度, 由于細胞之間存在遮光效應, 高氮組單位藻細胞接收到的光量子數低于低氮組。從另外一個角度考慮, 低氮組由于氮限制的影響, 藻細胞的光合色素合成受阻, 因此, 低氮組細胞的葉綠素含量低于高氮組[由培養物的顏色變化(圖2c)可以看出], 光合色素含量降低對微藻的光吸收能力產生負面影響, 從而導致低氮組細胞吸收的光量子或者參與光反應的光量子比例少于高氮組, 具體比例需要更加深入的量化研究進行確定。值得注意的是, 蹄形藻JNU-3201的最高細胞密度并未在氮濃度36.0 mmol/L時獲得, 而是在氮濃度9.0 mmol/L時獲得, 這一結果與李濤(2013)對荒漠柵藻和韋氏真眼點藻的研究結果類似, 推測其原因可能是適當氮脅迫水平下微藻優先進行細胞分裂, 以保證細胞密度, 待外界條件好轉再進行營養生長, 具體機制還需要通過分子手段進一步驗證。
3.2 蹄形藻JNU-3201的光能分配特性
利用葉綠素熒光技術可以探究藻細胞吸收光能后的能量分配情況。常用以下三個參數表征能量(激發能)的去向: Y(Ⅱ)、Y(NO)和Y(NPQ), 三者之和為1。其中, Y(Ⅱ)反映藻細胞光合效率的高低; Y(NO)為被動耗散為熱量和發出熒光的能量, 反映光系統Ⅱ反應中心關閉時的熒光耗散, 其值升高說明藻細胞光系統受到損傷; Y(NPQ)反映藻細胞通過光保護機制耗散為熱的能量, 是光系統的可逆調節過程(Klughammer, 2008)。藻細胞在正常生長條件下, 通常具有較高的Y(Ⅱ), 而在輕微脅迫條件下, Y(Ⅱ)降低, Y(NPQ)和Y(NO)升高, 而當Y(NO)大幅度升高時, 表明藻細胞正面臨不可逆的光系統損傷。在本研究中, 由Y(Ⅱ)看出, 在培養前期蹄形藻JNU-3201具有較高的光合效率, 隨培養進行, Y(Ⅱ)減少、Y(NO)+Y(NPQ)大幅增加, 說明藻細胞用于光反應的光能越來越少, 隨著氮濃度的越低, Y(Ⅱ)降低幅度越明顯, Y(NO)+Y(NPQ)增加幅度越大, Y(NO)+Y(NPQ)增加可能與缺氮導致的光系統蛋白合成受阻或者蛋白分解有關。大量研究表明低氮脅迫可以誘導產油微藻快速積累油脂, 但低氮濃度卻明顯降低了藻細胞的光合效率。光合作用是微藻一切能量的來源, 光合效率降低勢必會影響微藻的生長和主要產物的積累。
大量研究表明, 產油微藻的光合效率與其油脂含量常呈現負相關, 特別是在氮限制條件下尤為明顯, 氮限制導致光合色素合成受阻, 色素蛋白復合物和Rubisco酶分解加劇, 從而顯著降低藻細胞的光合效率, 但氮限制可以改變碳流分配, 促進產油藻細胞合成更多的儲藏性脂類, “低光合效率”與“高油脂含量”這一矛盾一直是藻類學家試圖解決的科學問題。李濤等(2011)發現可能存在不同類型的產油微藻, 其中一種就是綠色產油微藻, 在培養末期, 綠色藻細胞依然可以大量合成油脂, 本研究的蹄形藻在培養中期已變為黃色, 說明它通過光合作用同化碳源的能力減弱, 雖然碳流傾向于合成儲藏性油脂, 但由于其光合固碳能力減弱, 因此對細胞最終的油脂產量會產生一定影響。藻細胞在氮充足條件下, 具有較高光合效率, 但藻細胞合成油脂的能力較弱, 在氮限制條件下, 藻細胞大量合成油脂, 但光合效率較弱, 因此尋找適宜的氮濃度, 在“保證藻細胞具有較高光合效率的前提下, 誘導微藻合成儲藏性油脂”也是一種提高油脂產量的策略, 這也是針對本研究藻種的一種有效策略。
3.3 蹄形藻JNU-3201三大物質變化及油脂產量分析
蹄形藻JNU-3201的脂類、蛋白質和碳水化合物含量在培養周期內呈現趨勢性變化規律, 隨培養時間的延續, 藻細胞的脂類含量逐漸增加, 而蛋白質含量和碳水化合物含量呈現降低趨勢, 上述結果表明蹄形藻JNU-3201用于儲藏能量和碳源的主要物質可能是脂類, 其總脂含量最高可達40%以上, 對比以往研究結果, 綠藻平均總脂含量(干重)25% (Hu, 2008), 說明該藻具有較好的油脂生產潛力, 可以認為是一株產油微藻。此外, 脂類、蛋白質和碳水化合物含量的變化趨勢與氮濃度高低存在相關性, 低氮有利于脂類的積累, 而高氮更有利于蛋白質和碳水化合物的積累, 這一規律與大多數研究相似, 如微芒藻、真眼點藻、小球藻等(辜博等, 2011; Zhang, 2013; Adenan, 2016)。
低氮限制可以顯著促進微藻油脂的積累, 一方面, 低氮限制作為一種逆境條件, 微藻通過合成一些儲存物質(油脂和碳水化合物)或者減少高耗能代謝(如細胞分裂), 從而保證細胞渡過逆境, 而油脂作為高效的能量和碳源儲藏物, 對產油微藻來說是一種較優選擇; 另一方面, 從脂類代謝層面, 微藻通過加強脂類合成代謝的關鍵酶, 例如甘油-3-磷酸酰基轉移酶、溶血磷脂酸酰基轉移酶或二酰基甘油酰基轉移酶, 從而加強油脂的合成 (Taylor, 2002; Lardizabal, 2008; Zheng, 2008)。
低氮脅迫是誘導產油微藻油脂積累的有效條件之一, 但并非獲得最高總脂產量的必要條件, 因為總脂產量是生物量和總脂含量的乘積, 其數值高低不僅與藻細胞的總脂含量有關, 與生物量也存在較大關系(Rodolfi, 2009)。海綠球藻()和微綠球藻()均在最高總脂含量的實驗組中, 總脂產量達到最高值, 分別為0.25和0.23 g/L(梁英等, 2020)。共培養柵藻(sp.)和酵母(Yeast CCMY), 在最高生物量的實驗組, 總脂產量最高為0.29 g/L (Suastes-Rivas, 2020)。本研究中蹄形藻JNU-3201在非最高生物量、非最高總脂含量的實驗組, 獲得最高總脂產量為(2.43±0.06) g/L, 上述結果表明不同藻株的總脂產量受到總脂含量和生物量影響的權重不同, 獲得微藻最高總脂產量需要根據藻種特性, 選取適宜的誘導方式。
Hu等(2008)對近60年的能源藻株進行分析匯總, 報道綠藻平均總脂含量(干重)達到25%。許瑾等(2011)研究報道24株產油藻的總脂含量(干重)和總脂產量, 分別為15.57%~53.30%和0.57~2.36 g/L, 其中9株產油藻的總脂含量(干重)高于40%。蹄形藻JNU-3201的總脂含量(干重)最高可達46.92±1.52%, 總脂產量達到(2.43±0.06) g/L, 對比以往研究結果, 說明蹄形藻JNU-3201具有較好的油脂生產潛力, 可作為產油候選藻株。
3.4 蹄形藻JNU-3201脂肪酸變化特性及生物柴油性能評價
脂肪酸按照飽和程度劃分為飽和脂肪酸、單不飽和脂肪酸和多不飽和脂肪酸。Moser(2014)研究表明高比例的飽和脂肪酸與單不飽和脂肪酸, 是作為生物柴油原料的有利條件之一。蹄形藻JNU-3201飽和脂肪酸與單不飽和脂肪酸的總含量高達總脂肪酸的83.4%±0.4%, 具有作為生物柴油原材料的潛力。油酸(C18︰1)的氧化穩定性強于亞油酸(C18︰2)和亞麻酸(C18︰3)(羅曉嵐等, 2010)。蹄形藻JNU-3201含量最高的脂肪酸是油酸, 可達到總脂肪酸的58.8%±1.2%, 低氮限制(3.6 mmol/L)促進油酸的積累, 表明氮限制可能有利于增強其油脂的氧化穩定性。本研究富氮組(36.0 mmol/L)的多不飽和脂肪酸含量比對照組(18.0 mmol/L)增加了15.9%。有研究表明細胞膜中不飽和脂肪酸比例提高, 有利于提高膜的流動性(Pancha, 2015), 這可能是蹄形藻JNU-3201耐受高氮脅迫的原因之一, 其耐受機制還需要從分子層面進一步研究。
生物柴油樣品的質量參數可以反映生物柴油性能, 但其實驗測定過程冗長且成本較高, 獲取足夠多的樣本、詳細分析等過程也可能存在各種阻礙(Talebi, 2013)。生物柴油的質量參數由原材料的脂肪酸組成所決定, 分析脂肪酸組成可以預測生物柴油性能。Talebi等(2014)基于前人報道的高可靠性建模數據, 開發出一個新型評價生物柴油樣品質量參數的軟件Biodiesel Analyzer, 以便于快速高效分析生物柴油的性能, 降低篩選生物柴油原材料的成本。本研究中蹄形藻JNU-3201的6項生物柴油參數均符合BD100 (S10)和EN14214標準, 初步表明蹄形藻JNU-3201可以作為生產生物柴油的原材料。
4 結論
新分離的淡水藻株鑒定為蹄形藻(sp.),該藻主要儲能物質為脂質。蹄形藻富含油酸(C18︰1)、棕櫚酸(C16︰0)和亞油酸(C18︰2), 十六烷值、運動黏度、比重、密度、碘值等6項生物柴油質量參數均符合BD100(S10)和EN14214標準。該藻產油能力受氮素水平的影響較為顯著, 在最低氮濃度條件下(3.6 mmol/L), 獲得最高總脂含量(46.92%±1.52%, 干重), 在18.0 mmol/L條件下, 總脂產量最高達到(2.43±0.06) g/L。上述研究表明蹄形藻JNU-3201是一株具有開發潛力的優質產油藻株。
中華人民共和國國家質量監督檢驗檢疫總局, 中國國家標準化管理委員會, 2017. B5柴油: GB 25199-2017[S]. 北京: 中國標準出版社.
石巖峻, 胡晗華, 馬潤宇, 等, 2004. 不同氮磷水平下微小原甲藻對營養鹽的吸收及光合特性[J]. 過程工程學報, 4(6): 554-560.
許瑾, 張成武, 李愛芬, 等, 2011. 華南地區淡水產油微藻藻株的分離與篩選[J]. 可再生能源, 29(1): 66-71.
蘇怡, 高保燕, 黃羅冬, 等, 2017. 不同氮源及氮濃度對真眼點藻綱微藻生長及油脂積累的影響[J]. 水生生物學報, 41(3): 677-691.
李濤, 2013. 產油微藻的篩選與評價、高產油策略及其差異性研究[D]. 廣州: 暨南大學: 82.
李濤, 李愛芬, 桑敏, 等, 2011. 富油能源微藻的篩選及產油性能評價[J]. 中國生物工程雜志, 31(4): 98-105.
羅曉嵐, 朱文鑫, 2010. 油茶籽油加工和油茶資源綜合利用[J]. 中國油脂, 35(9): 13-17.
鄭和龍, 2019. 不同氮素濃度對5株微藻生長及其生化組成特征的影響[D]. 廣州: 暨南大學: 24-25, 15-16.
梁英, 紀維瑋, 石偉杰, 等, 2020. 氮限制時間對海綠球藻和微綠球藻生長、總脂含量及脂肪酸組成的影響[J]. 海洋科學, 44(2): 45-55.
辜博, 費小雯, 胡新文, 等, 2011. 營養元素限制對微芒藻Y-002油脂積累的影響[J]. 熱帶作物學報, 32(5): 789-795.
ADENAN N S, YUSOFF F M, MEDIPALLY S R,, 2016. Enhancement of lipid production in two marine microalgae under different levels of nitrogen and phosphorus deficiency [J]. Journal of Environmental Biology, 37(Special issue): 669-676.
ANDERSEN R A, 2005. Algal Culturing Techniques [M]. Burlington: Elsevier: 435-436.
BREUER G, LAMERS P P, MARTENS D E,, 2012. The impact of nitrogen starvation on the dynamics of triacylglycerol accumulation in nine microalgae strains [J]. Bioresource Technology, 124: 217-226.
CHEN Z R, LEI X Q, ZHANG B Z,, 2014. First report ofsp, a new pathogen for a potential energy-producing algae:cultures [J]. PLoS One, 9(3): e89571.
CHISTI Y, 2007. Biodiesel from microalgae [J]. Biotechnology Advances, 25(3): 294-306.
DELGADO R T, DOS SANTOS GUARIEIRO M, ANTUNES P W,, 2021. Effect of nitrogen limitation on growth, biochemical composition, and cell ultrastructure of the microalga[J]. Journal of Applied Phycology, 33(4): 2083-2092.
DEXTRO R B, 2021. Growth dynamic on a co-cultivation of two Chlorophyta microalgae exposed to copper [J]. Acta Limnologica Brasiliensia, 33: e16.
DUBOIS M, GILLES K A, HAMILTON J K,, 1956. Colorimetric method for determination of sugars and related substances [J]. Analytical Chemistry, 28(3): 350-356.
European Committee for Standardization, 2008. Automotive fuels-Fatty acid methyl esters (FAME) for diesel engines- Requirements and test methods: SS-EN 14214:2008 [S]. Brussels.
FENG P Z, DENG Z Y, FAN L,, 2012. Lipid accumulation and growth characteristics ofunder different nitrate and phosphate concentrations [J]. Journal of Bioscience and Bioengineering, 114(4): 405-410.
FENG Y J, XIAO J M, CUI N,, 2021. Enhancement of lipid productivity and self-flocculation by cocultivatingsp. FXY-10 andsp. Yu under mixotrophic mode [J]. Applied Biochemistry and Biotechnology, 193(10): 3173-3186.
HU Q, SOMMERFELD M, JARVIS E,, 2008. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances [J]. The Plant Journal, 54(4): 621-639.
HUSSIAN A E M, EL-MONEM A M A, NAPIóRKOWSKA- KRZEBIETKE A,, 2018. Short-term changes in phytoplankton assemblages and their potential for heavy metal bioaccumulation - a laboratory study [J]. Oceanological and Hydrobiological Studies, 47(3): 260-274.
KHOZIN-GOLDBERG I, SHRESTHA P, COHEN Z, 2005. Mobilization of arachidonyl moieties from triacylglycerols into chloroplastic lipids following recovery from nitrogen starvation of the microalga[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 1738(1/2/3): 63-71.
KLUGHAMMER C, SCHREIBER U, 2008. Complementary PS II quantum yields calculated from simple fluorescence parameters measured by PAM fluorometry and the saturation pulse method [J]. PAM Application Notes, 1: 27-35.
KNOTHE G, 2006. Analyzing biodiesel: standards and other methods [J]. Journal of the American Oil Chemists’ Society, 83(10): 823-833.
LARDIZABAL K, EFFERTZ R, LEVERING C,, 2008. Expression of umbelopsis ramanniana DGAT2A in seed increases oil in soybean [J]. Plant Physiology, 148(1): 89-96.
LIU W H, HUANG Z W, LI P,, 2012. Formation of triacylglycerol inf. minutissima under nitrogen limitation and possible physiological and biochemical mechanisms [J]. Journal of Experimental Marine Biology and Ecology, 418/419: 24-29.
LOWRY O H, ROSEBROUGH N J, FARR A L,, 1951. Protein measurement with the Folin phenol reagent [J]. The Journal of Biological Chemistry, 193(1): 265-275.
MOSER B R, 2014. Impact of fatty ester composition on low temperature properties of biodiesel-petroleum diesel blends [J]. Fuel, 115: 500-506.
NAJAFABADI H A, MALEKZADEH M, JALILIAN F,, 2015. Effect of various carbon sources on biomass and lipid production ofduring nutrient sufficient and nitrogen starvation conditions [J]. Bioresource Technology, 180: 311-317.
PANCHA I, CHOKSHI K, MAURYA R,, 2015. Salinity induced oxidative stress enhanced biofuel production potential of microalgaesp. CCNM 1077 [J]. Bioresource Technology, 189: 341-348.
RAMíREZ-VERDUZCO L F, RODRíGUEZ-RODRíGUEZ J E, DEL RAYOJARAMILLO-JACOB A, 2012. Predicting cetane number, kinematic viscosity, density and higher heating value of biodiesel from its fatty acid methyl ester composition [J]. Fuel, 91(1): 102-111.
RODOLFI L, ZITTELLI G C, BASSI N,, 2009. Microalgae for oil: strain selection, induction of lipid synthesis and outdoor mass cultivation in a low-cost photobioreactor [J]. Biotechnology and Bioengineering, 102(1): 100-112.
SHEN X F, LIU J J, CHAUHAN A S,, 2016. Combining nitrogen starvation with sufficient phosphorus supply for enhanced biodiesel productivity offed on acetate [J]. Algal Research, 17: 261-267.
SUASTES-RIVAS J K, HERNáNDEZ-ALTAMIRANO R, MENA-CERVANTES V Y,, 2020. Biodiesel production, through intensification and profitable distribution of fatty acid methyl esters by a microalgae-yeast co-culture, isolated from wastewater as a function of the nutrients' composition of the culture media [J]. Fuel, 280: 118633.
TALEBI A F, MOHTASHAMI S K, TABATABAEI M,, 2013. Fatty acids profiling: a selective criterion for screening microalgae strains for biodiesel production [J]. Algal Research, 2(3): 258-267.
TALEBI A F, TABATABAEI M, CHISTI Y, 2014. Biodiesel analyzer: a user-friendly software for predicting the properties of prospective biodiesel [J]. Biofuel Research Journal, 2: 55-57.
TAYLOR D C, KATAVIC V, ZOU J T,, 2002. Field testing of transgenic rapeseed cv. Hero transformed with a yeast-2 acyltransferase results in increased oil content, erucic acid content and seed yield [J]. Molecular Breeding, 8(4): 317-322.
WU H Q, MIAO X L, 2014. Biodiesel quality and biochemical changes of microalgaeandin response to nitrate levels [J]. Bioresource Technology, 170: 421-427.
YAAKOB M A, MOHAMED R M S R, AL-GHEETHI A,, 2021. Influence of nitrogen and phosphorus on microalgal growth, biomass, lipid, and fatty acid production: an overview [J]. Cells, 10(2): 393.
ZHANG J J, WAN L L, XIA S,, 2013. Morphological and spectrometric analyses of lipids accumulation in a novel oleaginous microalga,cf.(Eustigmatophyceae) [J]. Bioprocess and Biosystems Engineering, 36(8): 1125-1130.
ZHENG P Z, ALLEN W B, ROESLER K,, 2008. A phenylalanine in DGAT is a key determinant of oil content and composition in maize [J]. Nature Genetics, 40(3): 367-372.
ZHU S N, HUANG W, XU J,, 2014. Metabolic changes of starch and lipid triggered by nitrogen starvation in the microalga[J]. Bioresource Technology, 152: 292-298.
EVALUATION OF GROWTH AND LIPID ACCUMULATION POTENTIAL OFSP.
SHEN Hong-Xiao1, LI Tao2, 3, LI Ai-Fen1
(1. Institute of Hydrobiology, Jinan University, Guangzhou 510632, China; 2. Key Laboratory of Tropical Marine Bio-resources and Ecology, South China Sea Institute of Oceanology, Chinese Academy of Sciences, Guangdong Provincial Key Laboratory of Marine Medicine, Guangzhou 510301, China; 3. Southern Marine Science and Engineering Guangdong Laboratory (Guangzhou), Guangzhou 511458, China)
High-quality oleaginous microalgae are considered the foundation for large-scale production of microalgal lipid.sp. can accumulate storage triacylglycerols, but whether they have the potential for the feedstock of biodiesel is still lacking a systematic evaluation. A freshwater microalga, strainsp. was isolated from Nanhu Lake of Jinan University, Guangzhou, South China, and identified using morphological and molecular techniques. To evaluate the lipid production capacity of the microalgae, the biomass concentration, total lipid content, fatty acid composition, and photosynthetic efficiency were determined by culturing them under the four different sodium nitrate concentrations conditions (3.6, 9.0, 18.0, and 36.0 mmol/L). Finally, the quality parameters of biodiesel were predicted by using the theoretical mathematical model. The microalgal strain was identified assp. JNU-3201. During the culture period, carbohydrate content was lower than 20% (in dry weight). Protein content decreased and total lipid content gradually increased with the culture time, indicating that lipid were the major carbon storage forsp. JNU-3201. The major fatty acids included oleic acid (C18︰1), palmitic acid (C16︰0), and linoleic acid (C18︰2); the growth and lipid accumulation of the microalgae were significantly affected by nitrogen concentration. The highest total lipid content (46.92%±1.52%, in dry weight) was obtained at the lowest nitrogen concentration (3.6 mmol/L), the highest biomass concentration [(6.53±0.11) g/L] was obtained at the highest nitrogen concentration (36.0 mmol/L), and the highest total lipid yield [(2.43±0.06) g/L] was obtained at the middle nitrogen concentration (18.0 mmol/L). The percentage of monounsaturated fatty acids was increased significantly at low nitrogen concentrations. However, the content of photosynthetic pigments was decreased significantly, and the proportion of energy was lost in the form of heat and fluorescence was increased. The biodiesel parameters of cetane number, kinematic viscosity, density, iodine number, and oxidative stability all meet the Chinese biodiesel standard BD 100 (S10) and EU biodiesel standard EN 14214 standards. In conclusion,sp.JNU-3201 could be used as a potential feedstock for the production of microalgal biodiesel.
sp. JNU-3201; nitrogen concentration; total lipid; fatty acid; biodiesel quality parameters
X703
10.11693/hyhz20220500145
*熱帶亞熱帶水生態工程教育部工程研究中心開放基金, 2021B0402號;南方海洋科學與工程廣東省實驗室(廣州)人才團隊引進重大專項, GML2019ZD0406號。沈宏孝, 碩士研究生, E-mail: sshenhx@163.com
李愛芬, 博士生導師, 教授, E-mail: tiger@jnu.edu.cn; 李 濤, 副研究員, E-mail: taoli@scsio.ac.cn
2022-05-30,
2022-08-13

