鮰魚骨膠原多肽-鈣螯合物的制備及結構表征與穩定性研究
熊含露,張露,李金林,李小鋒,梅強根,馬天新,涂宗財,2*
1(國家淡水魚加工技術研發專業中心和江西省淡水魚高值化利用工程技術研究中心(江西師范大學),江西 南昌,330022)2(食品科學與技術國家重點實驗室(南昌大學),江西 南昌,330047)
鮰魚(Leiocassislongirostris)俗稱肥王魚、淮王魚等,是我國重要的淡水養殖水產品之一,2020年的產量為30.85萬t[1]。鮰魚肉嫩且味美,富含蛋白質和脂肪,被譽為淡水魚中的食用上品。鮰魚最美味之處在于軟邊的腹部,常被加工成凍魚片,但會產生約40%~55%的副產物,如魚骨、魚皮、魚鱗等[2]。其中,鮰魚骨含有豐富的蛋白質、不飽和脂肪酸、礦物質元素等營養成分,鈣磷比接近2∶1,易被人體吸收,是一種優良的補鈣食物資源[3]。但鮰魚骨質構堅硬,不便利用,目前主要被加工成動物飼料,造成資源浪費。
鈣是人體中必需的礦物質營養素,對維持人體正常的新陳代謝和酸堿平衡起著重要的作用。約99%的鈣以羥基磷灰石的形式存在于骨骼、牙齒中。缺鈣則易導致骨質疏松、佝僂病等疾病,且多發生在中老年和兒童群體中[4]。根據《中國居民膳食營養素參考攝入量(2013版)》顯示,中國成年居民每日的鈣推薦攝入量在800~1 000 mg,而人們實際每日攝入鈣量低于400 mg[5],因此,補鈣至關重要。目前,市場上常見的補鈣制劑有無機鈣、有機酸鈣、有機鈣等,但部分產品存在吸收率低、補鈣效果差等問題,無法滿足當代群體對補鈣的需求[6-7]。研究表明,肽-鈣螯合物具有溶解性好、易吸收、生物利用率高且無毒副作用等優點,逐漸成為人們一種理想選擇的補鈣劑[8]。如ZHANG等[9]研究證明,肽-鈣螯合物可提高腸道的鈣生物利用率,從而改善大鼠的骨質疏松問題。因此,基于低值鮰魚骨制備蛋白水解物,開發新型鈣制劑,不僅可以豐富鈣制劑的種類,還能提高魚骨資源利用率,降低環境污染,促進漁業產品的經濟效益。
本文以鮰魚骨為原料,以鈣結合能力為指標,采用單因素試驗優化制備膠原多肽的酶解工藝,采用Sephadex G-25進行分離純化,篩選出與鈣結合活性較好的膠原多肽組分。制備膠原多肽-鈣螯合物,通過傅里葉紅外光譜、掃描電鏡、能譜分析技術探究鮰魚骨膠原多肽螯合前后的形態結構變化,最后對膠原多肽-鈣螯合物的熱穩定性、酸堿穩定性、體外模擬消化穩定性進行評價,為其生物利用率提供理論依據。
1 材料與方法
1.1 材料與儀器
1.1.1 材料與試劑
冷凍鮰魚脊骨,由安徽富煌三珍公司提供。
S1063S鈣含量顯色檢測試劑盒,上海碧云天生物技術有限公司;堿性蛋白酶(200 000 U/g)、胃蛋白酶(250 U/mg)、胰蛋白酶(250 U/mg),北京索萊寶科技有限公司;細胞色素C(12 384 Da),阿拉丁試劑(上海)有限公司;抑肽酶(6 511.51 Da)、L-氧化型谷胱甘肽(612.63 Da)、羥脯氨酸(131.13 Da),上海源葉生物科技有限公司;CaCl2,西隴科學股份有限公司;三氟乙酸(trifluoroacetic acid,TFA)、乙腈(acetonitrile,ACN),賽默飛世爾科技有限公司。
1.1.2 儀器與設備
S—3400 N掃描電子顯微鏡,日本Hitachi公司;Spectrum One傅立葉變換紅外光譜儀,美國Perkin Elmer公司;EASY-nLC 1000型超高效液相,賽默飛世爾科技(中國)有限公司;Synergy H1酶標儀,美國Bio Tek公司;HH-6型數顯恒溫水浴鍋,國華電器有限公司;5430R型冷凍離心機,德國Eppendorf公司;FiveEasy Plus臺式pH計,梅特勒-托利多儀器(上海)有限公司;SR-AON-50型冷凍干燥機,上海舍巖儀器有限公司。
1.2 實驗方法
1.2.1 鮰魚骨的預處理
將冷凍鮰魚骨沸水蒸煮5 min,去除魚骨表面殘留的魚肉和膜性組織。按照1∶6(g∶mL)的料液比向魚骨中加入0.3 mol/L NaOH溶液脫脂,1 h后換液搖勻,靜置浸泡1 h后用蒸餾水反復沖洗魚骨至中性,瀝干水分,于60 ℃烘箱中烘干,粉碎備用。
1.2.2 鮰魚骨的酶解提取工藝
堿性蛋白酶由多種不同的蛋白酶組成,對膠原蛋白的水解程度較高,一定程度上有助于產生更多的生物活性肽和活性位點[10],因此本文采用堿性蛋白酶水解鮰魚骨粉制備鮰魚骨膠原多肽。以鈣結合能力為評價指標進行單因素試驗設計,通過固定其他因素,依次研究料液比(1∶20、1∶13、1∶10、1∶8、1∶6,g∶mL)、酶添加量(1%、2%、3%、4%、5%,質量分數)、pH(8.0、8.5、9、9.5、10)、酶解時間(1、2、3、4、5 h)、酶解溫度(30、40、50、60、70 ℃)對水解物鈣結合能力的影響。
1.2.3 鮰魚骨膠多肽的分子質量分布
采用高效體積排阻色譜法測定最優條件下酶解的鮰魚骨膠原多肽的分子質量分布[11-12]。2 mg/mL的鮰魚骨膠原多肽溶液過0.22 μm水系濾膜后進行上樣分析。測定條件:色譜柱,Waters XBridge Protein BEH 125? SEC(3.5 μm,7.8 mm×300 mm);流動相:V(ACN)∶V(0.1%TFA溶液)=40∶60;紫外檢測220 nm;流速0.4 mL/min;柱溫30 ℃;進樣量10 μL。以細胞色素C(12 384 Da)、抑肽酶(6 511.51 Da)、L-氧化型谷胱甘肽(612.63 Da)和羥脯氨酸(131.13 Da)為標準品繪制相對分子質量校正曲線,利用校正曲線方程計算酶解液的分子質量分布情況。
1.2.4 Sephadex G-25分離純化
參照李軍等[13]的方法略作修改。將溶脹好的Sephadex G-25填料裝入玻璃層析柱(1.6 cm×80 cm)中,超純水平衡2~3個柱體積,膠原多肽溶液過0.22 μm水系濾膜后上樣分析。洗脫條件:洗脫液為超純水,流速0.4 mL/min,檢測波長220 nm,每5 min收集1管。多次制備后合并相同組分,凍干。
1.2.5 膠原多肽鈣結合能力分析
稱取0.5 g鮰魚骨膠原多肽及其最優組分和0.25 g CaCl2溶于20 mL蒸餾水中,40 ℃水浴1 h。冷卻至室溫后用8倍體積的無水乙醇沉淀4 h,離心取沉淀凍干得到肽-鈣螯合物。最后采用鈣含量顯色檢測試劑盒測定鮰魚骨膠原多肽-鈣螯合物的鈣含量,鈣含量可直接反應膠原多肽的鈣結合能力[14]。
1.2.6 鮰魚骨膠原多肽-鈣螯合物的結構表征
1.2.6.1 傅里葉紅外光譜測定
將1.2.5小節中確定的鈣螯合能力最強肽組分及其鈣螯合物與干燥的KBr于瑪瑙研缽中混合,充分研磨后壓片,采用傅里葉變換紅外光譜儀在500~4 000 cm-1掃描[15]。
1.2.6.2 掃描電鏡及能譜分析
參照張玲[16]的方法將1.2.5小節中確定的鈣螯合能力最強肽組分及其鈣螯合物分別固定在導電膠帶上,噴金鍍膜,放入掃描電鏡施加電壓獲取微觀結構圖像,并對其進行能譜分析。
1.2.7 鮰魚骨膠原多肽-鈣螯合物的穩定性評價
1.2.7.1 熱穩定性分析
配制5 mg/mL的鮰魚骨膠原多肽-鈣螯合物溶液,分別放置于25(控制組)、50、60、70、80 ℃條件下恒溫水浴1 h,冷卻至室溫后用無水乙醇沉淀,離心凍干,測定其鈣結合能力。以控制組的鈣保留率為100%,計算不同溫度下鮰魚骨膠原多肽-鈣螯合物的鈣保留率。
1.2.7.2 酸堿穩定性分析
配制5 mg/mL的鮰魚骨膠原多肽-鈣螯合物溶液,以原液為控制組,其余組分別調pH為2、4、6、8、9,37 ℃水浴2 h,冷卻至室溫后用無水乙醇沉淀,離心凍干,評價樣品的鈣結合能力。以控制組的鈣保留率為100%,計算不同pH條件下鮰魚骨膠原多肽-鈣螯合物的鈣保留率。
1.2.7.3 體外模擬消化穩定性
用0.01 mol/L HCl溶液(pH 2.0)配制質量濃度為5 mg/mL的鮰魚骨膠原多肽-鈣螯合物,按照1∶50的酶底物質量比添加胃蛋白酶模擬胃消化環境,37 ℃水浴酶解1 h后,用1 mol/L NaOH溶液調節pH至7.5,再按照1∶25的酶底物質量比加入胰蛋白酶模擬腸消化環境,37 ℃水浴酶解2 h后,沸水浴加熱滅酶10 min終止酶解。最后冷卻至室溫,并用無水乙醇沉淀,離心凍干,測定其鈣結合能力。以未消化的鮰魚骨膠原多肽-鈣螯合物(控制組)的鈣保留率為100%,計算模擬消化過程中鮰魚骨膠原多肽-鈣螯合物的鈣保留率。
1.3 數據處理
所有試驗重復3次,實驗結果以平均值±標準偏差表示,采用Origin 8.6軟件作圖,用SPSS 22.0軟件中的單因素方差分析(ANOVA)評價數據間的顯著性差異,P<0.05認定具有顯著性差異。
2 結果與分析
2.1 鮰魚骨膠原蛋白多肽酶解單因素試驗
堿性蛋白酶酶解鮰魚骨制備膠原多肽的單因素試驗結果如圖1所示。由圖1-a中可知,鈣結合能力隨料液比的增加整體呈先上升后下降的趨勢,這是因為底物濃度會影響酶解液的分子擴散性,其底物濃度太低,酶與底物不易接近,在料液比為1∶13(g∶mL)時,鈣結合能力最高,達到22.95 mmol/L(P<0.05)。由圖1-b可知,堿性蛋白酶的添加量在1%~4%,鈣結合能力基本呈上升的趨勢,最大值達到28.47 mmol/L(P<0.05)。繼續增加酶添加量時,鈣結合能力反而下降。這是因為堿性蛋白酶的酶添加量增加,其水解能力增強,當繼續增加酶量,此時的鈣結合能力幾乎沒有發生改變,說明酶與底物達到飽和,因此確定最佳酶添加量為4%。由圖1-c可知,鈣結合能力隨著pH的增加整體上呈下降的趨勢,當pH為8.0時,鈣結合能力最高達到27.68 mmol/L(P<0.05),這是因為當pH較低時,H+與Ca2+競爭供電基團,并促進肽-鈣螯合物中Ca2+的解離,而pH過高時,溶液中的OH-會與Ca2+形成Ca(OH)2沉淀物,導致肽鈣結合能力下降[17-18]。同時,當酶解pH值為8.0時,正好為堿性蛋白酶的最適pH,此時的酶解活性最高[13]。
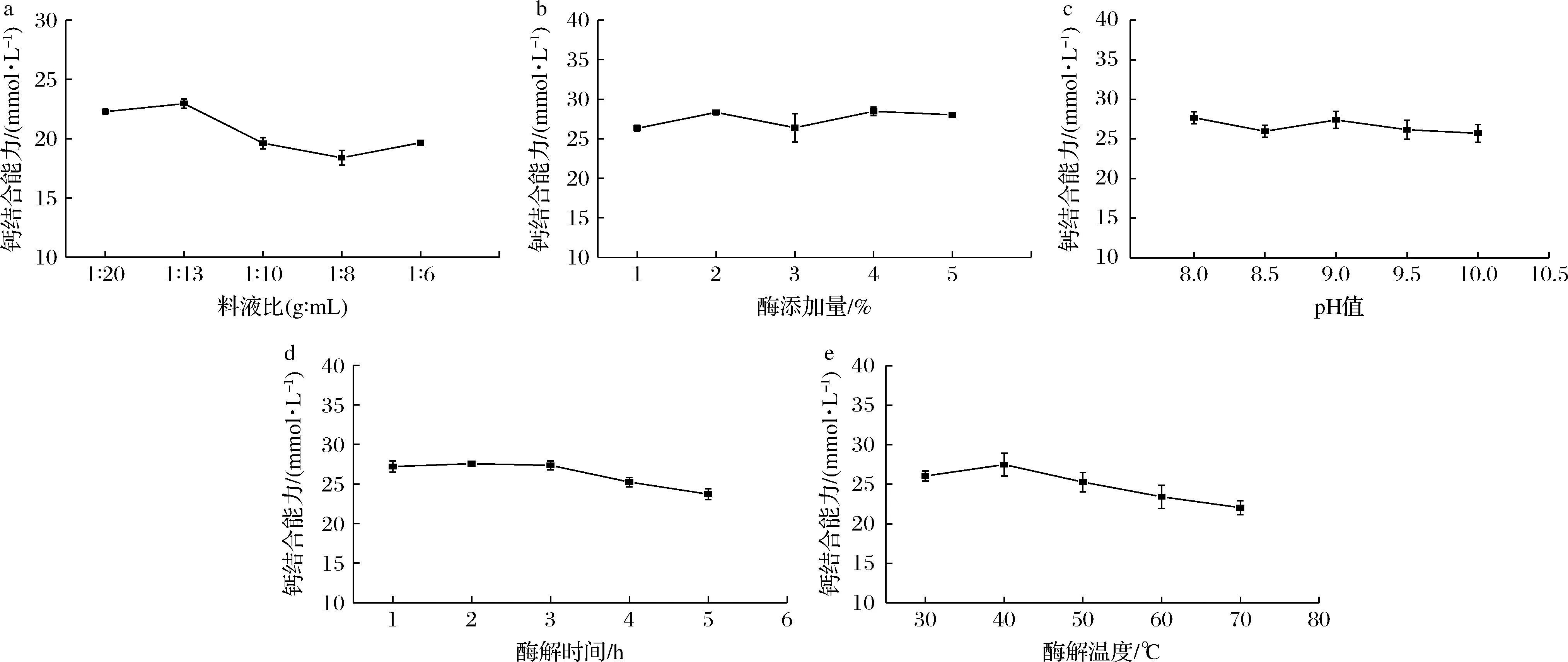
a-料液比;b-酶添加量;c-pH值;d-酶解時間;e-酶解溫度圖1 酶解條件對鈣結合能力的影響Fig.1 Effects of enzymatic hydrolysis conditions on calcium binding capacity
由圖1-d可知,隨著酶解時間的延長,鈣結合能力呈現先上升后下降的趨勢,當酶解時間為2 h時,鈣結合活性達到最大值27.56 mmol/L(P<0.05)。這是因為當酶解反應開始時,堿性蛋白酶與魚骨底物激烈反應,膠原多肽含量增加,其鈣結合能力也隨之增加,但隨著酶解時間的延長,膠原多肽也會被過度水解成氨基酸,使與鈣結合的膠原多肽含量降低。由圖1-e可知,鈣結合能力隨著酶解溫度增加呈先上升后下降的趨勢,在酶解溫度為40 ℃時,其鈣結合能力達到最大值27.48 mmol/L(P<0.05)。其原因在于隨著溫度的逐漸增加,堿性蛋白酶活性增強,但過高的溫度會導致堿性蛋白酶酶活力下降甚至失活,影響膠原多肽與鈣的結合能力。綜上所述,由單因素試驗可確定堿性蛋白酶制備鮰魚膠原多肽的最佳酶解工藝:料液比1∶13(g∶mL),酶添加量4%,pH 8.0,酶解時間2 h,酶解溫度40 ℃,此時制備的鮰魚膠原多肽與鈣結合能力為29.37 mmol/L。
2.2 鮰魚骨膠原蛋白肽的分子質量分布分析
鮰魚骨膠原多肽分子質量分布情況如圖2-a所示,混合標準品分離效果良好。依據標準品與保留時間的關系,以相對分子質量的對數(lgMw)對保留時間(t)作線性回歸得到相對分子質量校正曲線,如圖2-b所示,其相對分子質量校正曲線方程:lg(Mw)=-0.188 1t+6.642 1,R2=0.996 6,表明相對分子質量的對數與保留時間(t)具有良好的線性關系,可根據相對分子質量校正曲線方程和鮰魚骨膠原多肽的出峰時間,計算出鮰魚骨膠原多肽粉末各組分的分子質量分布情況。
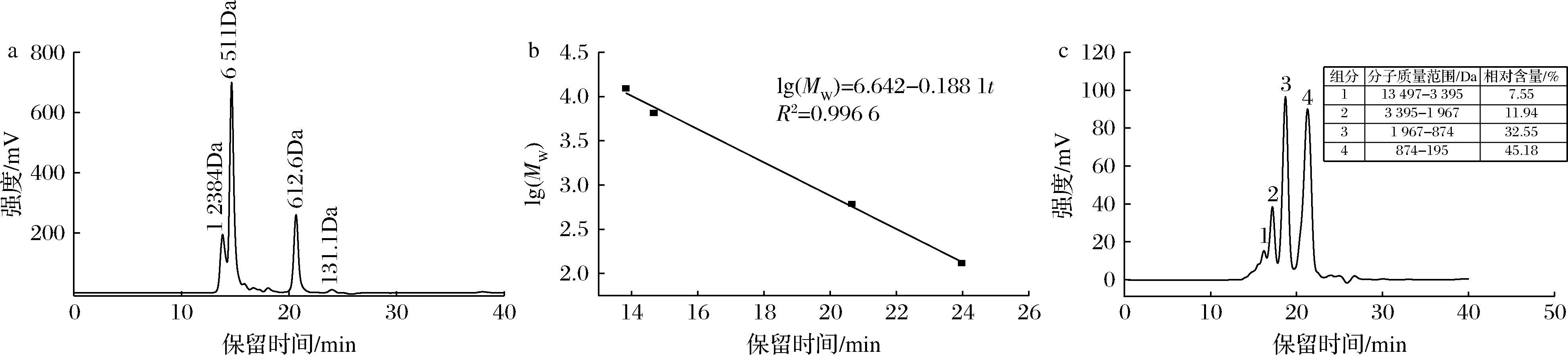
a-標準品的體積排阻色譜圖;b-相對分子質量校正曲線;c-鮰魚骨膠原多肽分子質量范圍圖2 標準品的體積排阻色譜圖、相對分子質量校正曲線和鮰魚骨膠原多肽分子質量分布Fig.2 Size exclusion chromatogram, relative molecular mass calibration curve and molecular mass distribution of catfish bone collagen polypeptide注:相對含量的數據來源于高效液相色譜分析結果
鮰魚骨膠原多肽的高效體積排阻色譜圖如圖2-c所示,圖中主要出現4個峰,表明鮰魚骨膠原多肽由4種不同分子質量膠原多肽所組成。通過相對分子質量校正曲線方程和鮰魚骨膠原多肽的出峰時間計算,分子質量分布如2-c所示,鮰魚骨膠原多肽的分布范圍廣,大小不一,且分子質量范圍為195~1 967 Da的膠原多肽相對含量最高,約占鮰魚骨膠原多肽整體的77.73%。因此,采用Sephadex G-25分子層析將其進行分離純化,并分析各個組分對鈣結合活性的影響。
2.3 鮰魚骨膠原多肽Sephadex G-25分離純化分析
凝膠過濾層析可根據樣品的分子質量大小對樣品進行分離,分子質量大的樣品不能進入凝膠顆粒,先被洗脫下來,分子質量小的樣品后被洗脫出來[19]。鮰魚骨膠原多肽經Sephadex G-25分離純化的圖譜如圖3-a所示,鮰魚骨膠原多肽按照分子質量大小被分離成3個不同組分,依次命名為F1、F2、F3。3個組分的鈣結合能力如圖3-b所示,F1、F2、F3組分與鈣的結合能力分別為1.78、5.43、6.69 mmol/L,其中F3組分顯示出最高的鈣結合能力,這與低分子質量的多肽更容易與金屬離子結合相符合[20]。
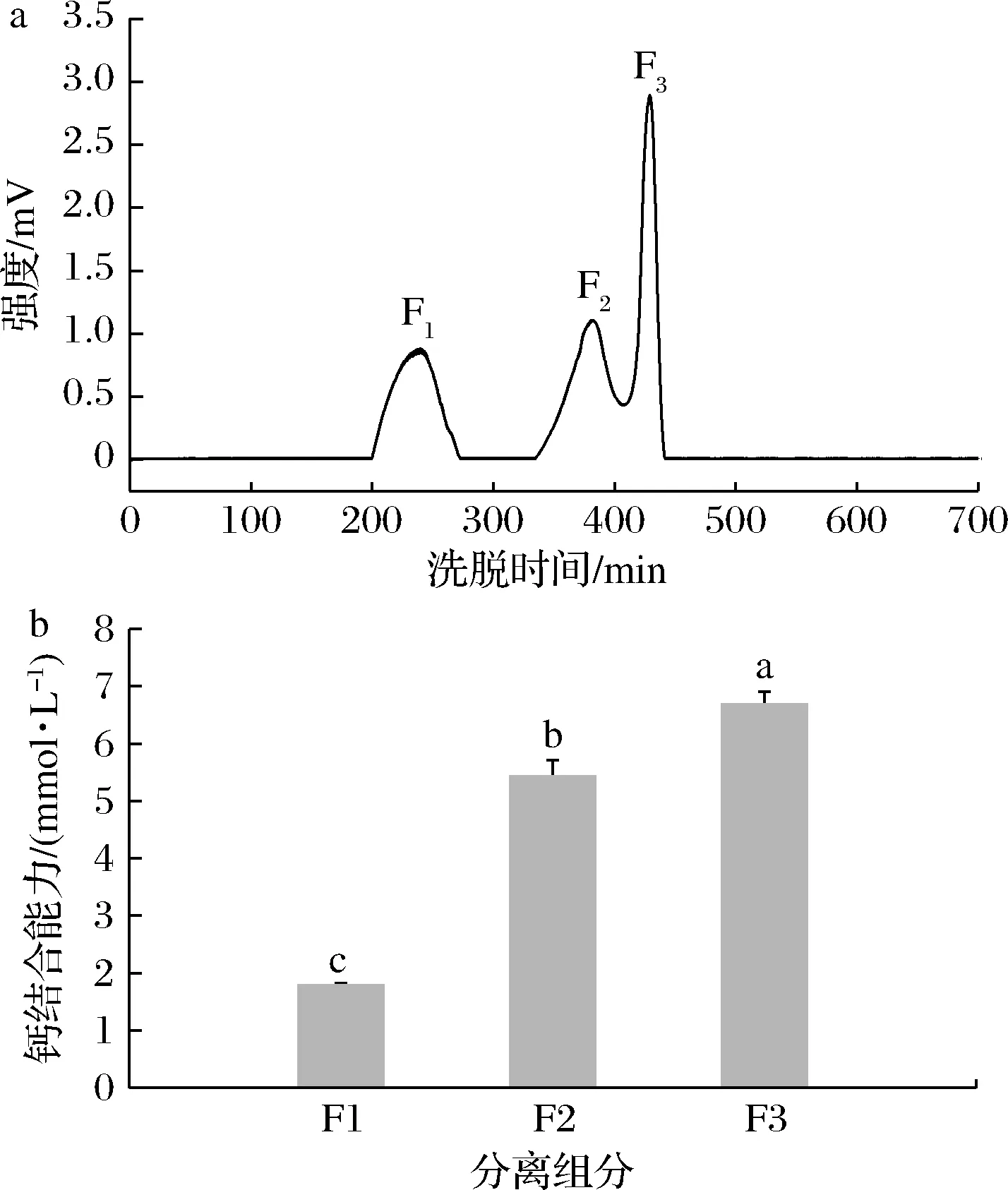
a-Sephadex G-25凝膠過濾層析色譜圖;b-肽-鈣結合能力圖3 鮰魚骨膠原多肽的Sephadex G-25凝膠過濾層析色譜圖和各個組分的鈣結合能力Fig.3 Sephadex G-25 gel filtration chromatography of catfish bone collagen polypeptide-calcium chelate and calcium binding capacity of different components注:不同小寫字母表示顯著性差異(P<0.05)(下同)
2.4 鮰魚骨膠原多肽-鈣螯合物結構表征分析
2.4.1 傅里葉紅外光譜

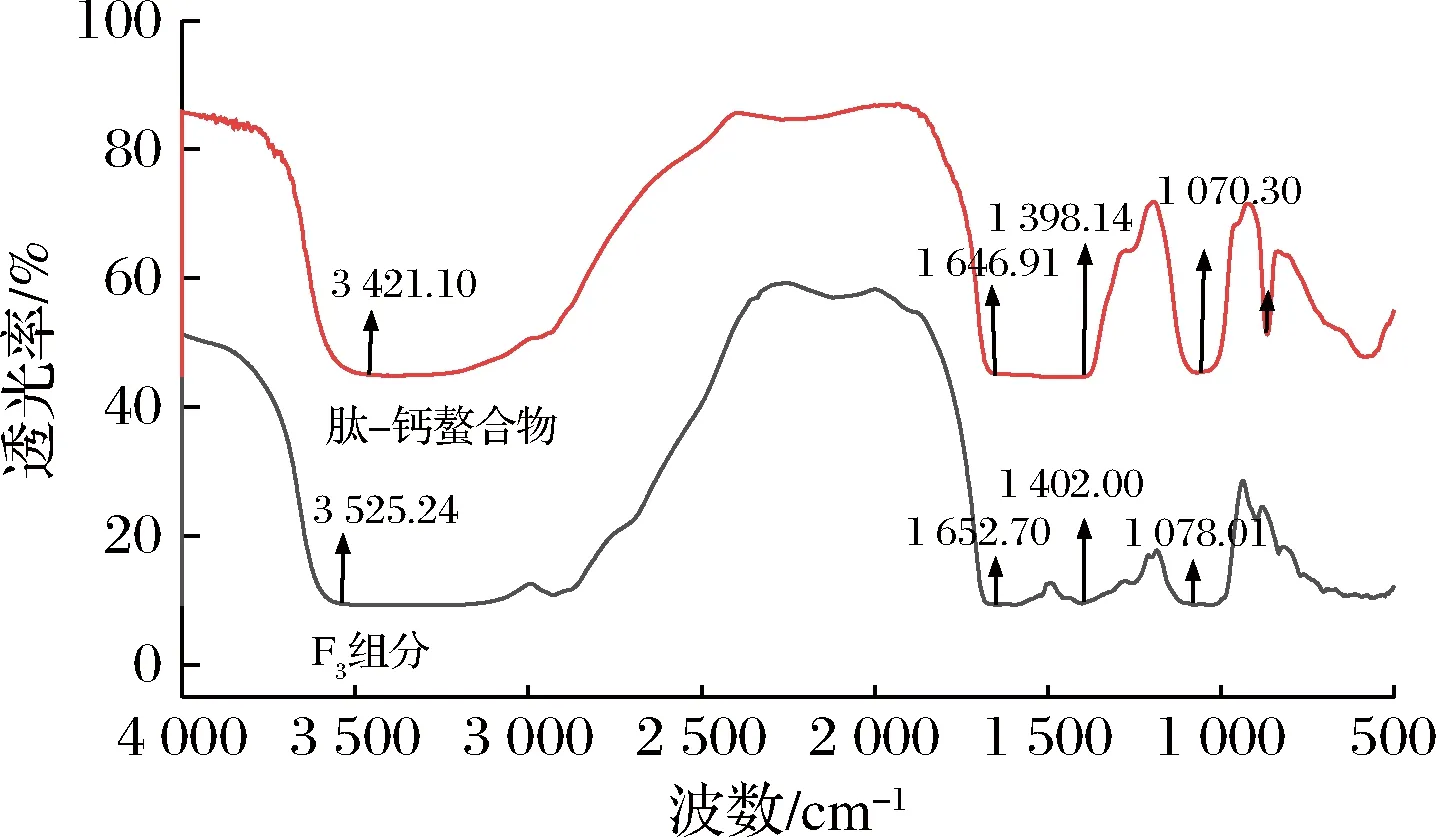
圖4 F3和肽-鈣螯合物的紅外光譜圖Fig.4 Infrared spectra of F3 and peptide-calcium chelate
2.4.2 掃描電鏡及能譜分析
F3組分及其肽-鈣螯合物的掃描電鏡如圖5-a和圖5-b所示,F3組分表面呈現光滑的平面,其表面還存在由于快速冷凍干燥而形成的裂紋。與Ca2+螯合后,其表面變為粗糙、疏松、多孔的形狀,且多個球狀連接一起,這是由于膠原多肽和Ca2+發生配位結合,Ca2+的嵌入和膠原多肽對Ca2+的截留共同作用的結果。為了更詳細了解F3組分及其肽-鈣螯合物中內部元素分布情況,采用能譜進行分析,結果如圖5-c和圖5-d所示。F3組分及其肽-鈣螯合物都能檢測到鈣元素,同時還共同含有N、C、O、Na、Cl等元素。但肽-鈣螯合物中鈣元素的信號強度要明顯強于F3組分,說明肽-鈣螯合物中的鈣含量要明顯高于F3組分。通過掃描電鏡和能圖分析可知,F3組分與Ca2+發生了螯合作用,形成了新的物質。
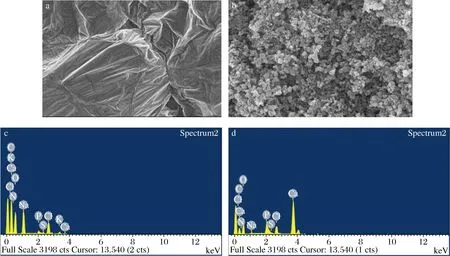
a-F3掃描電鏡圖;b-肽-鈣螯合物掃描電鏡圖;c-F3能譜圖;d-肽-鈣螯合物能譜圖圖5 F3及肽-鈣螯合物的掃描電鏡及能譜分析Fig.5 Scanning electron microscopy and energy spectrum analysis of F3 and its peptide-calcium chelate
2.5 鮰魚骨膠原多肽鈣螯合物穩定性評價
2.5.1 熱穩定性
熱處理是食品加工的常用手段,因此本研究以鈣保留率為評價指標,考察了不同熱處理溫度對鮰魚骨膠原多肽-鈣螯合物穩定性的影響。如圖6-a所示,隨著熱處理溫度的升高(50~80 ℃),鮰魚骨膠原多肽-鈣螯合物的鈣保留率先保持穩定,后緩慢降低,但鈣保留率仍在95.91%以上,且無顯著性差異(P>0.05),說明鮰魚骨膠原多肽-鈣螯合物具有一定的熱穩定性。這可能是因為Ca2+與鮰魚骨膠原多肽通過配位鍵相互作用將形成有序、緊密的結構,使其空間結構更加穩定[23]。

a-溫度與鈣保留率關系;b-pH與鈣保留率關系;c-消化穩定性圖6 鮰魚骨膠原多肽-鈣螯合物溫度、pH和消化穩定性關系分析Fig.6 Calcium retention rate of catfish bone collagen polypeptide-calcium chelate at different temperatures, different acid-base environment, different digestion methods
2.5.2 酸堿穩定性
鮰魚骨膠原多肽-鈣螯合物的酸堿穩定性如圖6-b所示,隨著pH值(2.0~9.0)的增加,鮰魚骨膠原多肽-鈣螯合物的鈣保留率呈現出先增加后下降的趨勢,但鈣保留率均在77.52%以上。與控制組相比,鮰魚骨膠原多肽-鈣螯合物在強酸性環境下的鈣保留率下降較快,這是由于高H+濃度可與Ca2+競爭活性基團,導致鮰魚骨膠原多肽-鈣螯合物的鈣結合能力下降[18]。而在堿性環境下,鮰魚骨膠原多肽-鈣螯合物的鈣保留率略有下降,這是因為堿性環境下的OH-與Ca2+結合發生少量的沉淀所致,但有研究表明金屬肽鈣復合物一旦形成穩定結構,其解離需要克服較大的活化能[24],所以在弱堿性條件下(pH 8.0)的鈣保留率下降趨勢不明顯。
2.5.3 體外消化穩定性
膳食營養素的吸收利用需要經過胃腸道的消化吸收,其吸收利用率會受到pH及各種消化酶的影響。因此,需要評價鮰魚骨膠原多肽-鈣螯合物在胃腸道模擬消化過程中的穩定性,其結果如圖6-c所示。經過胃蛋白酶消化后,鮰魚骨膠原多肽-鈣螯合物的鈣保留率下降到82.25%,這是因為模擬胃消化環境的pH為2.0,其高濃度的H+與Ca2+發生競爭,與圖6-b的強酸環境下導致鈣保留率下降的結果相一致。加入胰蛋白酶再次消化后,鮰魚骨膠原多肽-鈣螯合物的鈣保留率再次下降,其值為73.84%,這可能是胃消化階段的強酸環境和胰蛋白酶可能對鮰魚骨膠原多肽存在一定的降解作用,導致其鈣螯合能力降低[25]。但總體來說,其鈣保留率均在70%以上,表明鮰魚骨膠原多肽-鈣螯合物對胃蛋白酶、胰蛋白酶消化和胃腸道pH環境不敏感,能較好地保持結構不被破壞,促進人體對鈣的吸收。
3 結論
本文以鮰魚骨為原料,經堿性蛋白酶水解后與CaCl2螯合制備鮰魚骨膠原多肽-鈣螯合物。采用鈣結合能力為評價指標,通過單因素試驗得到鮰魚骨膠原多肽的最佳酶解工藝為:料液比1∶13(g∶mL),酶添加量4%,pH 8.0,酶解時間2 h,酶解溫度40 ℃,此時制備的鮰魚骨膠原多肽與鈣結合能力達到29.37 mmol/L。HPLC分析發現,鮰魚骨膠原多肽的分子質量主要集中在195~1 967 Da,其相對含量約占鮰魚骨膠原多肽整體的77.73%。利用Sephadex G-25分離純化得到3個組分,其中F3組分的鈣結合活性最佳。紅外光譜、掃描電鏡和能譜結果顯示,鮰魚骨膠原多肽的氨基、羧基和酰胺鍵是Ca2+的結合位點,與Ca2+螯合之后,其光滑的平面變為粗糙、疏松、多孔的形狀,鈣含量明顯增加,都表明有新物質的產生。熱穩定性和酸堿穩定性分析表明,鮰魚骨膠原多肽-鈣螯合物具有一定的耐熱性、耐弱堿性,但在強酸環境下不穩定。消化穩定性分析發現,鮰魚骨膠原多肽-鈣螯合物可在胃腸道的環境中保持穩定,其鈣保留率在70%以上,具有促進人體鈣吸收的潛力。

