捻轉(zhuǎn)血矛線蟲PCR檢測方法的建立及其應(yīng)用
鄒 敏,要慧中,楊冰可,周璐露,趙光明,楊文歡,吳 昌,林 青,4
(1. 西北農(nóng)林科技大學(xué) 動物醫(yī)學(xué)院,陜西楊凌 712100;2. 陜西省動物疫病預(yù)防控制中心,西安 710299;3. 商南縣農(nóng)業(yè)綜合執(zhí)法大隊,陜西商南 726300;4. 家畜疫病病原生物學(xué)國家重點實驗室,中國農(nóng)業(yè)科學(xué)院 蘭州獸醫(yī)研究所,蘭州 730046)
捻轉(zhuǎn)血矛線蟲(Haemonchuscontortus)是一種世界范圍內(nèi)的反芻動物胃腸道高致病性吸血線蟲,特別是在熱帶、亞熱帶和溫帶等溫暖潮濕的地區(qū),其危害程度更為嚴重[1-2]。主要寄生于山羊、綿羊等家養(yǎng)和野生反芻動物的皺胃和小腸[3],可導(dǎo)致宿主出現(xiàn)消瘦、貧血、下顎水腫、生理機能紊亂等慢性消耗性癥狀,甚至引起幼年動物急性死亡[4-7],給世界范圍內(nèi)的山羊、綿羊等反芻動物養(yǎng)殖業(yè)帶來重大的經(jīng)濟損失[2,7]。捻轉(zhuǎn)血矛線蟲病除了通過特征性的臨床病變以及尸檢時在胃腸道中發(fā)現(xiàn)大量的捻轉(zhuǎn)血矛線蟲蟲體來確診外[1],還可通過從糞便中檢測出的捻轉(zhuǎn)血矛線蟲蟲卵來確診。傳統(tǒng)的糞檢方法主要是顯微鏡檢查,臨床上通常是應(yīng)用麥克馬斯特氏法(McMaster’s method)來計算每克糞便中的蟲卵數(shù)(EPG),對線蟲感染進行定性和定量測定[8]。傳統(tǒng)鏡檢方法通過形態(tài)準確鑒定線蟲卵的種類有一定難度,往往判定結(jié)果存在一定的主觀性,且在實際檢測時也常有漏診情況出現(xiàn)。
在過去的幾十年里,為了提高腸道蠕蟲病診斷的敏感性和特異性,分子診斷方法得到不斷發(fā)展和完善。目前,隨著線蟲基因組學(xué)研究的不斷深入,加之蛋白質(zhì)組學(xué)和代謝組學(xué)的技術(shù)不斷發(fā)展[9],使得特異性生物標記物用來進行物種鑒別成為可能[10]。近年來,由于PCR技術(shù)快速、高效、便捷和特異性強等特點,同時又可以彌補傳統(tǒng)方法的一些缺陷,因此,基于PCR的一系列病原檢測技術(shù)已經(jīng)在動物胃腸道線蟲的研究中得到廣泛應(yīng)用[8,11-12]。本研究將基于捻轉(zhuǎn)血矛線蟲ITS2-28S基因序列,建立針對捻轉(zhuǎn)血矛線蟲卵的一種快速PCR分子檢測技術(shù),為羊捻轉(zhuǎn)血矛線蟲病的診斷與防治提供有效方法,并為該病的監(jiān)測預(yù)報提供技術(shù)支持。
1 材料與方法
1.1 材 料
1.1.1 蟲卵樣品 將采集于羊皺胃的捻轉(zhuǎn)血矛線蟲雌蟲在室溫下培養(yǎng)8~12 h以獲得成熟的蟲卵,同時將雌蟲蟲體置于體視顯微鏡下解剖其子宮,將子宮內(nèi)尚未成熟的蟲卵擠出。所收集的蟲卵保存于生理鹽水內(nèi)。細頸線蟲、粗紋食道口線蟲、似血矛線蟲、夏伯特線蟲、蘭氏毛尾線蟲、綿羊毛尾線蟲、尖尾線蟲、網(wǎng)尾線蟲、蛇形毛圓線蟲等蟲卵的DNA陽性樣品由西北農(nóng)林科技大學(xué)寄生蟲實驗室提取并保存。
1.1.2 糞便樣品 120只奶山羊新鮮糞便樣品分別采自陜西省藍田縣(85只)、千陽縣(20只)、富平縣(15只)3 個某規(guī)模化奶山羊場。
1.1.3 主要試劑 普通瓊脂糖凝膠DNA回收試劑盒(DP209)和高純度質(zhì)粒小提中量試劑盒(DP107)均購自天根生化科技(北京)有限公司;OMEGA糞便基因組DNA提取試劑盒(D4015)、大腸埃希桿菌JM109感受態(tài)細胞(G6014-20)、氨芐青霉素貯存液(A1170)、LB固體培養(yǎng)基干粉(L1015)、LB液體培養(yǎng)基干粉(L1010)等均購自北京索萊寶生物科技有限公司;TaKaRa ExTaq○R(RR001A)、T-vector pMD 19(Simple)載體(3271)、DNA標準DL 2000(3427A)均購自寶日醫(yī)生物技術(shù)(北京)有限公司。
1.2 方 法
1.2.1 捻轉(zhuǎn)血矛線蟲卵DNA的提取 按照 OMEGA糞便基因組DNA提取試劑盒說明書提取蟲卵的基因組DNA,并置于-20 ℃保存,備用。
1.2.2 捻轉(zhuǎn)血矛線蟲PCR檢測方法的建立引物設(shè)計 參考GenBank中的捻轉(zhuǎn)血矛線蟲序列(登錄號為KX829170.1),基于捻轉(zhuǎn)血矛線蟲ITS2-28S基因序列片段,利用ClustalX 1.83生物軟件篩選出捻轉(zhuǎn)血矛線蟲種內(nèi)保守且種間高變的堿基序列,利用NCBI內(nèi)的Primer-blast和oligo 7生物學(xué)軟件,設(shè)計捻轉(zhuǎn)血矛線蟲的上、下游特異性引物,引物相關(guān)的具體信息如表1所示。
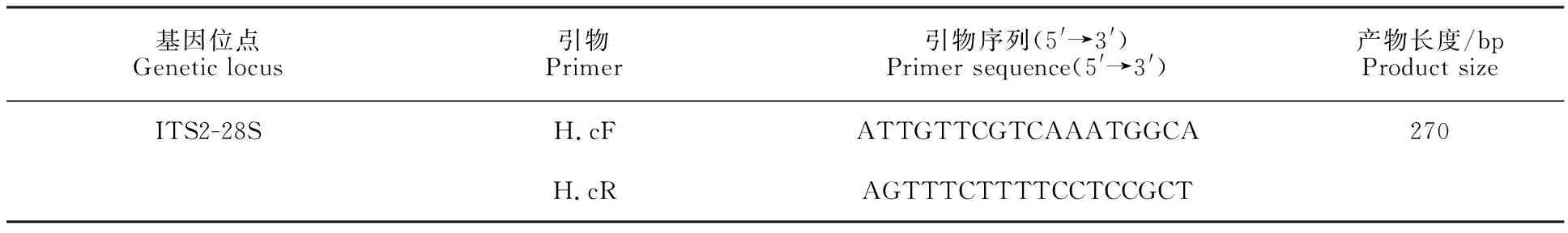
表1 捻轉(zhuǎn)血矛線蟲PCR引物Table 1 PCR primers for H.contortus
捻轉(zhuǎn)血矛線蟲PCR反應(yīng)體系的建立和條件優(yōu)化 PCR反應(yīng)總體系設(shè)定為25 μL:10× ExTaqBuffer 2.5 μL,dNTP Mixture 2 μL,上下游引物(10 μmol/L)各1 μL,ExTaqDNA聚合酶 0.125 μL,模板DNA 1 μL,ddH2O 17.375 μL。反應(yīng)條件為:94 ℃ 5 min;94 ℃ 30 s,53 ℃ 30 s,72 ℃ 30 s,35個循環(huán);72 ℃ 5 min。
退火溫度優(yōu)化:根據(jù)Oligo 7推薦的最佳退火溫度54.6 ℃,將溫度梯度設(shè)置為60 ℃、59 ℃、58 ℃、57 ℃、56 ℃、55 ℃、54 ℃、53 ℃、52 ℃、 51 ℃、50 ℃。
特異性試驗 利用建立的PCR方法對細頸線蟲、似血矛線蟲、夏伯特線蟲、蘭氏毛尾線蟲、綿羊毛尾線蟲、尖尾線蟲、網(wǎng)尾線蟲、蛇形毛圓線蟲、粗紋食道口線蟲等蟲卵的DNA進行擴增,設(shè)置捻轉(zhuǎn)血矛線蟲卵DNA為陽性對照,ddH2O為陰性對照。擴增后將PCR產(chǎn)物經(jīng)10 g/L瓊脂糖凝膠電泳,觀察結(jié)果,為進一步確定擴增結(jié)果的準確性,將陽性PCR原液送測序驗證。
敏感性試驗 陽性標準品的制備:使用普通瓊脂糖凝膠DNA回收試劑盒(DP209),對捻轉(zhuǎn)血矛線蟲卵PCR擴增產(chǎn)物進行純化與回收。將膠回收產(chǎn)物利用T-Vector pMD 19載體系統(tǒng)連接到pMD-19T SimpleⅠ載體上。將連接產(chǎn)物轉(zhuǎn)化到感受態(tài)細胞,在LB固體培養(yǎng)基上過夜培養(yǎng)14~16 h后,觀察菌落。挑取培養(yǎng)基上的單個菌落于含有1.5 μL氨芐青霉素和1 mL LB液體培養(yǎng)基的離心管內(nèi),放置在37 ℃搖床中,于220 r/min培養(yǎng)12 h。
利用建立的PCR方法及電泳檢測對菌落進行鑒定后,將菌液PCR擴增產(chǎn)物送測序。對經(jīng)測序結(jié)果正確的陽性質(zhì)粒參考高純度質(zhì)粒小提中量試劑盒(DP107)說明書進行DNA提取。經(jīng)分光光度計測定核酸濃度后,按5倍比稀釋為9個濃度梯度分別作為模板,使用建立的PCR反應(yīng)體系和反應(yīng)程序進行擴增,每個梯度重復(fù)3次,以確保試驗的可重復(fù)性。
1.3 臨床樣品檢測
1.3.1 光學(xué)顯微鏡檢查 采用飽和食鹽水漂浮法進行糞便中蟲卵的形態(tài)學(xué)檢查,于400倍的光學(xué)顯微鏡下觀察蟲卵的大小、顏色、卵殼厚度、形狀及卵內(nèi)容物等形態(tài)特征,對捻轉(zhuǎn)血矛線蟲卵進行鑒定并記錄結(jié)果。
1.3.2 糞便樣品PCR檢測 按照OMEGA糞便基因組DNA提取試劑盒說明書提取糞便樣品DNA并進行PCR擴增,對擴增產(chǎn)物進行凝膠電泳檢測,之后將所有陽性PCR產(chǎn)物送測,以確定目的基因片段的準確性。
1.3.3 兩種檢測方法結(jié)果比較 使用SPSS 24.0軟件對兩種檢測方法的結(jié)果進行一致性檢驗(Kappa vaule)和配對卡方檢驗(McNemar Test),分析計算結(jié)果。當Kappa值≥0.75,二者檢測結(jié)果一致性較好;當0.4≤Kappa值<0.75,二者檢測結(jié)果一致性一般;當Kappa值<0.4,二者檢測結(jié)果一致性較差。P<0.05為差異具有統(tǒng)計學(xué)意義。
2 結(jié)果與分析
2.1 PCR反應(yīng)退火溫度優(yōu)化
通過對PCR反應(yīng)條件中的退火溫度進行優(yōu)化,結(jié)果顯示,以53 ℃為退火溫度時,電泳檢測出的目的條帶最亮且無雜帶出現(xiàn)(圖1),即53 ℃為該PCR反應(yīng)的最佳退火溫度。
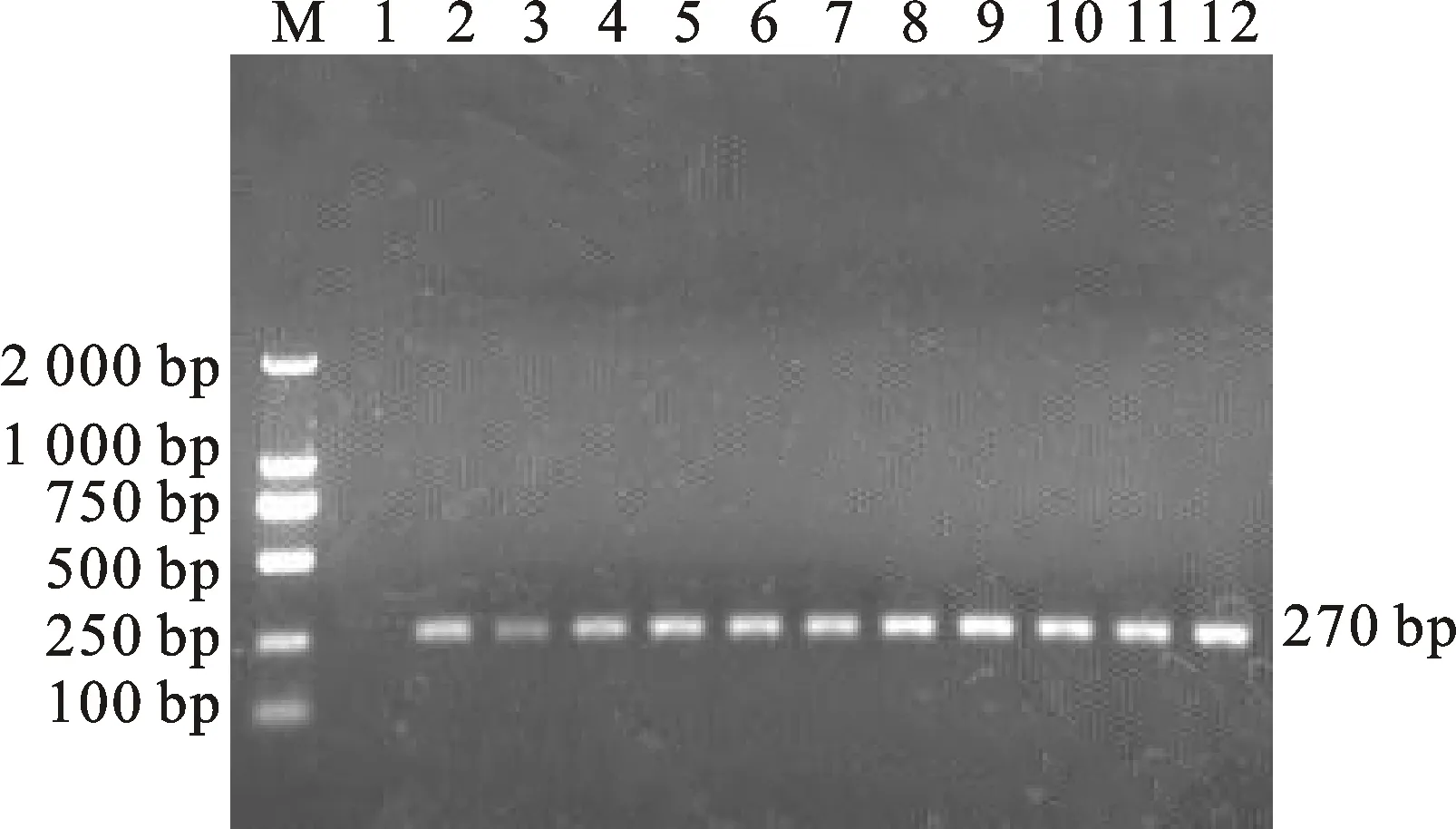
M.DNA 標準 DL 2000;1. 空白對照;2~12. 退火溫度分別為60 ℃、59 ℃、58 ℃、57 ℃、56 ℃、55 ℃、54 ℃、53 ℃、52 ℃、 51 ℃、50 ℃
2.2 PCR特異性試驗
電泳檢測結(jié)果顯示,僅以捻轉(zhuǎn)血矛線蟲卵DNA為模板的樣品出現(xiàn)一條270 bp的特異性條帶,其余線蟲卵DNA樣品電泳結(jié)果均為陰性(圖2)。將測序結(jié)果在NCBI上進行Blast比對,結(jié)果顯示,測序結(jié)果與GenBank中捻轉(zhuǎn)血矛線蟲基因參考序列(登錄號為KF176320.1)的相似度達到100%,與GenBank中多個捻轉(zhuǎn)血矛線蟲基因參考序列同源性均達99%以上。
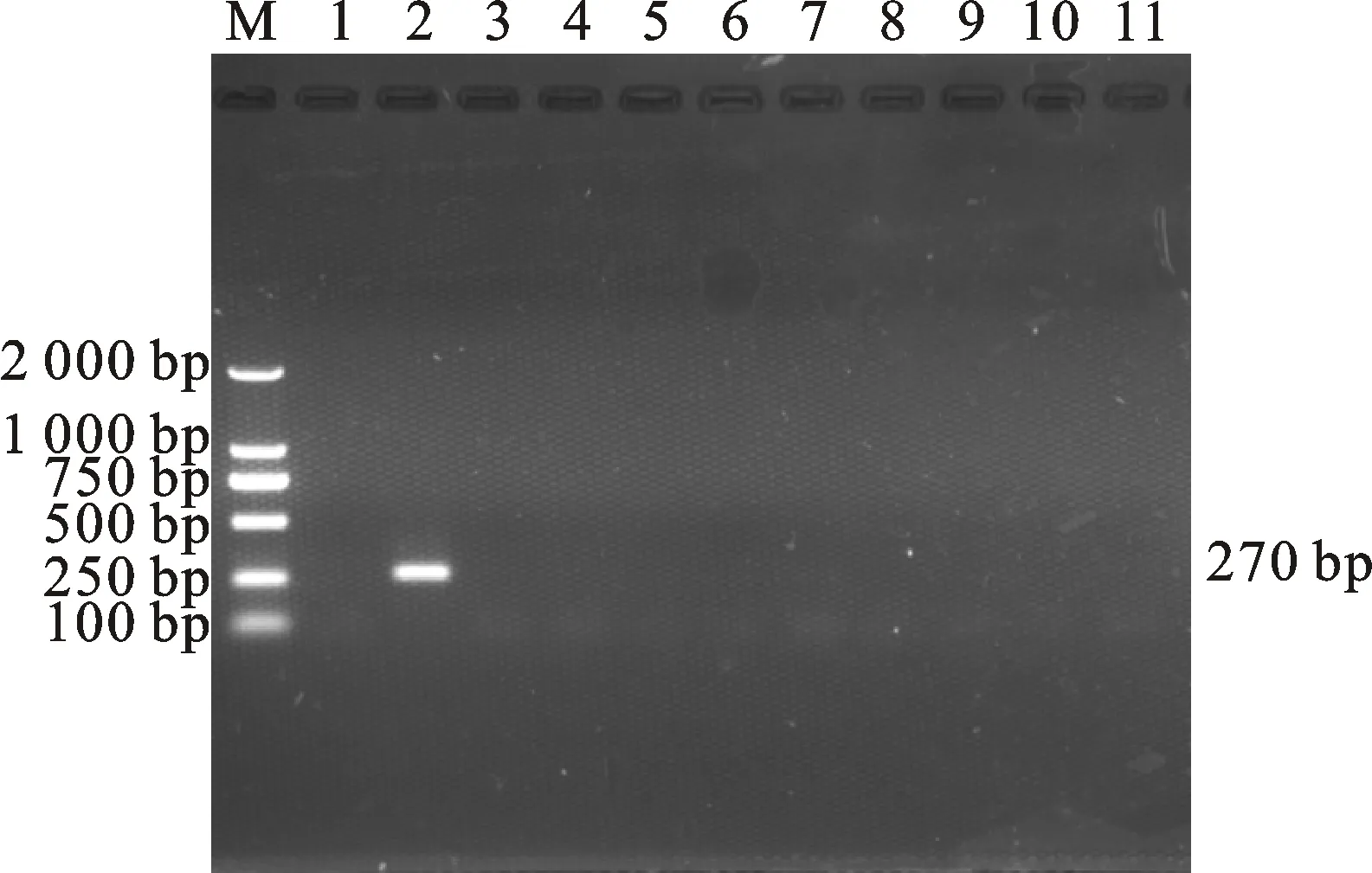
M. DNA 標準 DL 2000;1. 空白對照;2~11. DNA模板依次為捻轉(zhuǎn)血矛線蟲卵、細頸線蟲卵、似血矛線蟲卵、蘭氏毛尾線蟲卵、尖尾線蟲卵、網(wǎng)尾線蟲卵、夏伯特線蟲卵、蛇形毛圓線蟲卵、毛尾線蟲卵、粗紋食道口線蟲卵
2.3 PCR敏感性試驗
將DNA質(zhì)量濃度為116.529 ng/μL的陽性質(zhì)粒標準品,按5倍比例逐級稀釋至0.06 pg/μL后,以10個稀釋濃度梯度為DNA模板進行PCR擴增。結(jié)果顯示,該PCR方法能檢測到的DNA質(zhì)量濃度最低為0.298 pg/μL(圖3)。
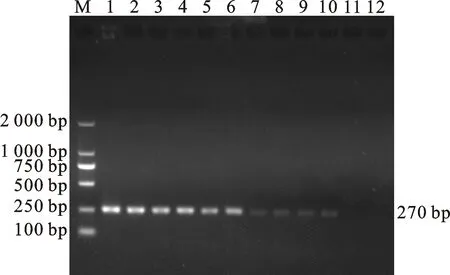
M. DNA 標準 DL 2000; 1~11. 捻轉(zhuǎn)血矛線蟲卵DNA質(zhì)量濃度為116.529 ng/μL 、23.309 ng/μL、4.661 ng/μL、0.932 ng/μL、0.186 ng/μL、0.583 ng/μL、0.037 ng/μL、0.007 ng/μL、1.492 pg/μL、0.298 pg/μL、0.060 pg/μL;12. 空白對照
2.4 臨床樣品檢測
2.4.1 糞便樣品顯微鏡檢結(jié)果 120只奶山羊糞便樣品中共檢出捻轉(zhuǎn)血矛線蟲陽性29只(其中藍田縣、千陽縣和富平縣3 個某奶山羊場的陽性數(shù)分別為23、4和2),陽性檢出率為24.2%。
2.4.2 糞便樣品PCR檢測結(jié)果 120只奶山羊糞便DNA樣品中共檢出46只陽性樣品(其中藍田縣、千陽縣和富平3 個某奶山羊場的陽性數(shù)分別為38、5和3),陽性檢出率為38.3%。將46只奶山羊陽性糞便樣品的PCR產(chǎn)物測序后進行同源性檢索,結(jié)果顯示,與數(shù)據(jù)庫內(nèi)收錄的捻轉(zhuǎn)血矛線蟲ITS2-28S 基因序列(MK300723.1)的相似度均為100%,由此判定,這46只奶山羊的糞便樣品為捻轉(zhuǎn)血矛線蟲感染陽性。
2.4.3 兩種檢測方法的結(jié)果比較 120只奶山羊糞便樣品經(jīng)光學(xué)顯微鏡檢查檢出29只捻轉(zhuǎn)血矛線蟲陽性(其中2只經(jīng)PCR檢測為陰性),而經(jīng)PCR方法檢出46只陽性。經(jīng)Kappa一致性檢驗顯示,兩種方法檢測結(jié)果之間存在一致性且一致性一般(Kappa=0.602,P<0.01);經(jīng)配對卡方檢驗顯示,兩種方法檢測捻轉(zhuǎn)血矛線蟲卵陽性差異極顯著(P<0.01)。
3 討 論
PCR方法因其快速、高效、敏感和便捷等優(yōu)點,在寄生蟲病原檢測及物種鑒定中發(fā)揮了重要的作用。核糖體DNA(rDNA)在真核生物中大量存在,且ITS2 rDNA序列因其具有低的種內(nèi)變異性和高種間變異性,已經(jīng)成為鑒定胃腸道線蟲的可靠遺傳工具[13-14],在線蟲新物種發(fā)現(xiàn)、種間鑒定和種群關(guān)系等方面具有重要意義。此外,28S 基因序列在物種內(nèi)都非常保守,因此,可作為反向引物的合適設(shè)計位點[15]。本研究利用捻轉(zhuǎn)血矛線蟲ITS2-28S rDNA序列篩選設(shè)計了一對特異性引物,并通過優(yōu)化PCR反應(yīng)條件,建立了一種用于捻轉(zhuǎn)血矛線蟲的PCR檢測方法,該方法可以特異性地檢出捻轉(zhuǎn)血矛線蟲卵。
捻轉(zhuǎn)血矛線蟲感染羊,并在皺胃發(fā)育成熟后通過糞便向外排出蟲卵,甚至會排出死亡的蟲體或蟲體碎片,通過分子生物學(xué)方法檢測糞便當中的病原可以大大提高羊捻轉(zhuǎn)血矛線蟲病的檢出率。本研究選擇捻轉(zhuǎn)血矛線蟲ITS2-28S的基因片段為靶基因建立PCR檢測方法,在50 ℃~ 60 ℃的溫度梯度中均能成功擴增出270 bp的特異性單一條帶,且在退火溫度為53 ℃時電泳條帶最亮。選取羊易感的其他幾種胃腸道線蟲卵作為對照,結(jié)果顯示,僅捻轉(zhuǎn)血矛線蟲卵基因組DNA為陽性,其余線蟲卵DNA全部為陰性,表明所建立的PCR檢測方法特異性良好,可以有效避免受到其他常見病原的干擾。在最佳PCR反應(yīng)條件下,通過對原始濃度的質(zhì)粒DNA進行5倍比例稀釋分別作為DNA模板進行PCR擴增,最低可檢測到的DNA量為0.298 pg,說明該檢測方法具有較高的敏感性。此外,本研究建立的方法與Bott等[16]利用ITS2基因建立的Real-Time PCR方法檢測捻轉(zhuǎn)血矛線蟲的敏感性相當(0.1 pg),但由于Real-time PCR需要成本更高的設(shè)備與試劑,對檢測人員的專業(yè)素養(yǎng)要求也更高,因此,目前只適用于試驗研究,而在臨床診斷應(yīng)用上受限。本研究建立的PCR方法與之相比,特異性和靈敏度相當,但成本更低。
本研究利用PCR方法對奶山羊的120只糞便樣品進行臨床檢測,同時與顯微鏡鏡檢結(jié)果進行對比發(fā)現(xiàn),鏡檢和PCR方法檢測結(jié)果一致性一般(Kappa=0.602,P<0.01);PCR方法檢測糞便中陽性率為38.3%,明顯高于顯微鏡鏡檢結(jié)果的24.2%,且差異極顯著(P<0.01)。值得注意的是,本次有2只羊糞便樣品經(jīng)鏡檢判定為捻轉(zhuǎn)血矛線蟲陽性,但經(jīng)PCR檢測結(jié)果卻呈陰性,分析其原因,可能是檢驗人員在顯微鏡檢查時,誤將其他線蟲的蟲卵判定為捻轉(zhuǎn)血矛線蟲蟲卵,這也是在顯微鏡鏡檢時容易出現(xiàn)的失誤。綜上結(jié)果表明,本研究建立的捻轉(zhuǎn)血矛線蟲PCR鑒定方法具有較高的特異性和敏感度,并且在通過直接檢測糞便中捻轉(zhuǎn)血矛線蟲蟲卵來確定羊只感染情況時,較顯微鏡檢查更為準確,且不需要鏡檢后的糞便幼蟲培養(yǎng)進行進一步確診,更加省時省力,具有一定的臨床應(yīng)用價值,為羊捻轉(zhuǎn)血矛線蟲病的臨床診斷提供了又一種可靠的技術(shù)選擇。

