2型糖尿病合并周圍神經病變病人血清Cys-C水平與神經傳導參數的相關性
牛 強,游婷婷,李 波
糖尿病作為臨床慢性疾病中較為常見的一類,可因胰島素分泌障礙或遺傳缺陷、內分泌疾病、病毒感染等生物作用使機體長期處于高血糖狀態,并進一步對機體心臟、腎臟、眼、血管及神經等多種組織產生損傷[1-2],引發相關組織器官功能障礙,對病人整體健康造成嚴重危害。在糖尿病病人的諸多并發癥中,糖尿病周圍神經病變(DPN)發病率相對較高,相關研究指出,國內60%左右住院治療的2型糖尿病(T2DM)病人合并有DPN[3-4],病人可表現出肢體痛覺過敏、感覺減退等感覺異常,癥狀多出現于下肢,造成行走或站立中足部位置異常,影響日常活動,嚴重者可發展為糖尿病足。DPN發病早期較為隱匿,約一半病人無明顯癥狀表現,目前臨床針對該病的診斷多需綜合癥狀表現、肌電圖檢查來完成,血清生化指標應用較少[5-6]。近年來,相關研究指出,糖尿病病人神經病變可能與氧化應激反應、血管損傷有關[7-8],而胱抑素C(Cys-C)作為半胱氨酸蛋白酶抑制劑超家族成員,除可作為腎功能評估指標外,亦可參與同型半胱氨酸(Hcy)代謝過程,促進機體氧化應激反應及血管內皮損傷,但有關其與神經病變的研究較少。本研究進一步探究T2DM合并DPN病人血清Cys-C表達與肌電圖神經傳導情況,現報道如下。
1 資料與方法
1.1 一般資料 選取2021年1月—2021年11月于我院接受治療的118例T2DM病人作為研究對象,根據DPN并發情況將其分為合并DNP組(61例)和單純T2DM組(57例)。納入標準:①符合《中國2型糖尿病防治指南(2017年版)》中T2DM診斷標準[9];②合并DNP病人符合《中國2型糖尿病防治指南(2017年版)》中DNP診斷標準;③于本院接受住院治療,并接受相關檢查。排除標準:①存在頸椎及腰椎退行性變、椎管狹窄、神經根壓迫等原因引發的神經病變;②吉蘭-巴雷綜合征;③存在淋巴管炎、靜脈栓塞等血管性病變者;④存在肝腎功能障礙或惡性腫瘤者;⑤藥物尤其是化療藥物引起的神經毒性作用以及腎功能不全引起的代謝毒物對神經的損傷。本研究符合赫爾辛基人體試驗準則要求。
1.2 方法 于病人入院后24 h內收集空腹靜脈血3 mL,經3 500 r/min離心處理10 min后,分離血清,采用酶聯免疫吸附試驗(ELISA)試劑盒測定血清Cys-C水平,具體步驟如下:在特異性抗體球蛋白孔位加入包被緩沖液進行稀釋,將濃度降至6 μg/mL,隨后在37 ℃下水浴3 h,結束后除去包被液,開始磷酸緩沖鹽溶液(PBS)洗滌,每次洗滌5 min,持續洗滌3次,隨后加入酶標特異性抗體溶液,在37 ℃下作用2 h,結束后對凹孔進行PBS洗滌,每次洗滌5 min,持續洗滌3次,隨后加入底物溶液0.2 mL,持續反應30 min,反應結束后注入0.05 mL終止劑,采用酶標比色計檢測血清Cys-C水平。在23 ℃室溫下采用美國Nicolet(AT2+6 amplifier)多通道肌電圖誘發電位儀檢測病人左右兩側正中神經感覺傳導速度(SCV)、正中神經運動傳導速度(MCV)、腓總神經SCV、腓總神經MCV,取兩側參數平均值。
1.3 觀察指標 比較兩組基線資料、血清Cys-C水平及肌電圖神經傳導參數,分析T2DM合并DPN病人血清Cys-C與肌電圖神經傳導參數的相關性,評估血清Cys-C與神經傳導參數對T2DM病人DPN并發情況的預測效能。

2 結 果
2.1 兩組一般資料比較 兩組性別、年齡、體質指數(BMI)、舒張壓比較,差異均無統計學意義(P>0.05),合并DNP組糖尿病病程長于單純T2DM組(P<0.05),收縮壓高于單純T2DM組(P<0.05)。詳見表1。

表1 兩組一般資料比較
2.2 兩組血清Cys-C水平及神經傳導參數比較 合并DNP組血清Cys-C水平均明顯高于單純T2DM組(P<0.05),正中神經SCV、正中神經MCV、腓總神經SCV、腓總神經MCV均明顯低于單純T2DM組(P<0.05)。詳見表2。

表2 兩組血清Cys-C水平及神經傳導參數比較(±s)
2.3 T2DM合并DNP病人血清Cys-C水平與神經傳導參數的相關性 Pearson相關性分析表明,血清Cys-C水平與正中神經SCV、正中神經MCV、腓總神經SCV、腓總神經MCV均呈負相關(P<0.05)。詳見表3。
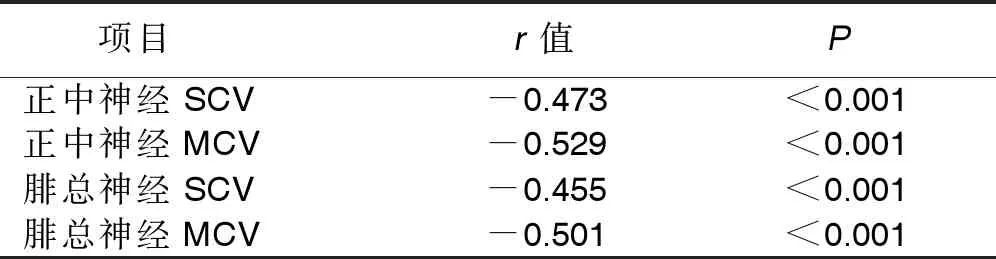
表3 T2DM合并DNP病人血清Cys-C水平與神經傳導參數的相關性分析
2.4 血清Cys-C水平與肌電圖神經傳導參數對T2DM病人并發DPN的預測效能 ROC曲線分析顯示,血清Cys-C、正中神經SCV、正中神經MCV、腓總神經SCV、腓總神經MCV預測T2DM病人并發DPN的ROC曲線下面積(AUC)分別為0.749,0.819,0.872,0.821,0.836,截斷值分別為1.51 mg/L、53.60 m/s、50.76 m/s、47.20 m/s、43.07 m/s,聯合診斷AUC可達到0.977,預測效能優于單項指標。詳見表4、圖1。

表4 血清Cys-C水平與肌電圖神經傳導參數對T2DM病人并發DPN的預測效能
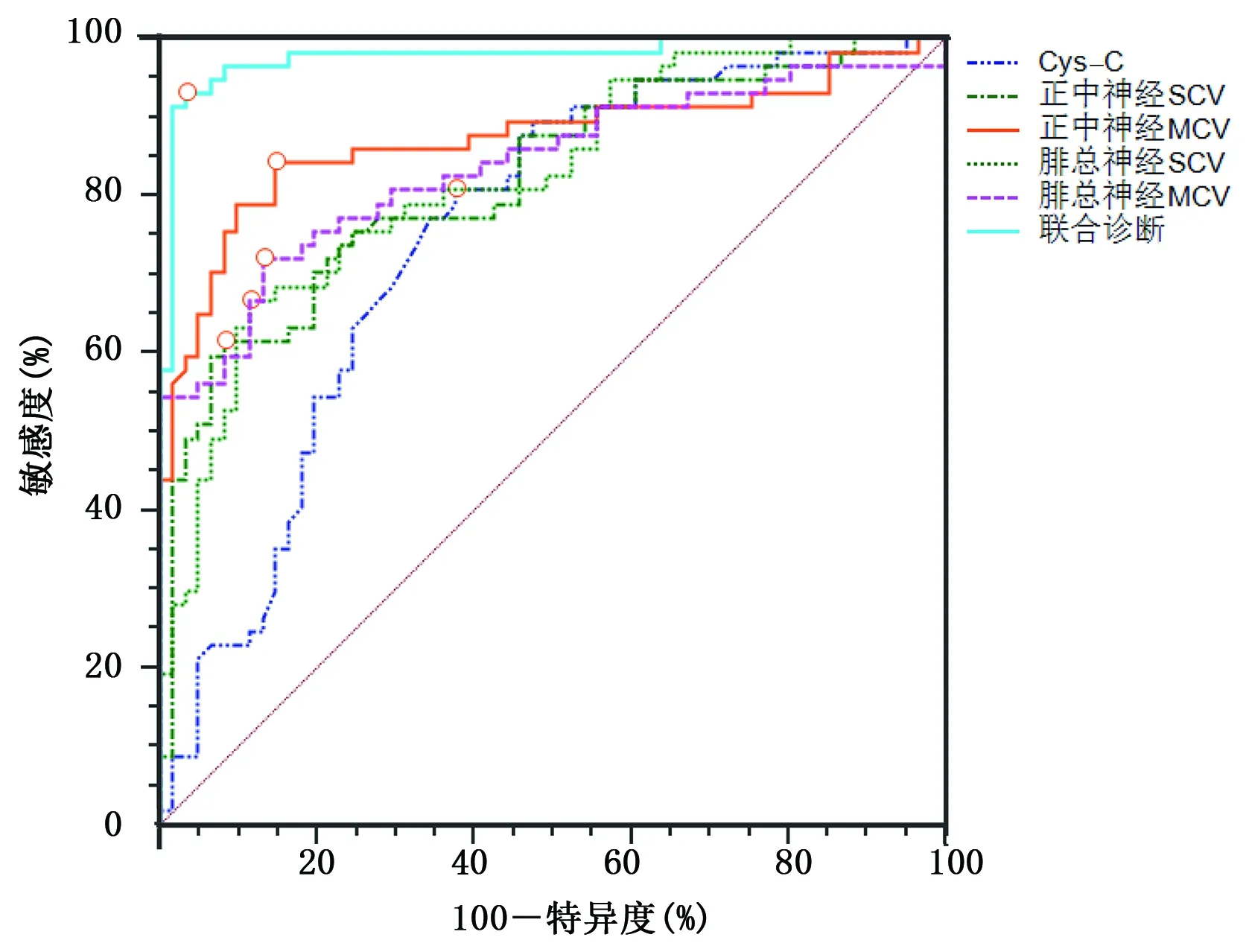
圖1 血清Cys-C水平與神經傳導參數預測T2DM病人并發DPN的ROC曲線
3 討 論
DPN作為糖尿病病人諸多并發癥中較多見的一類,其發病與血管損傷情況、代謝狀態紊亂、神經營養狀態不佳等多種因素相關,發病后可進一步引起下肢感染、足潰瘍、壞疽[10-11],處理不及時,病人可能面臨截肢風險。但DPN癥狀較為隱匿,部分病人發病早期無明顯自覺癥狀,待臨床癥狀出現后已形成不可逆性周圍神經病變,加大治療難度,故探尋早期預測DPN的生化指標十分必要。
DPN發病主要原因仍為糖尿病病人體內長期存在的高血糖狀態,然而,其發病機制尚未得到統一定論,大部分學者認為DPN屬于多因素共同影響產生的病變,可能涉及氧化應激反應及血管內皮損傷等多個生理過程[12]。循環中的Cys-C僅可在腎臟中被清除,其血清表達水平可在一定程度上反映腎小球濾過情況,在早期評估腎小球濾過功能障礙中較為敏感[13]。另一方面,Cys-C可通過與組織蛋白酶、Hcy的相互作用參與部分心血管疾病形成過程及Hcy代謝過程,而Hcy作為含巰基氨基酸,可對機體血管內皮細胞產生損傷,并促進損傷部位血管平滑肌的增生,使血栓調節因子表達水平上升,進而加重糖蛋白、脂質在血管壁的沉積情況,增加冠心病、動脈硬化發生風險;此外,其亦參與糖尿病病人慢性并發癥發生過程[14]。本研究發現,合并DNP組血清Cys-C水平高于單純T2DM組,提示T2DM病人神經損傷可能與血清Cys-C水平上升有關。經Pearson相關性分析發現,T2DM合并DNP病人血清Cys-C水平與SCV、MCV等神經傳導參數呈負相關,而經ROC曲線進一步分析證實,血清Cys-C預測T2DM病人DPN并發情況的AUC為0.749,具備良好的預測效能,說明此類病人血清Cys-C水平與其上下肢神經傳導損傷密切相關。血清Cys-C水平升高不但可反映腎小球濾過率,亦可加重機體炎癥反應,對部分Hcy分解酶產生抑制作用,增加Hcy濃度,從而促進過氧化氫生成,加重機體氧化應激反應及內皮損傷;同時,在高Hcy濃度狀態可抑制一氧化氮合酶表達,通過減少一氧化氮合成來降低內皮依賴性血管舒張反應,從而使血管內細胞因子分泌水平增高,繼而引發凝血功能紊亂、加重神經纖維缺血性損傷[15]。而隨著神經損傷加重,機體神經蛋白質合成及神經軸索轉運均可出現障礙,導致各項肌電圖神經傳導參數降低。
目前,臨床針對糖尿病病人神經病變的主要檢查手段仍為神經肌電圖檢查,檢查中主要通過評估肢體感覺、運動神經傳導功能來判斷病人神經病變發生情況[16],其中較為常用的指標為正中神經與腓總神經等部位的SCV、MCV,可反映病人上下肢神經傳導功能。本研究中,合并DNP組正中神經及腓總神經傳導參數更低,提示T2DM病人并發DNP后可伴隨明顯的上下肢神經傳導減退。而經ROC曲線進一步分析發現,正中神經SCV、正中神經MCV、腓總神經SCV、腓總神經MCV預測T2DM病人并發DPN的AUC分別為0.819,0.872,0.821,0.836,截斷值分別為53.60 m/s、50.76 m/s、47.20 m/s、43.07 m/s,相較于血清Cys-C均具備更良好的預測效能,提示正中神經SCV、MCV與腓總神經SCV、MCV等神經傳導參數可有效預測T2DM病人DPN并發情況。T2DM病人體內長期存在的高血糖狀態可使葡萄糖旁路代謝激活,從而經特定旁路通路代謝多余糖分,在醛糖還原酶的作用下形成山梨醇,還原型輔酶Ⅱ作為該催化過程中的輔酶,在大量消耗后可導致一氧化氮合成不足,或減少谷胱苷肽生成,均可造成自由基大量產生、血管內血流量降低,最終加重神經損傷[17];此外,病人血糖水平異常狀態可使蛋白質非酶促化反應加重,進而促進糖基化終末產物生成,而隨著這種產物在神經軸索及髓鞘的沉積,氧自由基基團對神經組織的損傷加重,軸索逆行轉運均可受到明顯負面影響,使神經細胞蛋白質合成出現障礙,最終導致軸索變性[18]。
綜上所述,T2DM合并DPN病人上下肢神經傳導受損表現較為明顯,同時可見血清Cys-C水平異常上升,臨床可利用Cys-C指標及傳統肌電圖神經傳導參數來預測T2DM病人DPN發生情況。

