淺談2022年湖南卷化學高考熱點題目的解題思路
王毓穎
(湖南省株洲市北附高級中學)
電化學和氧化還原反應作為化學高考中的熱點,2022年湖南卷的單選第8題和第9題引起了廣泛討論,筆者從一線教師的角度去回顧和解析上述兩題,為學生提供解題思路,并就上述題目淺析化學高考的知識要點和備考方向.
1 海水電池反應
電化學是高考的熱門考點,考查內容多為電化學的基礎知識.2022年湖南卷單選題第8題考查了原電池原理、化學反應式以及鋰—海水電池的分類.
例1海水電池在海洋能源領域備受關注,一種鋰—海水電池構造示意圖如圖1所示.下列說法錯誤的是( ).
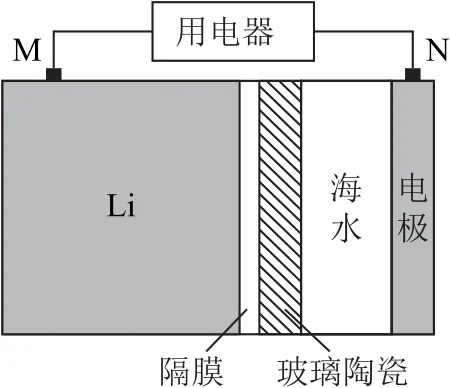
圖1
A.海水起電解質溶液作用
B.N 極僅發生的電極反應:
C.玻璃陶瓷具有傳導離子和防水的功能
D.該鋰—海水電池屬于一次電池
分析該題的爭議答案主要在選項A、B 之間,也有部分學生認為選D.該題的知識模塊為化學反應原理,屬于必修2和選修4的內容.本題考查了學生對于如下知識點的理解:原電池原理、原電池電極反應式的書寫以及鋰—海水新型電池.由圖像可知,該裝置為原電池裝置,是具備原電池形成條件的.
關于選項A:海水中含有豐富的電解質,如氯化鈉、硫酸鎂、氯化鈣等,其主要成分是鹽,可作為電解質溶液.故選項A 說法正確.
關于選項B:根據原電池正負極判斷方法,該電池M 為負極,N 為正極.負極參與反應的物質是金屬鋰,反應方程式為Li-e-=Li+,但是正極反應方程式并非只有一個.題干中表述的“N 極僅發生”的“僅”導致該選項錯誤.海水中是可以溶解氧氣的,其中溶解氧氣也有可能會得到電子,所以正極還有可能發生氧氣得電子的反應:O2+4e-+2H2O=4OH-,可以類比鋼鐵的吸氧腐蝕和析氫腐蝕.故選項B說法錯誤.
關于溶解的氧氣是否會得到電子,有些教師和學者做了相關的研究.徐海波、宋玉蘇、桑林等人通過海水溶解氧電池實驗研究認為氧氣是可以得到電子的.桑林在其文章中介紹晶體時寫到了鋰—海水溶解氧電池,但是作為軍工單位的研究內容,文章中并未詳細說明具體機理和工作流程.因此該選項的難點在于,考生會直接想到鋰和水的反應,卻不會考慮正極還有海水體系中溶解的氧氣可能也參與了反應.
關于選項C:鋰作為一種活潑金屬,會與水發生反應,因此采用了玻璃陶瓷——一種固體電解質材料,其作用有兩個:一個是隔絕水,防止鋰和水發生反應;另一個是傳導Li+,從而形成閉合回路.故選項C說法正確.
關于選項D:該電池為鋰電池,充電過程存在鋰枝晶問題.這個知識點大部分考生沒有聽過,屬于知識盲區,教師上課也不會作為重點進行講解,并且,正極生成的氫氣無法發生逆反應變為放電過程的反應物,不具備充電的功能,因此屬于一次電池,過程是不可逆的.故選項D 說法正確.
基于上述理論依據和分析,本題的答案是選項B.
如今的高考電化學試題通常以實際生活和工業應用的情境為載體,在題干中融入所要考查的電化學知識點,由此來考查學生的綜合能力以及核心素養.近年來考試命題方向除了鋰電池之外,新型材料電池(如微生物電池)等也是高考電化學命題的寵兒.筆者查閱相關資料發現,近幾年全國各地高考電化學知識點的考查方式都很靈活.例如,2020年山東卷試題考查了“微生物電池的應用”;2022年全國甲卷試題考查了“一種水性電解液Zn-MnO2離子選擇雙隔膜電池”;2022年全國乙卷試題考查了“Li-O2作為一種比能量高的電池,在汽車、航天等領域具有良好的應用前景”.由此不難發現,相較于傳統鋰電池而言,新型材料鋰電池不僅與我們的日常生活息息相關,更是高考的熱門考點,需要引起教師和學生的關注.對于在高考電化學專題的復習和練習上,學生不僅要從考查內容方面著手準備,同時也要結合電化學在日常生活中的具體應用情境,做到靈活掌握知識點.
2 氧化還原反應
氧化還原反應是每年高考的必考點,這是一個相對來說比較抽象的知識點,主要考查了學生對氧化還原反應的概念理解和規律分析,也考查了學生對化學反應的配比計算.下面以2022年湖南卷單選題第9題為例進行說明.
例2科學家發現某些生物酶體系可以促進H+和e-的轉移(如a、b和c),能將海洋中的轉化為N2進入大氣層,反應過程如圖2所示.下列說法正確的是( ).
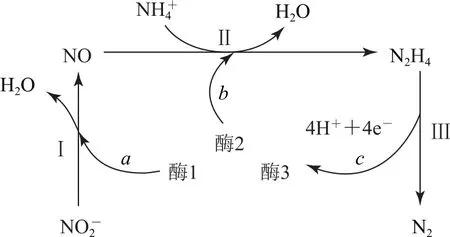
圖2
B.a和b中轉移的e-數目相等
C.過程Ⅱ中參與反應的n(NO)∶n()=1∶4
D.過程Ⅰ→Ⅲ的總反應為
分析該題的爭議答案在選項C和D 之間,選項A、B相對來說是比較好判斷的.該題的知識模塊屬于必修1的內容,考查了學生對于氧化還原反應這類知識點的理解.對于題干中“生物酶體系可以促進H+和e-的轉移”這句話的理解是本題的難點之一,也是影響學生解題的關鍵點.
先對流程圖進行分析:從箭頭的起點可以確定,該反應的反應物是,由箭頭的終點可以確定生成物是N2和H2O.而反應過程中先生成,后消耗的中間產物是NO 和N2H4.結合題干“某些生物酶體系可以促進H+和e-的轉移(如a、b和c)”和流程圖可以得出,酶1、酶2和酶3均為反應的催化劑.
關于選項B:過程Ⅰ反應為
過程Ⅱ反應為
過程Ⅰ對應a,過程Ⅱ對應b,所以a和b中轉移的e-數目是不相等的.故選項B錯誤.
關于選項C:根據“某些生物酶體系可以促進H+和e-的轉移(如a、b和c)”和流程圖可以得出,酶1、酶2和酶3為反應的催化劑,其功能是促進H+和e-的轉移.過程Ⅲ反應為
可以理解為過程Ⅲ產生了4molH+和4mole-,然后酶3將過程Ⅲ產生的4molH+和4mole-轉運出來,運輸給酶1 和酶2.其中酶1 使用2 molH+和1mole-,實現過程Ⅰ的反應
酶2使用剩下的2molH+和3mole-,實現過程Ⅱ的反應
不難發現,過程Ⅰ→Ⅲ,很像電極反應方程式,它們都是半反應,不算完整的氧化還原反應.由過程Ⅱ可知,參與反應的.故選項C錯誤.
本題的難點在于對題干信息“某些生物酶體系可以促進H+和e-的轉移”的解讀.雖然在不同的解題思路下,可以寫出符合的方程式,但是未體現題意,那么選項就不能納入備選.綜上分析可以得到,第9題應該選擇選項D.
在以往傳統命題思路下,對氧化還原反應知識點的考查是以“氧化還原反應化學方程式書寫”和“運用阿伏伽德羅常數的形式表示轉移電子數”等題型出現.但本題命題思路和往常不大一樣,命題組專家將“蓋斯定律”“電化學的正負極反應”以及“氧化還原反應”3個知識點相結合命題,對學生進行綜合考查,需要學生牢記得失電子守恒原則,并把握原子守恒原則,對學生知識的掌握程度和靈活運用原理解題的能力提出了更高的要求.
在平時的解題過程中,學生要留意新題型中題干與流程圖的提示,否則寫出來的方程式有可能不符合題目要求,是違背題目信息要求的,從而導致考試失分.同時,學生還要提高獨立思考的能力,在面對新題型時能靈活處理信息,從容解題,而非死記硬背,盲目套公式,守著固化的答題模式而陷入題目的陷阱中.
3 結論
筆者通過對近年高考化學命題方式的分析,發現近年來高考化學命題不僅強調對基本概念和化學原理的理解,更重視對理論與實踐的融會貫通.以本文所述兩道題為例,考題不同于以往考試命題——僅僅對單一的知識點進行考查,而是將不同知識點巧妙融合入題干中,并且加入在生活中實際應用的情境.
如今,全國高考命題趨勢更多地體現在:命題思路的靈活多變、不拘一格以及書本理論與生活實踐相結合來綜合考查知識點等.這便促使教師在日常教學過程中要更加遵循高中化學教學規律、重視課標和教材;同時也間接地避免學生機械刷題的學習方式,提升化學知識學習趣味性,最終使學生真正理解如何將化學知識點融會貫通和靈活運用.
(完)

