血清miR-199、miR-448表達與慢性乙型肝炎組織學特征以及進展為肝硬化的相關性分析
陳尚軍 蔣 蒙 張 繼 謝 虎 梁雪松
1.中國人民解放軍東部戰區海軍醫院感染科 (浙江 舟山,316000) 2.海軍軍醫大學附屬長海醫院感染科
慢性乙型肝炎是持續乙型肝炎病毒(HBV)感染引起的肝臟炎癥性疾病,世界衛生組織報告顯示2016年全球估計有2.57億慢性HBV感染者,約887 000人死于慢性HBV感染相關疾病,其中肝硬化占52%[1],我國肝硬化患者中約77%由HBV感染所致[2]。微小核糖核酸(miRNA)是內源性非編碼 RNA,在轉錄后調節靶基因的表達,與HBV復制、持續感染以及肝細胞損傷和肝硬化進展密切相關[3]。miR-199是與纖維化疾病相關的miRNA,通過調節caveolin-1、磷酸化激酶 B等纖維化相關分子途徑參與各器官纖維化發生和進展過程[4]。上皮-間充質轉化(EMT)來源的肌成纖維細胞是纖維化的關鍵,miR-448是與EMT相關的miRNA,通過抑制EMT降低波形蛋白和 E-鈣黏蛋白表達,進而促使癌細胞凋亡,降低遷移能力[5],但是miR-448是否參與慢性乙型肝炎患者肝硬化的發生尚不清楚。本研究通過檢測慢性乙型肝炎患者血清miR-199、miR-448表達,分析其與肝炎組織學特征以及進展為肝硬化的關系。
1 資料與方法
1.1 納入及排除標準 選擇2009年2月至2021年3月東部戰區海軍醫院收治的慢性乙型肝炎患者269例,納入標準:①經傳統血清學檢查,HBV病毒學和肝功能檢測、腹部超聲、病理學檢查證實為慢性乙型肝炎,符合《慢性乙型肝炎防治指南(2015 更新版)》中診斷標準[6];②年齡18周歲以上;③入組時未出現肝硬化;④知情同意簽署同意書。排除標準:①肝癌、自身免疫性肝病患者;②肝移植術后患者;③藥物或酒精性肝病患者;④近期應用免疫調節劑者;⑤妊娠或哺乳期女性。本研究已經獲得我院倫理委員會批準。
1.2 肝活檢 入組時進行肝組織活檢,患者左側臥位,局部消毒穿刺區域,采用16 G穿刺針(美國巴德公司)取長1.5 cm的肝組織活檢,5%甲醛固定,石蠟包埋切片,蘇木精-伊紅染色,選取6個匯管區在顯微鏡(奧林巴斯 BX50)下觀察。采用METAVIR評分評價肝臟炎癥和纖維化程度。肝臟炎癥活動度分級:G0,無;G1,輕度;G2,中度;G3,中/重度;G4:重度。根據METAVIR炎癥活動分級將患者分為G0~1組(68例)、G2組(104例)、G3~4組(97例)。肝纖維化分級:S0,纖維化形成;S1,輕度纖維化;S2,纖維化超過匯管區;S3,橋接纖維化;S4,肝硬化[7,8]。根據纖維化分期將患者分為S0~1組(71例)、S2組(110例)、S3組(88例)。
1.3 血清miR-199、miR-448表達檢測 入組時(T0)、入組1個月(T1)、入組3個月(T2)、末次隨訪時(T3)采集患者靜脈血3 ml,注入干燥試管后在室溫下靜置30 min,離心(相對離心力688×g),5 min,取上層液上機檢測。取200 μl血清樣本,miRNeasy提取試劑盒(美國Qiagen公司)提取總RNA,NanoDrop-2000分光光度計(美國Thermo公司)評估RNA質量,采用qScriptTMmicroDNA cDNA合成試劑盒(美國Quanta Biosciences公司)將RNA逆轉為cDNA,逆轉錄條件:37℃ 60 min,95℃ 5 min,4℃維持。miScript SYBR Green Master Mix試劑盒(美國Qiagen公司),7500實時PCR系統(美國Applied Biosystems公司)進行定量PCR反應,應用 2-ΔΔCt方法以 GAPDH 為內源對照評估比較miR-199、miR-448相對表達量。引物序列:miR-199,正向引物為5′-GCCAAGCCCAGTGTTCAGAC-3′,反向引物為5′-GTGCAGGGTCCGAGGTATTC-3′;miR-448,正向引物為5′-GCGTTGCATATGTAGGAT-3′,反向引物為5′-CTGGTGTCGTGGAGTC-GG-3′;U6,正向引物為5′-CTCGCTTCGGCAGCACA-3′,反向引物為5′-AACGCTTCACGAATTTGCGT-3′。反應條件:95℃ 15 min,94℃ 15 s,55℃ 30 s,70℃ 30 s,共40個循環。反應體系:Power SYBR?Green PCR Master Mix 2.5 μl,cDNA(12.5 ng)特異引物2 μl,RNase-Free ddH2O 21 μl。
1.4 隨訪和臨床資料收集 所有慢性乙型肝炎患者出院后均定期電話隨訪,門診復查,不適隨診,隨訪截止至2021年10月,統計隨訪期間乙型肝炎肝硬化發生情況。乙型肝炎肝硬化診斷標準[9]:①HBsAg陽性、或 HBsAg陰性、抗-HBc陽性且既往 HBsAg陽性>6個月,并除外其他病因;②肝臟活組織病理學提示肝硬化。③影像檢查顯示肝硬化和(或)門靜脈高壓征象;內鏡檢查顯示食管胃底靜脈曲張;肝臟硬度值測定符合肝硬化;白蛋白水平<34 g/L和(或)凝血酶原時間(PT)延長超過正常值3 s;血小板計數<100×109/L,符合①和②或者①和③中2項以上可診斷為肝硬化。收集慢性乙型肝炎患者年齡、性別、慢性乙型肝炎病程、肝硬化家族史、吸煙史、飲酒史、HBV DNA載量、丙氨酸氨基轉移酶(ALT)、天門冬氨酸氨基轉移酶(AST)、PT、臨床治療等信息。
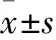
2 結果
2.1 慢性乙型肝炎患者不同肝組織學特征T0血清miR-199、miR-448表達比較 G3~4、S3組血清miR-199表達高于G2和G0~1組、S2和S0~1組(P<0.05),miR-448表達低于G2和G0~1組、S2和S0~1組(P<0.05);G2組、S2組血清miR-199表達高于G0~1組、S0~1組(P<0.05),miR-448表達低于G0~1組、S0~1組(P<0.05)。見表1。
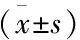
表1 慢性乙型肝炎患者不同肝組織學特征T0血清miR-199、miR-448表達比較
2.2 肝炎組、肝硬化組血清miR-199、miR-448表達比較 中位隨訪51(7~152)個月,截止末次共失訪14例,余255例慢性乙型肝炎患者中121例發生乙型肝炎肝硬化(肝硬化組),134例未發生乙型肝炎肝硬化(肝炎組)。肝炎組、肝硬化組T0、T1、T2、T3血清miR-199、miR-448表達變化差異具有統計學意義(F組間=623.475、532.168,P<0.05),兩組患者血清miR-199表達呈持續增高趨勢,miR-448表達呈持續降低趨勢(F時間=135.241、205.124,P<0.05),兩組間存在交互效應(F交互=152.427、172.414,P<0.05)。肝硬化組患者T0、T1、T2、T3血清miR-199表達高于肝炎組(P<0.05),miR-448表達低于肝炎組(P<0.05)。見表2。
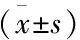
表2 肝炎組、肝硬化組血清miR-199、miR-448表達比較
2.3 慢性乙型肝炎進展為肝硬化的影響因素分析 肝炎組和肝硬化組患者單因素分析結果見表3。以是否發生乙型肝炎肝硬化為因變量(賦值:0=否,1=是),飲酒史(賦值:0=否,1=是)、肝硬化家族史(賦值:0=否,1=是)、乙型肝炎病程、ALT、AST、PT、白蛋白、血小板計數、HBV DNA載量、T3血清miR-199、T3血清miR-448為自變量,向后逐步法排除無關變量(入α=0.05,出α=0.10),最終ALT、HBV DNA載量、T3血清miR-199、T3血清miR-448與慢性乙型肝炎進展為肝硬化有關(P<0.05)。見表4。

表3 慢性乙型肝炎進展為肝硬化的單因素分析

表4 慢性乙型肝炎進展為肝硬化的Logistic回歸方程
2.4 T3血清miR-199、miR-448診斷慢性乙型肝炎進展為肝硬化的價值分析 T3血清miR-199、miR-448診斷慢性乙型肝炎進展為肝硬化的截斷值為2.11、1.09,曲線下面積為0.742、0.765,聯合T3血清miR-199、miR-448(取各自截斷值)診斷慢性乙型肝炎進展為肝硬化的曲線下面積為0.924,高于單獨T3血清miR-199、miR-448(z=6.249、5.781,P<0.05)。見表5和圖1。

表5 T3血清miR-199、miR-448診斷慢性乙型肝炎進展為肝硬化的效能

圖1 T3血清miR-199、miR-448診斷慢性乙型肝炎進展為肝硬化的ROC圖
3 討論
HBV持續感染可導致肝組織炎癥反應,引起肝星狀細胞和成纖維細胞合成大量膠原蛋白并在肝實質內沉積。在病毒性肝炎中,過度肝纖維化通常發生在門靜脈束內,這與持續的門靜脈炎癥有關,隨著門靜脈周圍纖維化的發展,出現橋接纖維化并跨越肝小葉,逐漸延伸到肝實質內,導致肝硬化的發生。慢性乙型肝炎進展為肝硬化受多種因素影響,包括年齡較大、男性、慢性活動性肝炎、ALT水平較高、失代償史、基因變異等[10]。表觀遺傳在慢性乙型肝炎進展為肝硬化的機制中發揮重要作用,miRNA在多種細胞過程中發揮重要作用,包括病毒-宿主的相互作用,部分miRNA通過與HBV轉錄調節基因相互作用調節病毒復制和持續感染[3],在肝纖維化進展和肝硬化過程中,miRNA通過調節多種細胞通路參與膠原蛋白在細胞外基質過度和持續積累過程,與肝硬化的發生密切相關[11]。
miR-199家族是負責細胞外基質沉積和促纖維化細胞因子釋放的小非編碼 RNA,包括3個成員,分別是miR-199a1、miR-199a2和miR-199b[12]。miR-199與纖維化疾病密切相關,現有報道顯示在腎間質纖維化模型中miR-199a-3p表達增加,miR-199a-3p通過抑制其靶基因細胞因子信號傳導抑制蛋白7表達,激活信號轉導子和轉錄激活子3,增加轉化生長因子(TGF)-β1誘導的Ⅰ型膠原蛋白和波形蛋白表達,促使腎間質纖維化進程[13]。Lino等[14]在單側輸尿管梗阻誘導的腎纖維化小鼠模型以及膽管結扎和四氯化碳誘導的肝纖維化小鼠模型中也觀察到miR-199a-5p表達增加,miR-199a-5p在TGFβ誘導下表達上調,并促進成纖維細胞激活,增殖、遷移、侵襲和分化為肌成纖維細胞,發揮促纖維化作用。miR-199-5p被認為是口腔黏膜下纖維化關鍵miRNA,其表達上調可促使膠原蛋白Ⅰ、Ⅲ表達,引起口腔纖維細胞增殖,導致口腔黏膜下纖維化發生和進展[15]。本研究顯示慢性乙型肝炎患者基線血清miR-199表達隨著肝臟炎癥分級和纖維化分期的增加而增高,通過隨訪發現,肝硬化組患者T0、T1、T2、T3血清miR-199表達均高于肝炎組,表明miR-199與肝炎癥活動增強,肝纖維化進展和肝硬化的發生有關,推測miR-199在慢性乙肝肝炎進展為肝硬化過程中可能發揮促肝硬化作用。回歸分析結果顯示miR-199過表達是慢性乙肝肝炎合并肝硬化的危險因素,證實了miR-199過表達與慢性乙肝肝炎發生肝硬化的因果關系,驗證了上述推測。Bi等[16]報道顯示miR-199靶向角質形成細胞生長因子(KGF)mRNA 的 3'-UTR以抑制KGF蛋白質翻譯,降低KGF表達,促使肝纖維化,沉默miR-199后可激活KGF逆轉纖維化進程,該結果也說明miR-199在肝纖維化發病機制中發揮促纖維化作用,支持本研究結論。
肌成纖維細胞是纖維化的關鍵細胞介質,肌成纖維細胞激活可生成大量膠原蛋白,并在細胞外基質中沉積,導致組織過度生長、硬化。肌成纖維細胞主要來源于間充質細胞、上皮細胞和內皮細胞,其激活需要EMT。EMT是上皮細胞逐漸轉變為間充質樣細胞并失去其上皮功能和特征的過程,正常EMT可促使細胞外基質沉積,形成新的上皮組織,促使傷口愈合,但EMT異常可引起上皮細胞持續轉變為肌成纖維細胞,導致纖維化的發生[17]。miR-448是一種抑癌基因,廣泛參與細胞過程,包括增殖、凋亡、侵襲和EMT過程,在乳腺癌、肝細胞癌和結腸直腸癌等多種惡性腫瘤中表達下調,研究顯示miR-448表達缺失可促使EMT,導致癌細胞侵襲和遷移[18],miR-448過表達可下調波形蛋白,抑制癌細胞的EMT,抑制細胞增殖、遷移和侵襲[19]。本研究發現miR-448與慢性乙型肝炎合并肝硬化也存在密切關系,肝硬化組患者血清miR-448表達明顯低于肝炎組,且血清miR-448表達隨著肝臟炎癥分級和纖維化分期的增加而降低,說明miR-448表達缺失可能誘導和加重慢性乙型肝炎患者肝硬化過程。Xu等[20]發現miR-448可靶向下調ABC轉運蛋白超家族的C亞家族3,抑制Jun N 末端激酶信號通路,促使肺成纖維細胞增殖減少,凋亡增加,逆轉肺纖維化進程。Yang等[21]報道顯示miR-448-5p缺失可上調正弦同源框同源物1(Six1)表達,導致TGF-β1表達上調,進而促使支氣管上皮細EMT和肺纖維化。以上結果提示miR-448表達異常與纖維化疾病發生有關,但miR-448通過何種機制參與慢性乙型肝炎患者肝硬化過程尚不清楚,已知TGF-β是一種主要的促纖維化細胞因子,其信號通路激活通過Smad信號通路誘導內皮細胞的間充質轉化,促使肝纖維化[22],miR-448可通過靶向調控其下游信號傳導抑制TGF-β表達[23],阻止肌成纖維細胞激活和膠原蛋白產生,逆轉肝纖維化進程和肝硬化的發生,而miR-448表達缺失則促使肝硬化發生。
ROC分析結果顯示T3血清miR-199、miR-448診斷慢性乙型肝炎合并肝硬化的曲線下面積為,表明miR-199、miR-448具有較高的價值,聯合兩項指標后其診斷效能明顯提高,提示同時檢測血清miR-199、miR-448表達,可為臨床診斷提供更準確的信息。Khairy等[24]報道顯示丙型肝炎病毒感染肝炎患者纖維化晚期血清miR-199表達顯著上調,miR-448表達顯著下調,miR-199和 miR-448可作為評估肝纖維化進展的非侵入性生物標志物。
綜上,乙型肝炎肝硬化患者血清miR-199高表達,miR-448低表達與慢性乙型肝炎患者炎癥分級、肝硬化分期以及進展為肝硬化均有關,可作為慢性乙型肝炎進展為肝硬化評估的指標。

