基于單細胞組學分析LCLAT1在喉鱗癌中的表達及其與預后的關系
王嘉達,沈志森,沈一鳴,王嘉寧
喉癌是一種常見的頭頸部惡性腫瘤[1],病理類型主要是鱗狀細胞癌[2]。雖然近幾十年喉癌全球死亡率有所下降,但是東南亞地區喉癌疾病負擔依然嚴峻[3]。因而尋求新的治療靶點,抑制腫瘤進展,提高喉癌患者的生活質量是十分重要的。磷脂作為細胞膜的重要組成部分,是腫瘤細胞增殖必要的養分[4]。有研究顯示心磷脂酰基轉移酶1(LCLAT1)在肺癌中通過調節線粒體動力學來調節腫瘤的增殖和轉移[5]。但是LCLAT1在喉癌中的作用尚不清楚,因此本研究使用單細胞轉錄組學分析了LCLAT1在喉癌上皮細胞亞群中的表達情況,并結合癌癥基因組圖譜(TCGA)數據庫、Reactome數據庫和String數據庫進一步分析LCLAT1潛在的作用。現報道如下。
1 資料與方法
1.1 材料 來自3例喉鱗癌患者的腫瘤組織、癌旁組織及對應的淋巴轉移組織共9個樣本用于單細胞RNA測序,喉癌標本20例用于免疫組織化學實驗,這些標本均來自2019年10—12月寧波市醫療中心李惠利醫院的患者,本研究通過醫院倫理委員會批準(批號:KY2020PJ191)。在Reactome數據庫(https://reactome.org) 下載甘油磷脂合成途徑相關基因128個。從TCGA數據庫下載喉鱗癌基因轉錄組測序數據及對應的臨床信息,共123例,其中腫瘤組織111例,正常組織12例。
1.2 單細胞轉錄組測序實驗 將腫瘤組織切成直徑約3 mm小塊,用磷酸鹽緩沖液(PBS)反復沖洗,去除表面雜質。使用人腫瘤解離試劑盒(Miltenyi Biotec,Cat No.130-095-929,德國)解離組織。經由70m細胞篩過濾及離心機離心后獲得細胞沉淀,將細胞再次置于PBS溶液中保存。使用10 XGenomics單細胞轉錄組測序平臺捕獲單細胞、極低量RNA反轉錄擴增和DNA文庫構建。使用NovaSeq 6000測序平臺進行測序。上機要求:樣本存活率>85%,細胞濃度700~1200個/l。
1.3 生信分析方法 使用“Seurat”包分析單細胞測序下游數據,數據整合及去批次效應通過CCA方法尋找錨定點細胞實現[6]。使用“AUCell”包對細胞進行生物學功能富集分析。使用“copykat”包鑒定惡性細胞。采用R軟件(4.1.3版本)“limma”包和“survival”包分析128個甘油磷脂合成途徑相關基因在TCGA喉癌隊列中的表達水平及與總體生存率的關系。使用Cytoscape軟件與String數據庫構建蛋白質互作網絡并鑒定核心基因。
1.4 免疫組織化學實驗 免疫組化實驗采用Envision兩步法。石蠟切片烘烤后,用常規二甲苯和乙醇脫臘,然后用PBS洗滌3次,每次3 min。在黑暗環境下3%過氧化氫孵育10 min阻斷內源性過氧化物酶后,切片先后與一抗和二抗孵育。切片用二氨基聯苯胺(DAB)染色,蘇木精復染,在不同濃度的乙醇中梯度脫水后,然后在病理醫師的協助下用顯微鏡檢查。抗原使用兔單克隆抗體LCLAT1[Abcam(ab122197),Cambridge,UK]。
1.5 統計方法 采用R軟件進行數據分析,基因差異表達分析logFC=1。單因素回歸分析采用Cox分析和Kaplan-Meier分析,取交集。P<0.05表示差異有統計學意義。
2 結果
2.1 喉鱗癌單細胞測序分析 經過多重質量控制后,獲得50 618個細胞和36 567個基因用于下游分析。一共識別出10個主要細胞簇,基于一些經典的細胞標記基因,分別命名為上皮細胞、內皮細胞、CD8+T細胞、B細胞、漿細胞、髓系細胞、成纖維細胞、肥大細胞、漿細胞樣樹突狀細胞和中性粒細胞,見圖1。對上皮細胞進一步聚類,一共識別出11個細胞簇。使用“AUCell”R包計算每一個上皮細胞“細胞周期通路”的活性,發現細胞簇1是細胞周期活性最高,見圖2左圖淺綠色細胞簇。使用“copykat”R包鑒定出惡性細胞主要是細胞簇0、1、2、4、8,見圖2右圖紅色細胞。
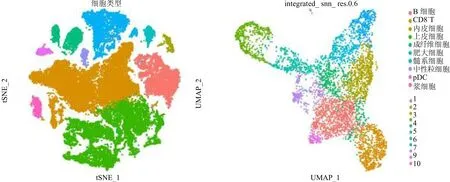
圖1 通過TSNE和UMAP分別展示喉鱗癌腫瘤微環境及上皮細胞異質性注:左圖tSNE圖展示喉鱗癌腫瘤微環境10個主要的細胞亞群。右圖UMAP圖展示上皮細胞11個細胞亞群
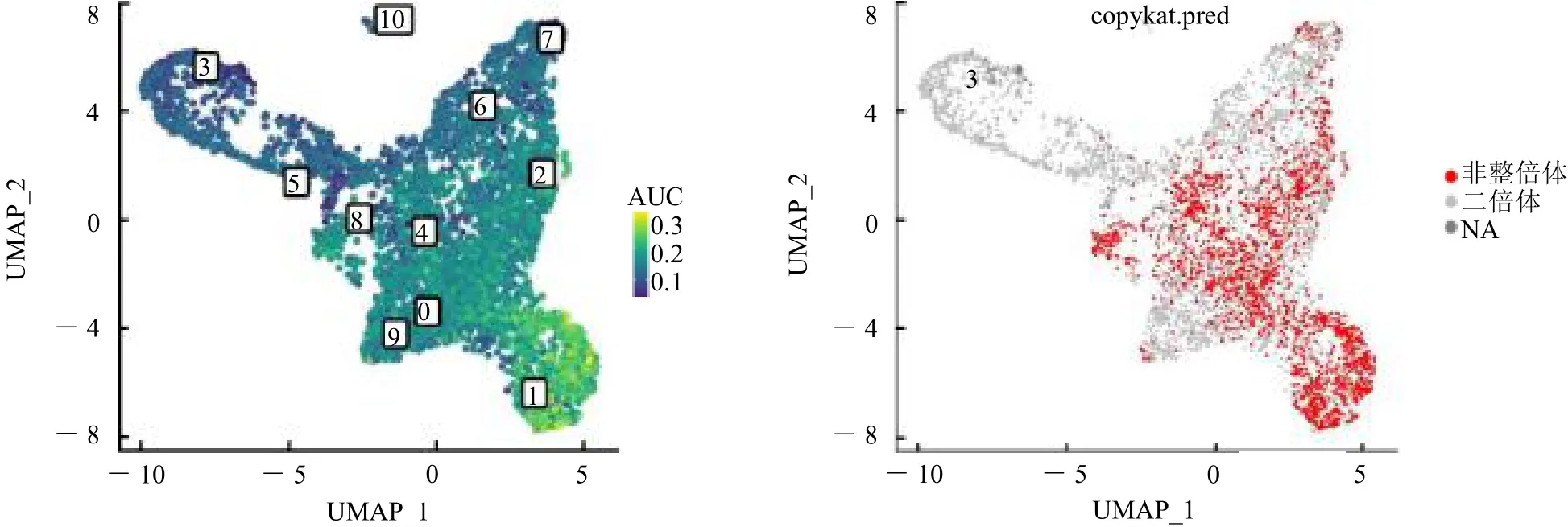
圖2 上皮細胞AUCell和copykat分析結果
2.2 LCLAT1在喉癌中的表達分析 單細胞測序結果表明在上皮細胞中LCLAT1主要在細胞簇c1與c10表達,簇c1為細胞增殖活躍的惡性細胞簇,簇c10整體上遠離上皮細胞,僅包含15個細胞,并且檢測出大量線粒體相關基因,該細胞簇是凋亡的細胞,差異無統計學意義(P>0.05),見圖3。基于TCGA喉癌隊列分析,結果表明LCLAT1在腫瘤組織中高表達(LogFC=1.214,P<0.005),128個甘油磷脂合成途徑相關基因中有30個基因在腫瘤與正常組織中表達差異均有統計學意義(均P<0.05),使用這30個基因構建了蛋白質相互作用網絡,LCLAT1是甘油磷脂合成途徑中的關鍵基因之一,見圖3。20例喉癌標本免疫組織化學實驗結果表明LCLAT1在腫瘤組織中高表達,見圖4。
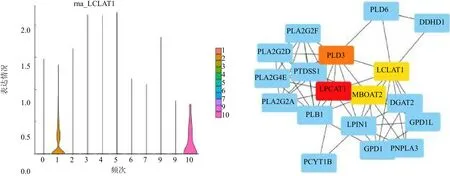
圖3 LCLAT1在喉癌上皮細胞中的表達情況及在甘油磷脂合成途徑中的核心價值
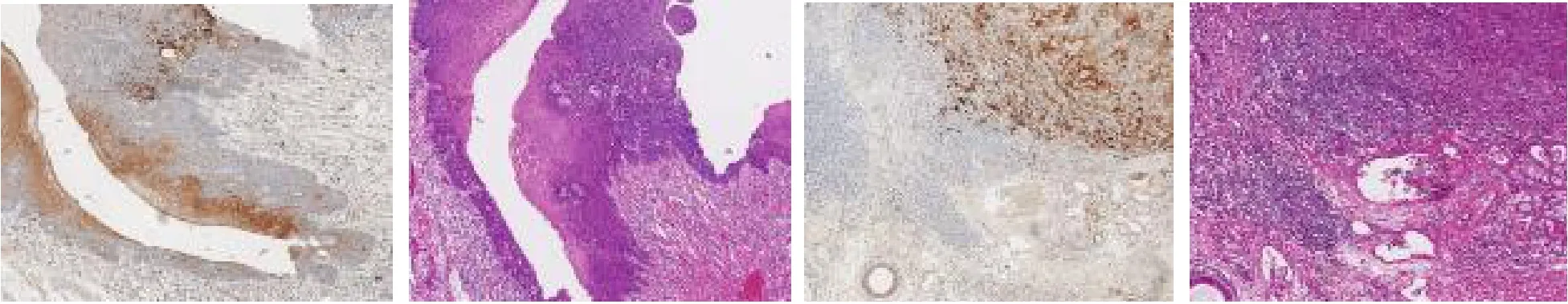
圖4 喉鱗癌腫瘤組織和正常組織的免疫組織化學染色結果(HE染色,×7)
2.3 LCLAT1與喉癌預后的關系 在30個表達差異有統計學意義的基因中,有2個基因與喉癌的總體生存率相關,其中LCLAT1是危險系數最高的基因(HR=2.296,95%CI:1.172~4.498,P<0.05),另外一個是MBOAT2(HR=1.336,95%CI:1.018~1.756,P<0.05)。單因素和多因素Cox風險回歸分析顯示LCLAT1是喉癌的獨立預后指標,見表1~2,ROC曲線分析顯示LCLAT1是喉癌可靠的預后指標,1、3和5年生存率曲線下面積分別為0.657、0.608和0.629。
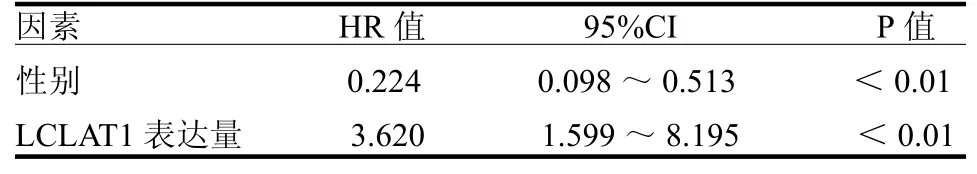
表1 影響喉癌患者生存預后的多因素回歸分析
3 討論
本研究使用單細胞轉錄組學重點探討了喉鱗癌上皮細胞的異質性,檢測樣本包含3例喉鱗癌患者的腫瘤組織、癌旁組織及對應的淋巴結轉移組織,觀察了LCLAT1在上皮細胞亞群中的表達情況。結果顯示LCLAT1大部分位于線粒體內,主要參與甘油磷脂合成途徑。因此筆者收集了128個甘油磷脂合成途徑相關基因,分析了它們在喉癌中的表達及其與預后的關系,評估LCLAT1在喉鱗癌甘油磷脂合成途徑中的重要作用。最后通過對20例喉鱗癌標本進行免疫組織化學實驗驗證了LCLAT1在喉癌腫瘤組織中高表達,在癌旁組織中低表達。
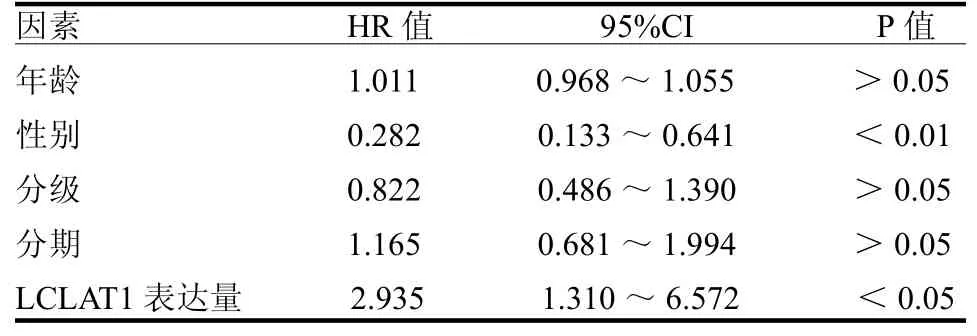
表2 影響喉癌患者生存預后的單因素回歸分析
代謝重編程是癌癥發生、進展和轉移的主要特點[7]。線粒體作為各種代謝途徑的交匯點,在癌癥發展中起著重要作用。心磷脂含有大量不飽和脂肪酸,主要位于線粒體內膜,病理情況下可以易位至外膜,調控氧化應激、細胞凋亡和炎癥反應等[8-10]。有研究發現胰腺癌干細胞中存在心磷脂結構改變[11],靶向線粒體功能的治療可以明顯改善癌癥宿主的能量和蛋白質代謝[12]。目前已有多種靶向線粒體的納米技術試圖通過能量代謝干擾、線粒體蛋白干擾及活性氧調節等方法治療癌癥[13]。有研究發現心磷脂可以改變線粒體膜的脂質成分,導致膜透化,心磷脂與脂質包埋的柔紅霉素共同遞送,可以增加乳腺癌細胞的藥物攝取量,提高藥物細胞毒性[14]。將藥物靶向遞送到細胞器是分子藥理學的現代趨勢之一[15]。
線粒體對機體免疫系統至關重要,線粒體的細胞代謝和代謝編程與先天免疫反應密切相關[16]。免疫細胞激活后需要大量的能量,供給不同的免疫細胞線粒體會采取不同的措施,例如在活化的T細胞中線粒體通過增加糖酵解供給能量,而在調節性T細胞中則通過增加 氧化供能[17]。除了能量供給外,線粒體還可以通過產生三羧酸循環的活性氧和代謝物來調控免疫細胞活化和免疫反應的信號級聯[18]。有研究發現線粒體特異性心磷脂的從頭合成是CD8+T細胞維持正常的抗原反應性所必需的[19]。心磷脂不光可以影響外周免疫系統,還可以調控中樞神經系統的免疫功能[20]。還有研究發現胞外的心磷脂可以通過Toll樣受體4依賴途徑調節星形膠質細胞分泌的細胞因子和細胞毒素[21]。胞質接觸的錯位心磷脂還可以作為損傷相關分子模式通過模式識別受體誘導炎癥,參與干燥綜合征、系統性紅斑狼瘡及類風濕關節炎等自身免疫性疾病[22]。
本文結果提示LCLAT1是喉癌的危險因素。其主要功能是調節心磷脂的代謝以及進而調控線粒體功能,雖然這項研究尚在初始階段,仍需要大量實驗驗證LCLAT1在喉鱗癌甘油磷脂代謝過程中的作用,但是本研究為靶向甘油磷脂代謝途徑或者靶向線粒體的癌癥新治療提供了思路。
利益沖突 所有作者聲明無利益沖突
作者貢獻聲明 王嘉達:實驗操作、論文撰寫;王嘉達、沈一鳴、王嘉寧:數據整理、統計學分析;沈志森:研究指導、論文修改、經費支持

