海水體系碳酸鈉水合物結晶形成過程研究及應用
鞏學敏,張榮瑜,李 娜,郝雅楠,張 千
(華北理工大學化工學院,河北唐山 063210)
近年來,淡水資源緊缺促進了海水淡化產業的發展[1-2]。海水淡化產生大量的副產物濃海水,若將其直接排海將對海洋生態系統產生不利影響[3]。濃海水中含有大量的化學資源[4-6],且這些物質含量約為天然海水的2倍,從濃海水中提取這些物質比直接從海水中提取更經濟。濃海水中氯化鈉含量豐富,可以作為氨堿法制堿的原料[7-9]。但是,濃海水中氯化鈉濃度較低,若用來生產純堿,還需要增大氯化鈉的濃度。現有精制化鹽工藝可以使濃海水中氯化鈉濃度達到飽和狀態,其符合純堿生產對原料的要求,但是該方法鹽耗大,生產成本較高[7]。因此,增大副產濃海水的濃度,可以減少純堿生產的化鹽過程,且有利于實現濃海水資源利用最大化目標,緩解濃海水排海造成的資源浪費和海洋環境污染問題。
目前,水合物結晶法海水濃縮技術以能耗低、工藝簡單、潔凈環保等優點得到廣泛關注[10-11]。常用的水合劑多采用烷烴類、二氧化碳、氮氣等氣體[12-15],各氣體分子形成水合物的環境條件較為苛刻,常常需要較為嚴格的溫度和壓力范圍,且有些水合劑還存在毒性和爆炸性等危險因素。有些無機鹽類的化合物在常壓條件下的過飽和水溶液中亦可形成結晶水合物,其過程具有操作簡單、運輸方便、安全無毒害等特點。碳酸鈉在低于32 ℃的單鹽飽和水溶液中可結晶析出Na2CO3·10H2O。相較于其他無機鹽水合劑,增濃后的海水可用于純堿生產,碳酸鈉水合物結晶過程未引入雜質離子[16-18]。利用這些性質,碳酸鈉可以作為水合劑進行海水濃縮工藝研究。利用工業生產余熱資源,碳酸鈉水合物經熱分解得到無水碳酸鈉,又可作為水合劑進行循環使用。鑒于此,基于水鹽體系相平衡理論,研究了0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元海水體系相圖特征,分析碳酸鈉水合物的結晶過程,探討了碳酸鈉水合物法增濃海水的技術工藝。
1 實驗部分
1.1 試劑和儀器
試劑:NaCl、Na2CO3、Na2SO4及分析所用試劑均為分析純,所用溶劑水均為去離子水。
儀器:CHD-0530型低溫恒溫槽,用于相平衡恒溫水浴;SmartLab型X射線衍射儀(XRD),用于平衡固相表征,Cu靶Kα射線,管電壓為40 kV,管電流為100 mA,掃描速率為10(°)/min,掃描范圍2θ為10~90°。
1.2 實驗裝置及方法
實驗裝置如圖1所示,設定溫度為0 ℃±0.1 ℃。0 ℃時Na2CO3-Na2SO4-NaCl-H2O相平衡反應時間為12 h。以0 ℃時Na2CO3-Na2SO4-NaCl-H2O體系各三元子體系相平衡數據[19]為基礎,通過改變另一種鹽投加量,分別得出四元體系的相平衡溶解度數據。
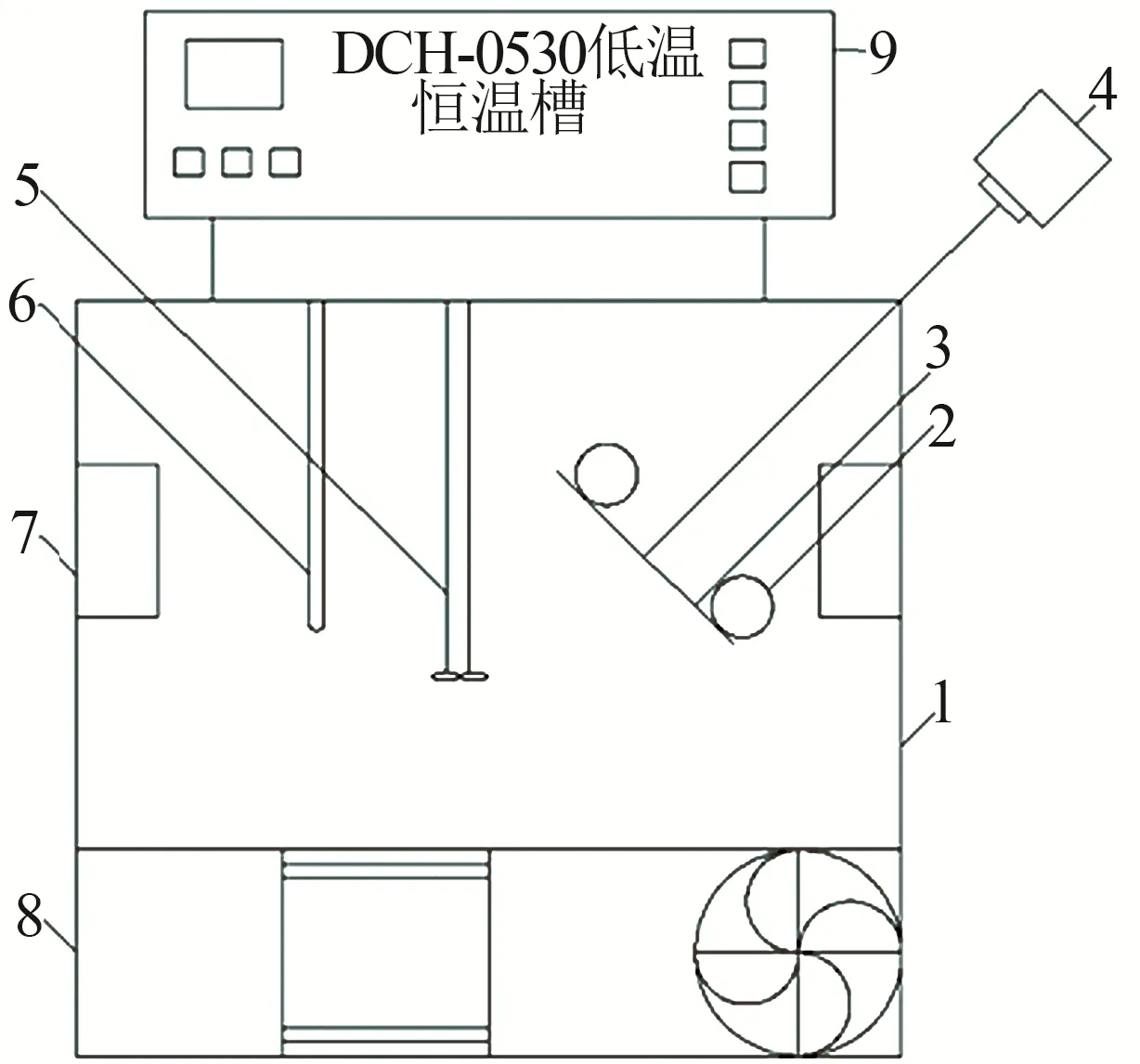
圖1 相平衡反應實驗裝置Fig.1 Experimental apparatus of phase equilibrium
1.3 分析方法
等溫法測定0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系相平衡溶解度。其中:CO32-含量采用雙指示劑(指示劑)滴定法測定;SO42-濃度采用加入BaCl2生成BaSO4的重量法測定;Cl-濃度采用硝酸銀滴定法測定[20]。取3個平行樣品同時進行測定,液相中各離子含量分析方法的不確定度為±0.01。平衡固相組成采用XRD表征分析確定。
2 結果及討論
2.1 0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系相平衡研究
0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系相平衡溶解度數據見表1。表1中0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系存在1個等溫共飽點,其液相共飽和對應平衡固相XRD譜圖見圖2。將樣品XRD譜圖與標準卡進行對比,定性分析得出等溫共飽點A對應的平衡固相組成為Na2CO3·10H2O、Na2SO4·10H2O和NaCl。
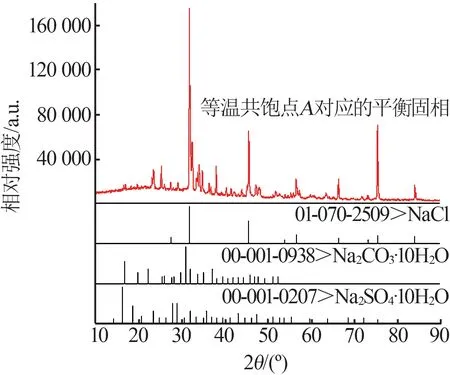
圖2 等溫共飽點A對應的平衡固相XRD譜圖Fig.2 XRD patterns of equilibrium solid phase corresponding to isothermal cosaturation point A
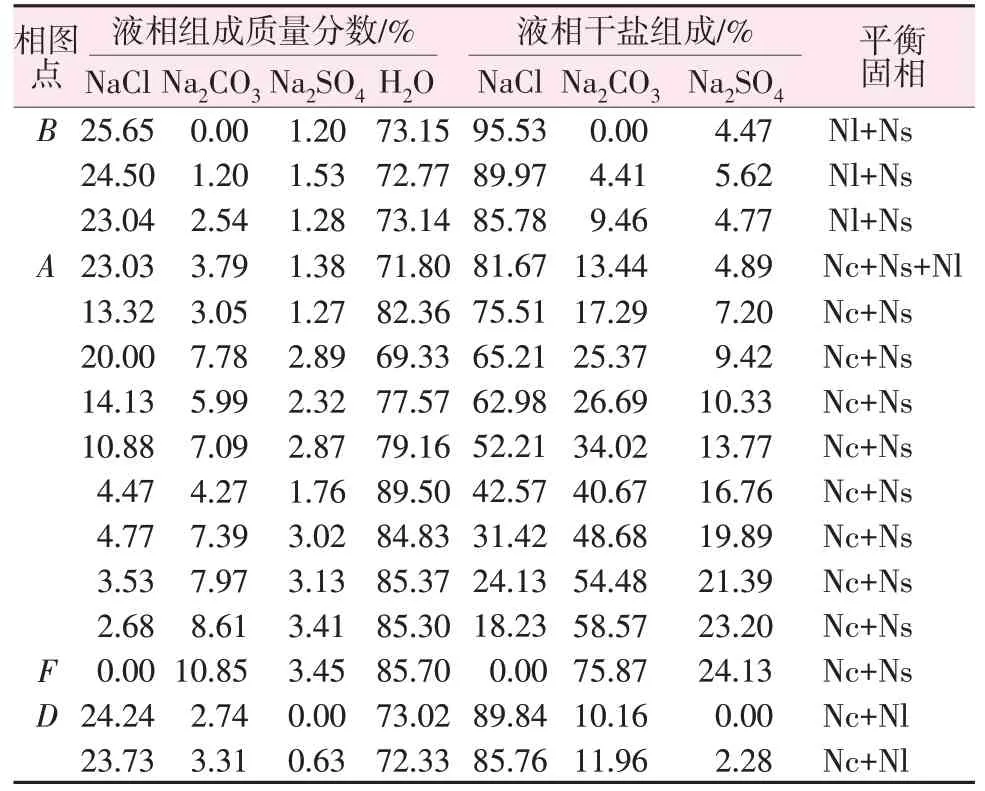
表1 0 ℃時NaCl-Na2SO4-Na2CO3-H2O四元體系相平衡溶解度數據Table 1 Phase equilibrium solubility data of NaCl-Na2SO4-Na2CO3-H2O system at 0 ℃
根據表1數據繪制0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系相圖,如圖3b所示。由圖3b可得:0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系可生成1個三鹽等溫共飽點A,其對應的平衡固相組成為Na2CO3·10H2O、Na2SO4·10H2O和NaCl;形成3個單鹽結晶區,包括ABCDA為NaCl固相與共飽和溶液結晶區、GBAFG為Na2SO4·10H2O固相與共飽和溶液結晶區、EFADE為Na2CO3·10H2O固相與共飽和溶液結晶區;形成3條兩鹽共飽和曲線,包括BA為NaCl與Na2SO4·10H2O兩鹽固相共飽曲線、DA為NaCl與Na2CO3·10H2O兩鹽固相共飽曲線、FA為Na2SO4·10H2O與Na2CO3·10H2O兩鹽固相共飽曲線。通過相圖分析表明,0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系可生成較大面積的Na2CO3·10H2O結晶區。對于海水的增濃過程,可采用加入碳酸鈉使其形成Na2CO3·10H2O結晶的方法進行研究。
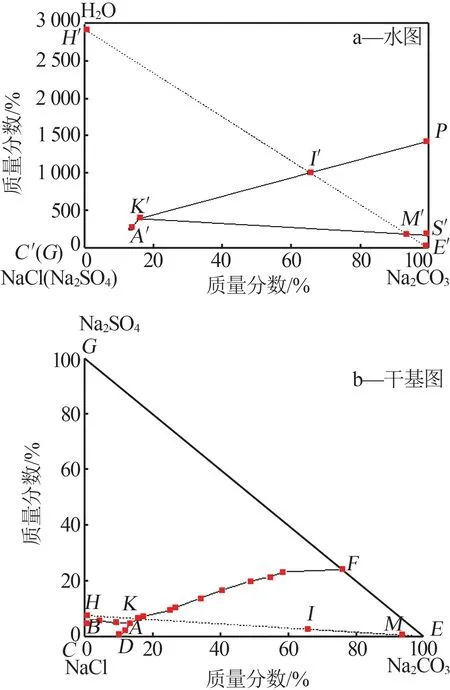
圖3 0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系平衡相圖Fig.3 Equilibrium phase diagram of Na2CO3-Na2SO4-NaCl-H2O quaternary system at 0 ℃
2.2 碳酸鈉水合物法增濃海水工藝研究
以京唐鋼海水淡化副產濃海水為研究對象,忽略較低含量的Ca2+、Mg2+成分,濃海水組成以及干鹽組成如表2所示。
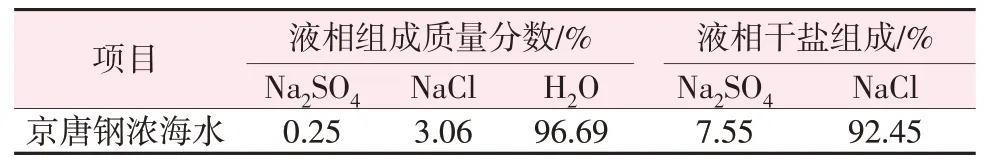
表2 副產濃海水組成Table 2 Compositions of byproduct from concentrated seawater
基于0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系干基相圖,結合該體系水圖特征,分析0 ℃時碳酸鈉水合物法增濃海水工藝過程,如圖3所示。圖3a為工藝水圖,圖3b為工藝干鹽圖,干鹽圖和水圖中組成點分別對應。實線表示相間線,虛線表示工藝過程線。京唐鋼濃海水組成點為圖3b干鹽圖中的H點,對應圖3b水圖中的H′。根據相圖直線規則,向副產濃海水中加入無水碳酸鈉,隨著其投加量逐漸增大,混合體系組成點在濃海水組成點和碳酸鈉組成點之間移動,即干鹽圖中沿著HE線由H向E移動,水圖中沿著H′E′線由H′向E′移動。線段HE與Na2CO3·10H2O和Na2SO4·10H2O兩鹽共飽和線FA相交于K點,對應于水圖為K′點。
圖3a水圖中,點S′表示Na2CO3·10H2O的固相組成點,點P表示Na2CO3的飽和溶解度點。連接S′K′,與線段H′E′相交于M′點,M′對應干鹽圖中M點;連接PK′,與線段H′E′相交于I′點,I′對應于干鹽圖中I點。無水碳酸鈉加入海水體系過程中,混合體系組成點在H′I′階段時,加入的碳酸鈉全部溶解,混合體系為未飽和狀態,沒有碳酸鈉水合物結晶析出;隨著碳酸鈉不斷加入,混合體系點達到I′點時,開始析出Na2CO3·10H2O結晶固相;繼續增大碳酸鈉投加量,混合體系組成點在I′M′階段時,Na2CO3·10H2O結晶析出量不斷增大,且M′點時Na2CO3·10H2O固相析出量最大;繼續加入無水碳酸鈉,Na2SO4·10H2O與Na2CO3·10H2O兩種固相將同時析出。對于研究碳酸鈉水合物增濃海水技術,只考慮I′M′混合體系組成部分。基于相圖的杠桿規則和直線規則分析,干鹽圖中IM混合體系組成部分的固相組成為Na2CO3·10H2O,母液組成均為K點,即K點(水圖中的K′)為增濃后海水體系組成點。根據海水資源利用最大化原則,選取M點(水圖M′)為碳酸鈉最佳投加量組成點進行分析。
2.3 工藝計算
基于物料守恒定律,以1 000 kg京唐鋼濃海水作為研究對象,對0 ℃時碳酸鈉水合物法增濃海水工藝進行計算,結果見表3。
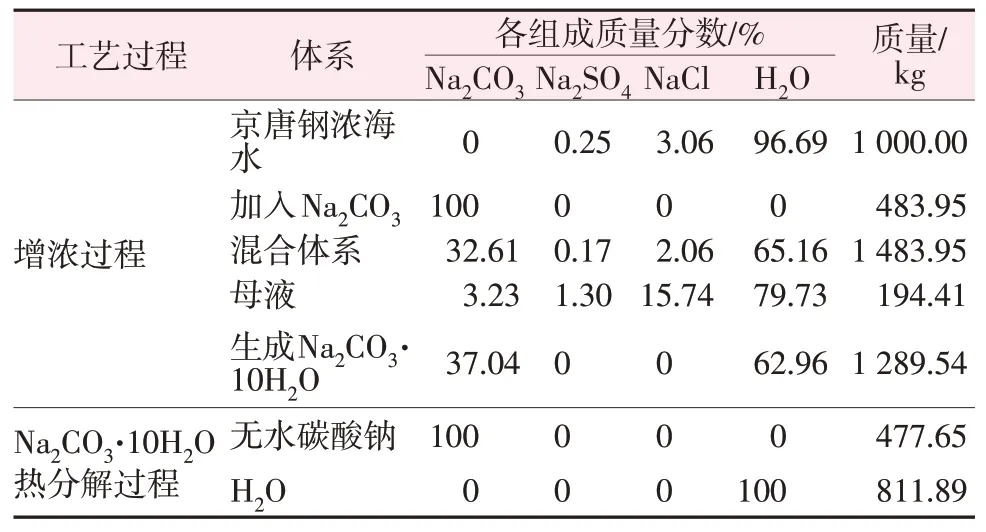
表3 0 ℃時碳酸鈉水合物法增濃海水工藝計算Table 3 Calculation of seawater concentration by sodium carbonate hydrate method at 0 ℃
由計算結果可得,每利用1 000 kg京唐鋼濃海水,需要加入483.95 kg無水Na2CO3組成混合體系。在0 ℃條件下反應12 h后達到相平衡,固液分離后得到Na2CO3·10H2O析出量為1 289.54 kg,并產生194.41 kg母液,即為增濃后的濃海水質量,其組成為Na2CO3質量分數為3.23%、Na2SO4質量分數為1.30%、NaCl質量分數為15.74%、H2O質量分數為79.73%。整個增濃工藝過程中,海水濃縮率達到80.56%,濃縮后氯化鈉濃度是原濃海水的5.14倍。分離產生的十水合碳酸鈉經熱分解得無水碳酸鈉477.65 kg,碳酸鈉的回收率為98.70%。
碳酸鈉水合物法增濃海水技術工藝流程見圖4。通過向京唐鋼濃海水中加入無水碳酸鈉水合劑,在0 ℃條件下反應12 h,達到相平衡后靜置分離,析出碳酸鈉結晶水合物。通過離心分離,分別得到增濃后的海水與Na2CO3·10H2O結晶。增濃后的海水經精制處理可以用于純堿生產的原料;Na2CO3·10H2O結晶可以作為工業生產的副產品,或經過熱分解得到無水碳酸鈉,實現工藝的循環利用。
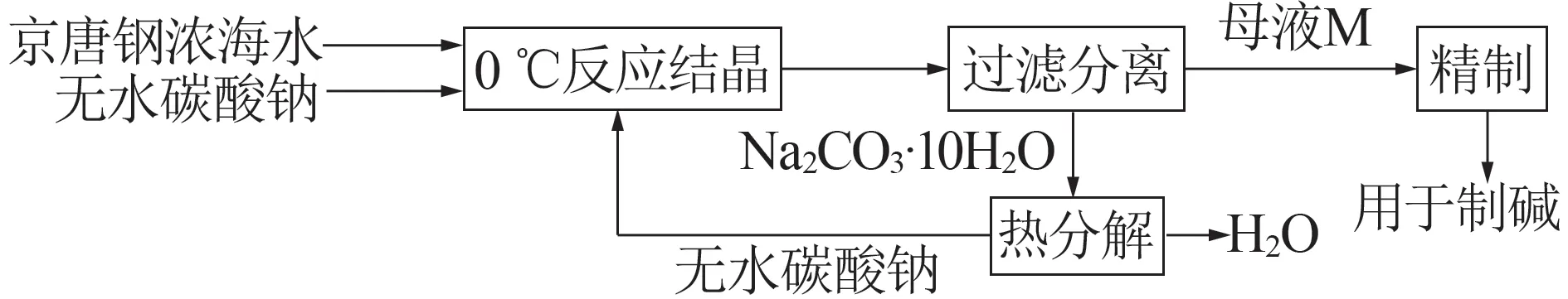
圖4 濃海水濃縮工藝流程圖Fig.4 Process flow diagram of concentrated seawater concentration
3 結論
1)采用等溫溶解法測定了0 ℃時Na2CO3-Na2SO4-NaCl-H2O四元體系相平衡溶解度數據,并繪制了相圖。相圖特征分析表明,該體系存在1個等溫共飽點和3個結晶區,較大面積Na2CO3·10H2O結晶區的形成可用于碳酸鈉水合物法增濃海水技術研究。
2)以京唐鋼濃海水為研究對象,設計碳酸鈉水合物法增濃海水工藝,并進行工藝計算。結果表明:每利用1 000 kg濃海水,需要加入483.54 kg Na2CO3,反應平衡分離后得到增濃海水194.41 kg,其NaCl質量分數為15.74%,相當于原副產濃海水質量分數的5.14倍。該技術的濃海水濃縮率為80.56%,碳酸鈉回收率為98.70%。
3)碳酸鈉水合物法增濃技術可以高效增濃海水,具有操作簡單、安全、對環境友好等特點。增濃后的海水經精制處理可以用于氨堿法生產純堿的原料,可以減少原有純堿生產工藝的化鹽過程,有利于濃海水利用最大化。該技術為海水淡化副產濃海水的綜合利用提供了理論和數據支持。