西藏卡瑪多微晶菱鎂礦熱分解行為研究
田曉利,李志勛,馮潤棠,張 潔,鄭全福,史旭武,杜永彬
[1.濮陽濮耐高溫材料(集團)股份有限公司,河南濮陽 457100;2.青海濮耐高新材料有限公司,青海海東 810700;3.西藏昌都市翔晨鎂業(yè)有限公司,西藏昌都 854000]
菱鎂礦是生產鎂及鎂化合物的主要原料,被廣泛應用于冶金、建材、化工、農牧業(yè)、汽車及環(huán)保等領域[1-7]。通過對菱鎂礦熱分解行為進行研究,可以優(yōu)化熱分解條件,實現菱鎂礦的高效利用,對生產實踐具有重要的指導意義。
目前,研究人員對顯晶質菱鎂礦熱分解動力學進行了大量研究。BAI等[8]用TG-DTG法和TGDSC法對菱鎂礦進行了研究,發(fā)現菱鎂礦的分解溫度為550~650 ℃。吳鋒等[9]發(fā)現,塊狀菱鎂礦開始分解溫度和完全分解溫度均高于粉狀菱鎂礦;在相同分解率下,菱鎂礦粒度越大,分解所需平均活化能越大,煅燒溫度越高。上述關于菱鎂礦的研究多是顯晶質菱鎂礦,而微晶菱鎂礦的相關研究卻少見報道。
近年發(fā)現的西藏卡瑪多微晶菱鎂礦儲量豐富。為了給該微晶菱鎂礦的開發(fā)利用提供理論指導,筆者以西藏卡瑪多微晶菱鎂礦為原料,研究了不同升溫速率條件下微晶菱鎂礦的熱分解特性,并進行了熱力學計算,同時根據微晶菱鎂礦的熱重實驗數據,采用非等溫熱重分析方法(FWO法和KAS法)計算了不同升溫速率條件下微晶菱鎂礦的熱分解活化能,最后分析了微晶菱鎂礦的分解產物氧化鎂的微觀形貌。
1 實驗部分
1.1 實驗原材料
實驗所用原料為西藏卡瑪多微晶菱鎂礦,其化學成分如表1所示。從表1可以看出,微晶菱鎂礦純度較高,MgO質量分數與燒失量(LOI)之和大于98%,Fe2O3及SiO2等雜質含量低。微晶菱鎂礦的物相組成和微觀形貌如圖1和圖2所示。從圖1和圖2可以看出,微晶菱鎂礦的主要物相為MgCO3且峰形尖銳,晶體形貌多為立方體和柱狀體,粒徑為2~4 μm。
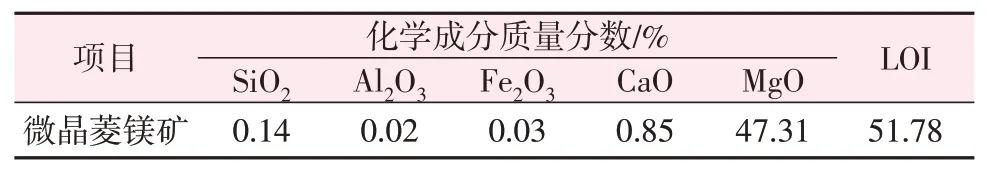
表1 微晶菱鎂礦化學成分Table 1 Chemical compositions of microcrystalline magnesite
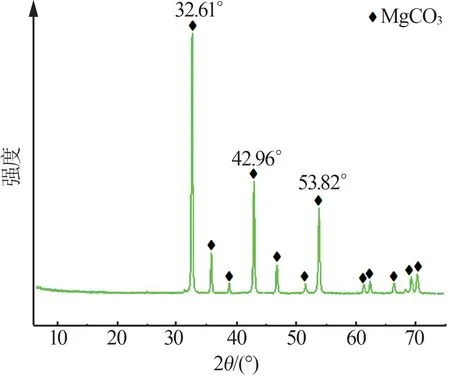
圖1 微晶菱鎂礦XRD譜圖Fig.1 XRD pattern of microcrystalline magnesite

圖2 微晶菱鎂礦SEM照片Fig.2 SEM image of microcrystalline magnesite
1.2 實驗過程與分析表征
1)將微晶菱鎂礦依次經過鄂式破碎機和對輥破碎機破碎,并篩分。
2)選取粒徑≤0.5 mm的微晶菱鎂礦顆粒,采用RZ-8-17型高溫熱重儀進行熱重分析。空氣氣氛,分別以2、5、10 ℃/min的升溫速率從室溫加熱至1 000 ℃,同時做平行實驗。
3)根據熱重分析結果,采用公式(1)計算微晶菱鎂礦熱分解產物輕燒氧化鎂的分解率[4]。
式中:α為試樣的分解率;m0為試樣的原始質量;mx為試樣加熱過程中的質量;m∞為試樣完全分解后的質量。
4)結合上述實驗結果,對微晶菱鎂礦的熱分解行為分別進行熱力學和動力學計算。
5)采用掃描電鏡(SEM,Nova NanoSEM230)觀察微晶菱鎂礦分解后的微觀形貌。
2 結果與討論
2.1 微晶菱鎂礦分解熱力學
圖3為微晶菱鎂礦在不同升溫速率條件下(空氣氣氛)的TG曲線。從圖3可以看出:在不同升溫速率條件下TG曲線的變化趨勢相同;TG曲線上僅有一個質量損失臺階,表明微晶菱鎂礦熱分解為一步反應;微晶菱鎂礦熱分解的開始溫度無明顯差異(約為372 ℃),但是熱分解結束溫度隨著升溫速率的增大而增加(升溫速率為2 ℃/min時,結束溫度為767 ℃;升溫速率為5 ℃/min時,結束溫度為862 ℃;升溫速率為10 ℃/min,結束溫度為為902 ℃),表明升溫速率越大,達到相同分解率所需的煅燒溫度越高。這是因為,升溫速率大會導致菱鎂礦分解產生的CO2氣體迅速增加,由于CO2氣體排出不暢,導致礦石反應界面周圍CO2氣體分壓增大,進而阻礙了分解反應的進行。其次,增大升溫速率會導致礦石內外溫度梯度變大,進而引起熱量傳遞滯后,最終影響微晶菱鎂礦內部的分解。
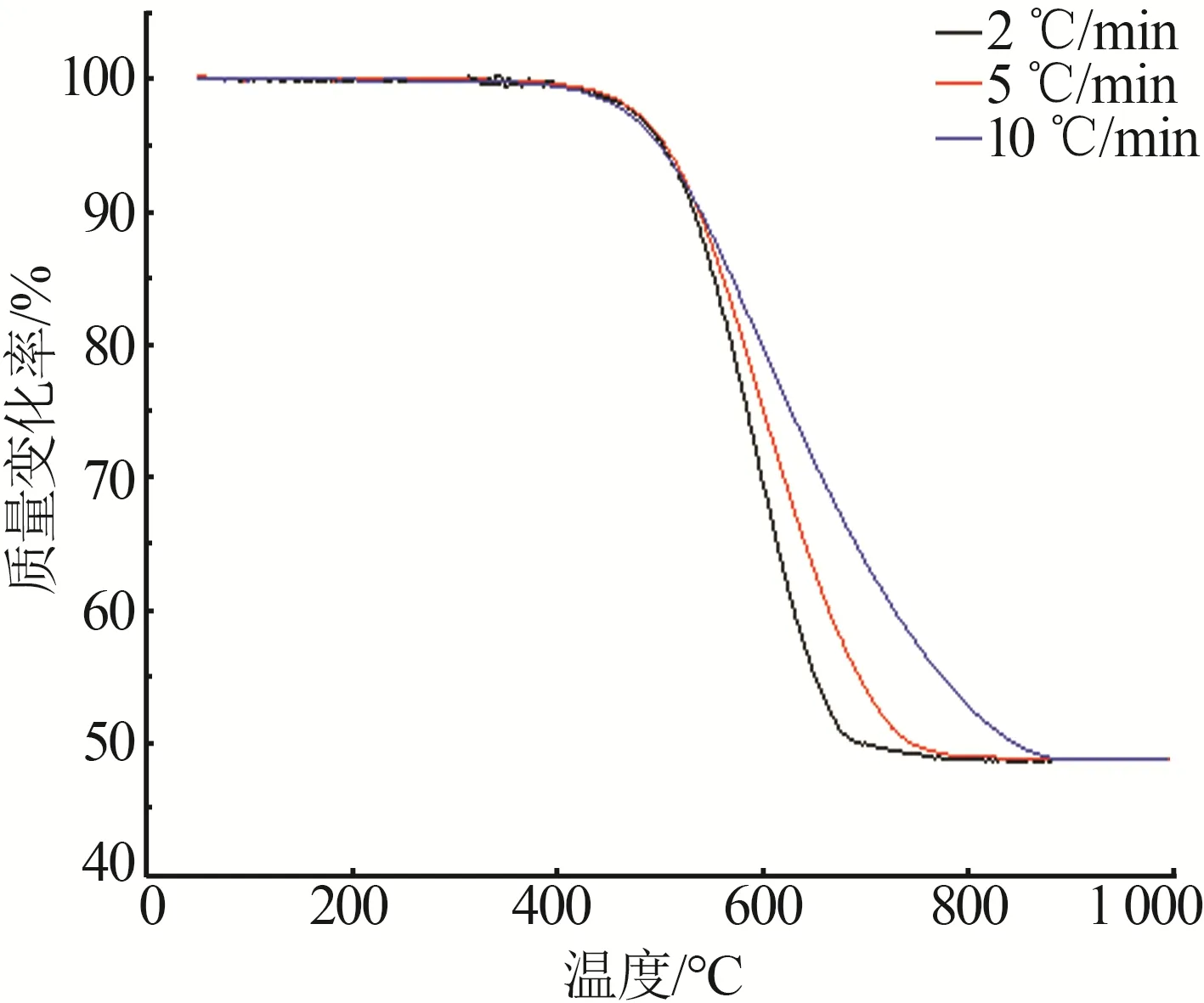
圖3 微晶菱鎂礦在不同升溫速率條件下的TG曲線Fig.3 TG curves of microcrystalline magnesite at different heating rates
微晶菱鎂礦分解的化學方程式如式(2)所示,該反應為吸熱反應。在微晶菱鎂礦實際煅燒過程中,熱量的輸出主要包括3個方面:1)微晶菱鎂礦從室溫開始加熱并分解產生CO2;2)CO2氣體帶走一部分熱量;3)爐內熱量通過爐壁散失。
筆者擬用焓變(ΔH)和比熱容(C)計算理論上微晶菱鎂礦熱分解過程中所需吸收的熱量。對于凝聚態(tài)物質,Cp,m≈Cv,m[J/(mol·K)],整個化學分解過程所需的熱量主要包括:1)微晶菱鎂礦從常溫加熱到分解溫度時本身吸收的熱量;2)微晶菱鎂礦主要成分MgCO3分解生成MgO和CO2過程中的焓變。從無機熱力學數據手冊[10]查到MgCO3、MgO、CO2比熱容分別為C(MgCO3)=77.906+57.739×10-3T-17.405×10-5T-2、C(MgO) =48.982+3.142×10-3T-11.439×10-5T-2、C(CO2)= 44.141 + 9.037 × 10-3T- 8.535 × 10-5T-2,此外MgCO3、MgO、CO2的焓分別為-1 096.21、-601.24、-393.51 kJ/mol。在不同升溫速率條件下(2、5、10 ℃/min),整個微晶菱鎂礦熱分解反應過程所需的熱量(Q2、Q5、Q10)計算如下。
1)當升溫速率為2 ℃/min時,微晶菱鎂礦從25 ℃加熱到分解溫度767 ℃時本身所吸收的熱量為Q1:
微晶菱鎂礦分解過程中的焓變ΔH:
因此,整個過程所需要的熱量:
2)當升溫速率為5 ℃/min時,微晶菱鎂礦從25 ℃加熱到分解溫度862 ℃時本身所吸收的熱量為Q1:
微晶菱鎂礦分解過程中的焓變ΔH:
因此,整個過程所需要的熱量:
3)當升溫速率為10 ℃/min時,微晶菱鎂礦從25 ℃加熱到分解溫度902 ℃時本身所吸收的熱量為Q1:
微晶菱鎂礦分解過程中的焓變ΔH:
因此,整個過程所需要的熱量:
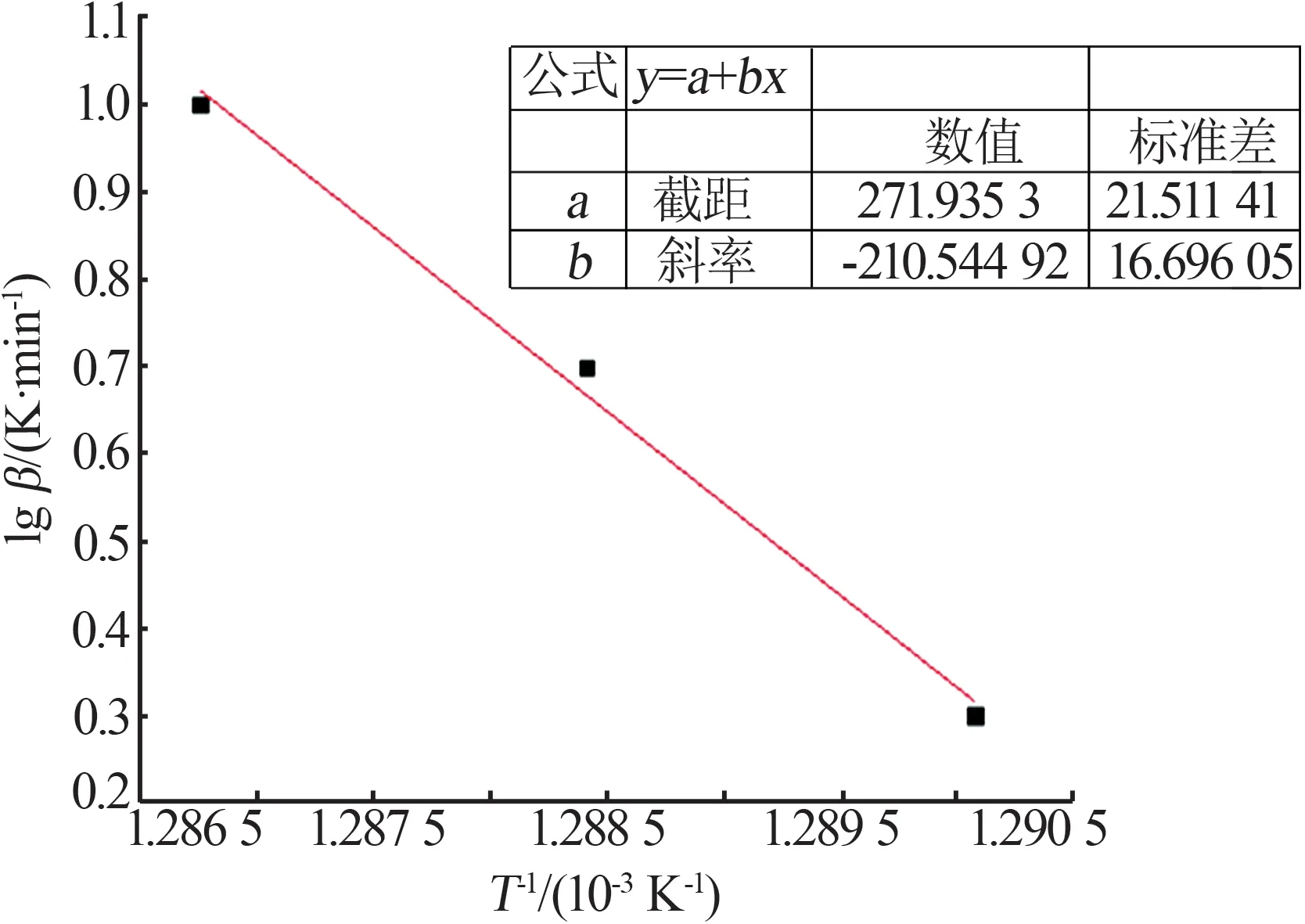
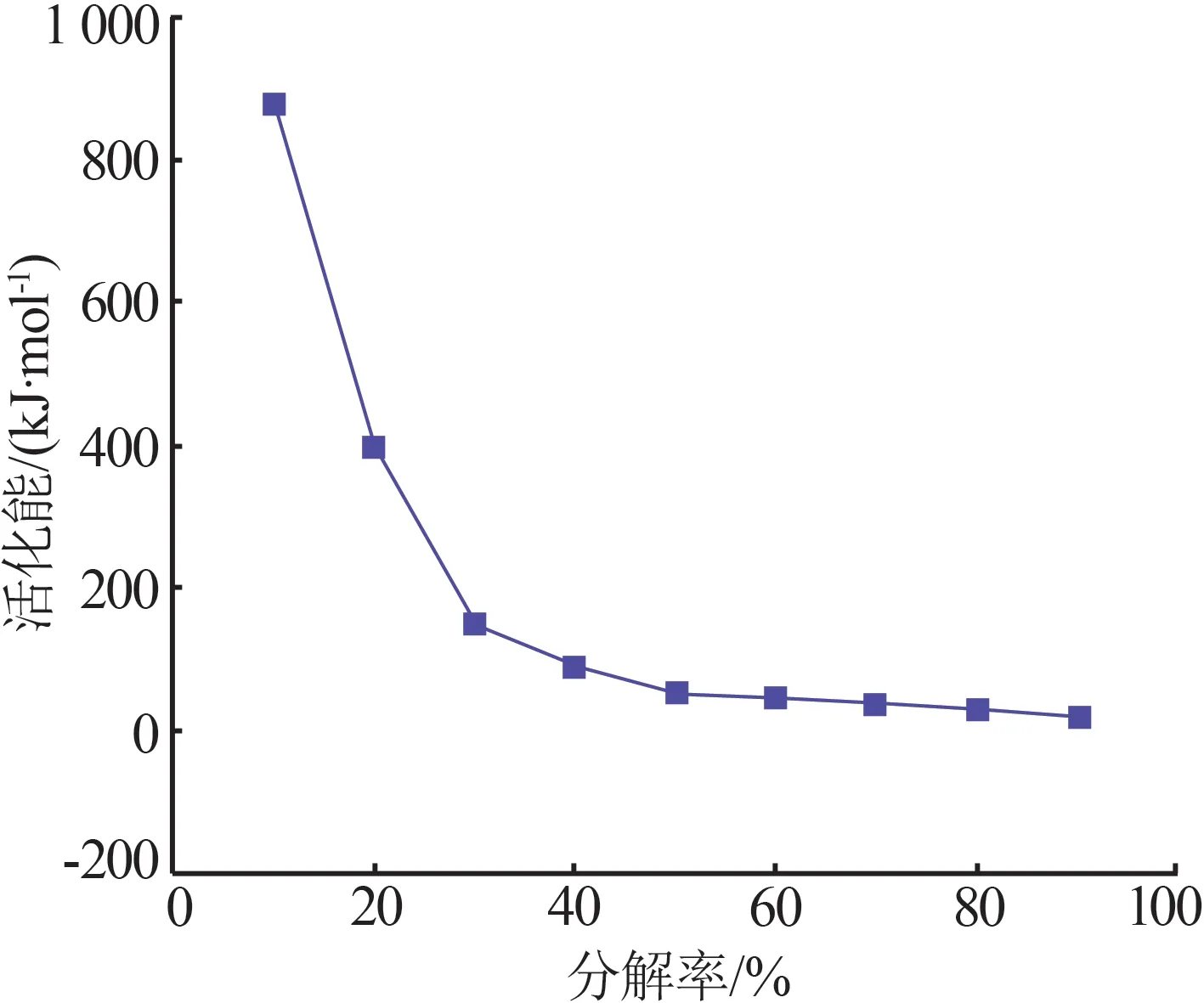
綜上所述,隨著升溫速率的增加,微晶菱鎂礦分解反應過程所需要的熱量Q逐漸增大(Q2 微晶菱鎂礦熱分解速率與很多因素有關,如菱鎂礦礦石表面形態(tài)、溫度及周圍氣氛等。微晶菱鎂礦的分解反應是先在表面快速成核,然后逐步由外向里推進,其分解動力學主要受制于:a)反應表面的反應速率;b)氣體產物通過氧化物產物層向周圍氣氛中的擴散速率;c)熱量通過反應表面的傳導過程。 菱鎂礦熱分解反應動力學參數為礦石工程研發(fā)、生產實踐提供理論依據和指導,其中活化能是微晶菱鎂礦熱分解反應的重要指標。根據非等溫反應動力學理論,在線性升溫條件下菱鎂礦熱分解動力學方程如公式(3)所示[11]。 式中:A為指前因子,min-1;α為反應分解率,%;β為升溫速率,K/min;E為活化能,kJ/mol;T為溫度,K;?(α)為反應機理函數;R為氣體常數,8.314 J/(mol·K)。 在多升溫速率基礎上,用Flynn-Wall-Ozawa(FWO)法[11]對非等溫反應動力學進行解析,由FWO 法可得公式(4): 圖4為微晶菱鎂礦在不同升溫速率條件下的分解率與溫度的關系。從圖4看出S型分解率曲線分為3個反應階段:1)受傳熱因素限制的誘導期(0<α<0.1);2)由化學反應或成核生長控制的快速反應期(0.1<α<0.9);3)受氣體產物分離限制的反應緩慢期(0.9<α<1)。當菱鎂礦分解率α相同時,升溫速率越大,則所需煅燒溫度越高,且分解率越大該趨勢越明顯。可見,圖4結果與熱分解動力學理論公式(4)結果一致。 圖4 不同升溫速率條件下微晶菱鎂礦分解速率與溫度的關系Fig.4 Relationship between decomposition rate and tempera?ture of Tibet microcrystalline magnesite at different heating rates 分析3種不同升溫速率條件下的熱重曲線,當α相同時則G(α)相同,選取分解率的值分別為10%、20%、30%、40%、50%、60%、70%、80%、90%,以lgβ-1 000/T作圖,用最小二乘法進行線性回歸,通過斜率k可進一步求得活化能E(見公式5)。 通過擬合lgβ和1 000/T得到lgβ-1 000/T曲線,依據其斜率獲得各分解率下對應的活化能,以分解率為10%時lgβ-1 000/T曲線為例(見圖5)。圖6為熱分解反應在不同分解率條件下的活化能。由圖6可知,分解率越低(<30%),即溫度為500~600 ℃時,所需活化能較大。為了使微晶菱鎂礦易煅燒且充分分解,可在500~600 ℃進行保溫。 圖5 微晶菱鎂礦熱分解反應動力學曲線(FWO法)Fig.5 Kinetic curve of thermal decomposition reaction of microcrystalline magnesite(the method of FWO) 圖6 微晶菱鎂礦熱分解活化能(FWO法)Fig.6 Activation energy of thermal decomposition of microcrystalline magnesite(the method of FWO) 在多升溫速率的基礎上,用Kissinger-Akahira-Sunose(KAS)法[11]對非等溫反應動力學進行解析,由 KAS法可得公式(6): 分析3種不同升溫速率條件下的熱重曲線,當α相同時則G(α)相同,選取分解率的值分別為10%、20%、30%、40%、50%、60%、70%、80%、90%,以lg(β/T2)-1 000/T作圖,用最小二乘法進行線性回歸,通過斜率k可進一步求得活化能E(見公式7)。 通過擬合 lgβ和1 000/T得到lgβ-1 000/T曲線,依據其斜率獲得各分解率下對應的活化能,以分解率為10%時的lgβ-1 000/T曲線為例(見圖7)。圖8為熱分解反應在不同分解率下的活化能。由圖8可知,分解率越低,即溫度為500~600 ℃時,所需活化能越大。為了使微晶菱鎂礦易煅燒且充分分解,可在500~600 ℃進行保溫。 圖7 微晶菱鎂礦熱分解反應動力學曲線(KAS法)Fig.7 Kinetic curve of thermal decomposition reaction of microcrystalline magnesite(the method of KAS) 圖8 微晶菱鎂礦熱分解活化能(KAS法)Fig.8 Activation energy of thermal decomposition of microcrystalline magnesite(the method of KAS) 綜上所述,無論是用Flynn-Wall-Ozawa(FWO)法還是用Kissinger-Akahira-Sunose (KAS)法計算求得微晶菱鎂礦活化能,其活化能隨著分解率的變化趨勢相近。由圖6和圖8可知,當分解率≤30%時,微晶菱鎂礦活化能隨著分解率的增大急劇下降。而TIAN等[12]通過FWO、KAS和Coats-Redfern法計算得到不同分解率下遼寧海城顯晶菱鎂礦活化能為199.99~206.37 kJ/mol,并不隨分解率的變化而大幅度變化。因此,微晶菱鎂礦的活化能和顯晶質菱鎂礦的活化能差別很大。 圖9為微晶菱鎂礦分解率為90%時的微觀形貌。由圖9可知,升溫速率越大,微晶菱鎂礦分解產物氧化鎂晶粒越大。這是因為,在同一分解率條件下,微晶菱鎂礦分解所需活化能相同[4],當微晶菱鎂礦分解率為90%時,升溫速率越大(依次為2、5、10 ℃/min),對應溫度越高(依次為644、685、762 ℃),微晶菱鎂礦越易被活化分解,晶粒更易長大。 圖9 微晶菱鎂礦在不同升溫速率條件下分解率為90%時的微觀形貌Fig.9 Microstructure of microcrystalline magnesite at different heating rates with conversion rate of 90% 1)微晶菱鎂礦分解熱力學顯示,隨著升溫速率增大,微晶菱鎂礦分解所需的熱量Q逐漸增大。當升溫速率從2 ℃/min逐漸增加到10 ℃/min時,其分解所需的熱量從187.93 kJ/mol逐漸增大到207.08 kJ/mol。 2)非等溫反應動力學(FWO法和KAS法)研究結果表明,隨著升溫速率增大,FWO法和KAS法求得的熱分解活化能與分解率的變化趨勢相近。當分解率≤30%時,熱分解活化能隨著分解率的升高而急劇下降;當分解率>30%時,熱分解活化能隨著分解率的升高而下降緩慢,且逐漸趨于平緩。 3)當微晶菱鎂礦分解率相同時,升溫速率越大所需溫度越高,微晶菱鎂礦越易被活化分解,晶粒越易長大。2.2 微晶菱鎂礦分解動力學




3 結論