宮頸局部IFI16、STAT1蛋白、T-bet蛋白表達與HPV16/18感染轉(zhuǎn)歸相關(guān)性及聯(lián)合檢測價值分析*
潘曉偉,史鵬飛,任海霞,陳何偉,王宏衛(wèi)
石家莊市人民醫(yī)院婦科,河北石家莊 050011
人乳頭瘤病毒(HPV)16/18持續(xù)感染是宮頸癌發(fā)生的重要始動因素之一,故促進HPV16/18感染轉(zhuǎn)陰意義重大[1]。目前臨床處理HPV16/18感染手段包括藥物、高強度聚焦超聲(HIFU)、宮頸環(huán)形電切術(shù)(LEEP)等,但即使是病情相似患者,接受相同治療方法后,HPV16/18感染轉(zhuǎn)歸情況亦不盡相同,提示有其他因素參與了HPV16/18感染轉(zhuǎn)歸情況[2-3]。干擾素誘導(dǎo)蛋白16(IFI16)可選擇性表達于上皮細胞,調(diào)控細胞周期、細胞分化、免疫調(diào)節(jié)等,在宮頸癌組織中IFI16蛋白表達高于癌前病變及健康對照人群[4-5]。信號傳導(dǎo)和轉(zhuǎn)錄激活因子1(STAT1)蛋白在多種癌癥中表達異常,HPV16感染患者STAT1蛋白陽性表達率明顯升高,與宮頸病變進展有關(guān)[6]。T-box基因家族的新型轉(zhuǎn)錄因子T-bet蛋白選擇性表達于Th1細胞、樹突狀細胞、巨噬細胞等,可增加機體抗病毒感染能力[7]。當(dāng)前關(guān)于宮頸局部IFI16、STAT1蛋白、T-bet蛋白相對表達水平與HPV16/18感染轉(zhuǎn)歸相關(guān)性報道較少,本研究對此進行探討,并分析三者聯(lián)合檢測對HPV16/18感染轉(zhuǎn)歸的預(yù)測價值,以期為臨床處理HPV16/18感染提供參考,現(xiàn)報道如下。
1 資料與方法
1.1一般資料 選取2020年5月至2021年12月本院收治的110例HPV16/18感染患者作為研究對象,其中HPV16感染58例,HPV18感染42例,雙重感染10例;宮頸細胞學(xué)診斷報告未見上皮內(nèi)瘤樣病變及惡性細胞(NMIL)32例,意義不明的不典型鱗狀細胞(ASCUS)41例,低度鱗狀上皮內(nèi)病變(LSIL)37例。納入標(biāo)準(zhǔn):(1)HPV16(+)和/或HPV18(+);(2)宮頸細胞學(xué)診斷報告NMIL、ASCUS或LSIL;(3)自愿加入本研究;(4)首次檢出HPV16/18感染。排除標(biāo)準(zhǔn):(1)既往有宮頸癌史;(2)拒絕接受治療;(3)有宮頸、子宮手術(shù)史;(4)伴明顯全身炎癥、感染疾病。本研究經(jīng)倫理委員會審批,患者自愿簽署知情同意書。
1.2治療方法 研究對象均根據(jù)病情并結(jié)合患者意愿給予藥物、HIFU、LEEP治療,治療后6個月采用實時熒光聚合酶鏈反應(yīng)法檢測HPV-DNA(試劑盒購于廣東凱普生物科技有限公司,可檢測14種高危型及6種低危型),HPV16/18感染患者治療前在有感染型號相對的膜芯片位點上可見黑色斑點顯示,治療后轉(zhuǎn)陰患者在對應(yīng)膜芯片位點無黑色斑點顯示。研究對象根據(jù)治療后6個月HPV16/18感染轉(zhuǎn)歸情況分為轉(zhuǎn)陰組(60例)、未轉(zhuǎn)陰組(50例)。
1.3IFI16、STAT1蛋白、T-bet蛋白檢測 采用免疫印跡法檢測IFI16、STAT1蛋白、T-bet蛋白表達,治療前使用專用宮頸刷,以宮頸口為圓心,順時針旋轉(zhuǎn)3圈,加入裂解液,勻漿器勻漿提取總蛋白,離心15 min(4 ℃ 13 000 r/min),分離上清液。制作標(biāo)準(zhǔn)曲線,聚丙烯酰胺凝膠電泳,完成電泳后分割膠條至合適大小,轉(zhuǎn)膜緩沖液平衡,將在凝膠中已經(jīng)分離的條帶轉(zhuǎn)移至硝酸纖維素膜上,50%甲醇脫色至背景清晰,雙蒸水洗。洗膜(3次×5 min),加入一抗,4 ℃放置12 h,棄一抗,洗膜(4次×5 min),加入辣根過氧化物酶偶聯(lián)的二抗,室溫放置2 h,棄二抗,洗膜(4次×5 min)。化學(xué)發(fā)光顯影、定影,用凝膠圖像處理系統(tǒng)分析目標(biāo)帶的分子量,以相對內(nèi)參表達量作為IFI16、STAT1蛋白、T-bet蛋白表達,以上所用試劑均購于大連寶生物科技,各步驟均按試劑盒說明書進行操作。
1.4觀察指標(biāo) (1)兩組一般資料比較。(2)兩組宮頸局部IFI16、STAT1蛋白、T-bet蛋白表達比較。(3)分析HPV16/18感染轉(zhuǎn)歸相關(guān)因素。(4)分析IFI16、STAT1蛋白、T-bet蛋白及聯(lián)合檢測預(yù)測HPV16/18感染轉(zhuǎn)歸價值。(5)IFI16、STAT1蛋白、T-bet蛋白高表達與低表達患者轉(zhuǎn)陰率比較。
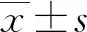
2 結(jié) 果
2.1兩組一般資料比較 兩組年齡、體重指數(shù)、HPV16/18感染情況、宮頸細胞學(xué)診斷、生育史、性伴數(shù)量、文化程度比較,差異無統(tǒng)計學(xué)意義(P>0.05)。未轉(zhuǎn)陰組有陰道炎患者占比多于轉(zhuǎn)陰組,差異有統(tǒng)計學(xué)意義(P<0.05);兩組采用不同治療方法的患者占比比較,差異有統(tǒng)計學(xué)意義(P<0.05);轉(zhuǎn)陰組采取HIFU、LEEP治療方法的患者占比與采取藥物治療方法的患者占比比較,差異有統(tǒng)計學(xué)意義(P<0.05)。見表1。

表1 兩組一般資料比較

續(xù)表1 兩組一般資料比較
2.2兩組宮頸局部IFI16、STAT1蛋白、T-bet蛋白表達 未轉(zhuǎn)陰組IFI16、STAT1蛋白表達高于轉(zhuǎn)陰組,T-bet蛋白表達低于轉(zhuǎn)陰組,差異有統(tǒng)計學(xué)意義(P<0.05)。見表2、圖1。

表2 兩組宮頸局部IFI16、STAT1蛋白、T-bet蛋白表達

圖1 兩組宮頸局部IFI16、STAT1蛋白、T-bet蛋白表達
2.3HPV16/18感染轉(zhuǎn)歸的多因素Logistic回歸分析 將HPV16/18感染轉(zhuǎn)歸情況作為因變量(轉(zhuǎn)陰賦值0,未轉(zhuǎn)陰賦值1),納入陰道炎(無賦值0,有賦值1)、治療方法(藥物賦值1,HIFU或LEEP賦值2)、IFI16、STAT1蛋白、T-bet蛋白(三者均按實際值賦值)相對表達水平作為自變量,結(jié)果顯示,陰道炎、治療方法、IFI16、STAT1蛋白、T-bet蛋白的表達均與HPV16/18感染轉(zhuǎn)歸有關(guān)(P<0.05)。見表3。

表3 HPV16/18感染轉(zhuǎn)歸的多因素Logistic回歸分析
2.4IFI16、STAT1蛋白、T-bet蛋白及聯(lián)合檢測預(yù)測HPV16/18感染轉(zhuǎn)歸的ROC曲線分析 IFI16、STAT1蛋白、T-bet蛋白及聯(lián)合檢測預(yù)測HPV16/18感染未轉(zhuǎn)陰的AUC分別為0.841、0.729、0.835、0.932,IFI16、STAT1蛋白、T-bet蛋白聯(lián)合檢測預(yù)測HPV16/18感染未轉(zhuǎn)陰的AUC最大,三者聯(lián)合檢測的靈敏度為88.00%,特異度為85.00%,見圖2。

圖2 IFI16、STAT1蛋白、T-bet蛋白及聯(lián)合檢測預(yù)測HPV16/18感染未轉(zhuǎn)陰的ROC曲線分析
2.5IFI16、STAT1蛋白、T-bet蛋白高表達與低表達患者轉(zhuǎn)陰率比較 以ROC曲線獲得的IFI16、STAT1蛋白、T-bet蛋白最佳截斷值(0.91、1.31、0.61)作為分界點,將患者分為IFI16、STAT1蛋白、T-bet蛋白高表達與低表達患者,結(jié)果顯示,IFI16、STAT1蛋白高表達患者轉(zhuǎn)陰率低于IFI16、STAT1蛋白低表達患者,T-bet蛋白高表達患者轉(zhuǎn)陰率高于T-bet蛋白低表達患者,差異有統(tǒng)計學(xué)意義(P<0.05)。見表4。

表4 IFI16、STAT1蛋白、T-bet蛋白高表達與低表達患者轉(zhuǎn)陰率比較[n(%)]
3 討 論
本研究針對感染高危HPV16/18型感染進行分析,因其高致病性,所有研究對象在陰道鏡病理排除已存在宮頸病變后均采取了治療干預(yù),包括HIFU、LEEP和藥物治療,以促進HPV16/18感染轉(zhuǎn)陰,結(jié)果表明,轉(zhuǎn)陰組采取HIFU、LEEP治療方法的患者占比與采取藥物治療方法的患者占比比較,差異有統(tǒng)計學(xué)意義(P<0.05),提示HIFU、LEEP治療效果優(yōu)于藥物。
IFI16基因定位于染色體1q23,已被發(fā)現(xiàn)在細胞衰老、凋亡、增殖、炎癥免疫反應(yīng)等中具有重要的作用[8]。本研究結(jié)果顯示,與轉(zhuǎn)陰組比較,未轉(zhuǎn)陰組IFI16蛋白表達明顯升高,是HPV16/18感染轉(zhuǎn)歸相關(guān)影響因素。文獻[9]報道在體外細胞實驗中,HPV E7通過募集IFI16炎性小體,抑制細胞焦亡,促進HPV自我逃避免疫監(jiān)視,表明IFI16高表達不利于HPV清除,本研究結(jié)果與文獻[9]報道結(jié)果有相似之處。一方面IFI16蛋白高表達可觸發(fā)、加重宮頸局部炎性反應(yīng),不利于HPV感染的修復(fù),另一方面IFI16蛋白高表達可通過抑制抑癌基因p53表達,為HPV相關(guān)宮頸病變的進展創(chuàng)造有益局部微環(huán)境。但文獻[10]報道在體外觀察到了IFI16能通過整合先天免疫和表觀遺傳,抑制病毒感染,本研究結(jié)果與文獻[10]報道結(jié)果不同,提示體內(nèi)、體外IFI16作用不同,可能與體內(nèi)IFI16調(diào)控機制更復(fù)雜有關(guān),有待后續(xù)進一步觀察探討。
STAT1蛋白包含6個結(jié)構(gòu)域,功能復(fù)雜,可調(diào)控功能性基因和細胞因子基因的表達[11]。本研究結(jié)果顯示,未轉(zhuǎn)陰組STAT1蛋白高于轉(zhuǎn)陰組,STAT1蛋白表達與HPV16/18感染轉(zhuǎn)歸密切相關(guān)。上調(diào)STAT1蛋白表達,可導(dǎo)致宿主和病毒基因表達發(fā)生變化,造成HPV持續(xù)感染[12]。WU 等[13]報道,STAT1蛋白表達與HPV 16病毒載量呈正相關(guān)。吳思等[14]研究顯示,STAT1蛋白表達隨宮頸病變等級升高逐漸增加,均表明STAT1蛋白表達升高在HPV感染轉(zhuǎn)歸中起到消極作用。STAT1蛋白在HPV16/18感染早期階段升高是機體對HPV16/18感染的一種應(yīng)激性反應(yīng),具有保護作用,但隨著感染時間推進,若HPV16/18未轉(zhuǎn)陰,STAT1蛋白又起到原癌基因作用,參與宮頸癌前病變向癌變的轉(zhuǎn)化[15]。本研究發(fā)現(xiàn),STAT1蛋白高表達患者轉(zhuǎn)陰率低于STAT1蛋白低表達患者,證實STAT1蛋白表達情況會影響HPV16/18感染轉(zhuǎn)歸。
T-bet蛋白可通過調(diào)控輔助性T細胞1與輔助性T細胞2之間的轉(zhuǎn)換,調(diào)節(jié)機體免疫功能[16]。本研究發(fā)現(xiàn),未轉(zhuǎn)陰組T-bet蛋白表達低于轉(zhuǎn)陰組,提示T-bet蛋白與HPV16/18感染轉(zhuǎn)歸有關(guān),后續(xù)的多因素分析亦證實這一結(jié)論。在HPV16感染所致宮頸炎大鼠模型中,宮頸局部T-bet蛋白表達降低,而給予相關(guān)治療后,T-bet蛋白表達升高,HPV16感染轉(zhuǎn)陰[17]。陳雪等[18]報道,HPV陽性患者T-bet蛋白相對表達水平低于HPV陰性患者。本研究結(jié)論與文獻[17-18]報道結(jié)果一致。T-bet蛋白通過啟動輔助性T細胞1遺傳程序在輔助性T細胞1細胞的發(fā)育中起重要作用,并且抑制輔助性T細胞2細胞因子的合成,起到增強免疫功能作用,從而影響HPV16/18感染轉(zhuǎn)歸。T-bet蛋白高表達患者轉(zhuǎn)陰率高于T-bet蛋白低表達患者,說明T-bet蛋白對HPV16/18感染轉(zhuǎn)陰具有促進作用。T-bet蛋白預(yù)測HPV16/18感染未轉(zhuǎn)陰的AUC低于IFI16、STAT1蛋白、T-bet蛋白聯(lián)合檢測的AUC,且三者聯(lián)合檢測的AUC最大,故建議臨床三者聯(lián)合檢測對HPV16/18感染轉(zhuǎn)歸進行預(yù)測。另由于宮頸局部IFI16、STAT1蛋白、T-bet蛋白表達與HPV16/18感染轉(zhuǎn)歸有關(guān),所以HPV16/18感染患者檢測IFI16、STAT1蛋白、T-bet蛋白表達還能為臨床選取合適的治療方式提供參考,例如檢測IFI16、STAT1蛋白、T-bet蛋白表達結(jié)果發(fā)現(xiàn),患者轉(zhuǎn)陰可能性較小,則建議患者接受HIFU或LEEP進行治療;若檢測IFI16、STAT1蛋白、T-bet蛋白結(jié)果發(fā)現(xiàn),患者轉(zhuǎn)陰可能性較大,若患者自身猶豫不決或經(jīng)濟能力有限,可先選取藥物進行治療,后續(xù)加強隨訪,再決定下一步的干預(yù)方法,使患者受益最大化。
綜上所述,宮頸局部IFI16、STAT1蛋白、T-bet蛋白表達與HPV16/18感染轉(zhuǎn)歸有關(guān),三者聯(lián)合檢測可作為預(yù)測HPV16/18感染轉(zhuǎn)歸的一個可靠方案,在保證轉(zhuǎn)陰率的同時,又避免過度治療增加患者負擔(dān)。

