斑籽木乙酸乙酯萃取部位的體內外抗炎作用及機制
楊銳,盧光衣,張倩茹,陳帥,何紅平,蔣華夷
云南中醫藥大學中藥學院 云南省南藥可持續利用重點實驗室,昆明 650500
斑籽木別名斑籽,為大戟科斑籽木屬灌木,產于我國云南西南部,在亞洲南部和東南部各國亦有分布[1]。斑籽木全株均可入藥,具有清熱解毒、消腫止痛、瀉下利尿等功效,常用于治療支氣管炎、哮喘、水腫、黃疸、麻風病和皮膚病等[2]。研究表明,斑籽木提取物具有抗腫瘤、抗過敏、抗菌、抗氧化、保肝、免疫調節等多種藥理活性,而關于其化學成分的研究報道較少,已分離鑒定的化學成分主要涉及二萜、苯丙素、生物堿等結構類型[2-6]。為進一步明確斑籽木活性部位及其物質基礎,2021 年8 月—2022 年1 月本研究以斑籽木地上部分為研究對象,采用角叉菜膠致小鼠足跖腫脹模型,初步評價其90%乙醇提取物乙酸乙酯萃取部位(BSEA)的抗炎活性,并對BSEA 體外抗炎活性進行評價;同時,通過分子對接技術初步探討活性成分可能的抗炎作用機制,為斑籽木在抗炎方面的應用提供理論依據。
1 材料與方法
1.1 材料 斑籽木地上部分于2019 年3 月采自云南省西雙版納州,經云南中醫藥大學張雪梅鑒定為大戟科斑籽木Baliospermum solanifolium (Burman) Suresh,標本(BS-201903001)保存于云南省傣醫藥與彝醫藥重點實驗室;角叉菜膠(美國Sigma 公司);阿司匹林、羧甲基纖維素鈉(北京索萊寶科技有限公司)。雌性ICR 小鼠[SPF 級,體質量(20 ± 2)g,斯貝福(北京)生物技術有限公司,生產許可證號:SCXK(京)2019-0010],適應性飼養4 d,環境溫度為(22 ± 2)oC,濕度為40%~60%,每日光照約12 h,自由飲食和攝水。小鼠單核巨噬細胞RAW264.7(中科院上海細胞庫);DMEM 培養基和胎牛血清(以色列Biological Industries 公司);Griess 試劑、LPS 及陽性對照藥物L-NMMA 均購自日本Sigma 公司;一氧化氮(NO)檢測試劑盒(碧云天生物技術有限公司);GF254型薄層層析硅膠板(青島海洋化工廠);柱色譜硅膠(80~100、100~200 目,青島海洋化工廠);RP-C18柱色譜填料(美國EMD Millipore 公司);MCI(CHP20P,75~150 μm,日本三菱化學公司);Sephadex LH-20葡聚糖凝膠(美國GE Healthcare公司);色譜純乙腈和甲醇(上海星可高純溶劑有限公司);工業乙醇、石油醚、乙酸乙酯、丙酮、甲醇(上海泰坦化學有限公司)經重蒸后使用。NX-1R離心機(天津鼎昊源生物科技有限公司);Varioskan FLASH 多功能酶標儀(美國Thermo 公司);MX-S 旋渦混勻儀(北京大龍興創實驗儀器股份公司);Caliper3 數顯卡尺(東莞三量具有限公司);Centrifuge 5804R 型冷凍離心機(德國Eppendorf 公司);Synergy2 型多功能酶標儀(美國Biotek 公司);Bruker AV-500 型核磁共振儀(德國Bruker 公司);Hei-VAP Core HL/G3 旋轉蒸發儀(德國Heidolph 公司);Agilent 1260 型高效液相色譜儀(美國Agilent公司),色譜柱為XDB-C18(9.4 mm×250 mm,5 μm,美國Agilent公司)。
1.2 BSEA體內抗炎作用觀察方法
1.2.1 BSEA的制備 取干燥斑籽木地上部分20 kg適當粉碎,用90%乙醇/水浸漬提取4 次,每次3 d。合并濾液,減壓濃縮至無醇味后將浸膏分散于水中,用石油醚于室溫下萃取3次。水相隨后用乙酸乙酯萃取4次,萃取液經減壓濃縮后得到浸膏800 g。
1.2.2 動物分組、藥物干預及模型制備 參照文獻[7-8]方法,將48只雌性小鼠,隨機分為正常對照組、模型組、陽性對照組及BSEA 高、中、低劑量組。陽性對照組給予阿司匹林400 mg/kg 灌胃,BSEA 高、中、低劑量組分別給予176、88、44 mg/kg 浸膏灌胃,均以1 mL/100 g連續灌胃5 d,每天1次;模型組給予等體積0.5%羧甲基纖維素鈉溶液灌胃。給藥劑量根據人給藥劑量換算并結合預實驗結果確定。除正常對照組外,其他各組均在末次給藥1 h 后,于小鼠左后足跖皮下注射1%角叉菜膠水溶液25 μL 致炎。采用游標卡尺法測定致炎后5 h 小鼠的左后足足跖厚度,并分別按下式計算足跖腫脹度和腫脹抑制率。

1.3 BSEA體外抗炎作用觀察方法
1.3.1 斑籽木BSEA 化學成分的分離 斑籽木BSEA 經正相硅膠(3.5 kg,80~100目)柱色譜分離,以石油醚-丙酮(1∶0~0∶1)梯度洗脫,薄層色譜法監測,合并相同組分,得到7 個部分Fr.A~G。Fr.C(69.1 g)經硅膠柱層析(691 g,100~200目,石油醚-丙酮1∶0~0∶1 梯度洗脫)分為7 個組分Fr. C1~C7。Fr.C1經半制備HPLC(51%乙腈-水,3 mL/min)得到化合物1(6.3 mg,tR=24.7 min)。Fr. D(30.4 g)經MCI柱層析,以90%甲醇-水洗脫,得到4 個組分Fr.D1~D4。Fr.D1(13.2 g)經硅膠柱色譜(400 g,100~200 目,石油醚-丙酮50∶1~1∶1 梯度洗脫)分為8 個組分Fr.D1-1~D1-8。Fr.D1-8經半制備HPLC(15%乙腈-水,3 mL/min)得到化合物4(8.7 mg,tR=7.6 min)。Fr.E(32.9 g)經MCI 柱色譜(40%~100%甲醇-水梯度洗脫)得到3 個組分Fr. E1~E3。Fr.E2 經中壓RP-18 柱層析,以40%~100%甲醇-水梯度洗脫,得到8個組分Fr.E2-1~E2-8。Fr.E2-4經硅膠柱層析(80 g,80~100 目,石油醚-乙酸乙酯20∶1等度洗脫)得到化合物2(129.8 mg)。Fr. E3 經硅膠柱層析(120 g,80~100目,石油醚-乙酸乙酯30∶1~2∶1 梯度洗脫)分為9 個組分Fr. E3-1~E3-9。Fr.E3-5 經半制備HPLC(82%乙腈-水,3 mL/min)得到化合物3(7.4 mg,tR=29.6 min)。
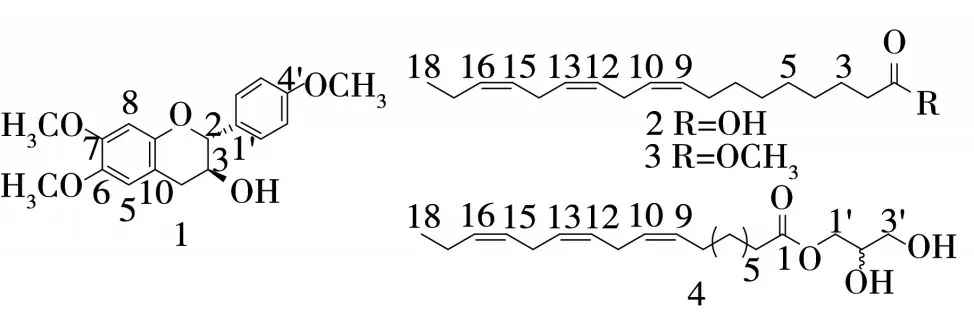
圖1 化合物1~4的結構
1.3.2 單體化合物的體外抗炎活性檢測 將RAW264.7 巨噬細胞接種至96 孔板,用1 μg/mL LPS 進行誘導刺激,同時加入待測化合物處理(終濃度從50 μmol/L 開始2 倍稀釋),設置空白對照組(不含藥物)和NG-甲基-L-精氨酸乙酸鹽(L-NMMA)陽性對照組。細胞過夜培養后取培養基檢測NO 生成,在570 nm 處測定吸光值(OD)。采用MTS 法在剩余培養基中進行細胞存活率檢測,以排除化合物對細胞的毒性影響[9]。半數抑制濃度(IC50)值按Reed&Muench法計算[10]。

1.4 BSEA體外抗炎作用機制分析 利用PubChem數據庫(https://pubchem.ncbi.nlm.nih.gov/),獲得化合物2的sdf格式文件。根據文獻[11-13],選取5個與抗炎活性密切相關的誘導型一氧化氮合酶(iNOS)、過氧化物酶體增殖物激活受體α(PPARα)、核轉錄因子-κB(NF-κB)、白細胞介素-1β(IL-1β)和腫瘤壞死因子-α(TNF-α)組成靶點數據庫。通過RCSB PDB 數據庫(https://www.rcsb.org/)搜索以上靶點對應的蛋白,下載相應蛋白的pdb 格式文件。用CB-Dock2(https://cadd. labshare. cn/cb-dock2/php/index.php)自動計算結合位置和box的范圍,然后基于AutoDock Vina執行分子對接[14-15]。
1.5 統計學方法 采用SPSS25.0 統計軟件。符合正態分布的計量資料以±s表示,兩組比較采用t檢驗,三組及以上比較采用單因素方差分析,進一步兩兩比較采用LSD 法檢驗。P<0.05 為差異有統計學意義。
2 結果
2.1 BSEA 的體內抗炎作用 連續灌胃給藥5 d,小鼠未出現異常,表明受試樣品在實驗所設定的劑量條件下對小鼠的正常生命活動無影響。模型組、陽性對照組及BSEA 高、中、低劑量組致炎5 h 足腫脹度 分 別 為(29.52 ± 3.14)%、(16.07 ± 1.61)%、(19.02 ± 3.63)%、(21.48 ± 2.45)%、(25.33 ± 4.93)%。與模型組比較,陽性對照組、BSEA 高劑量組、BSEA 中劑量組足腫脹度低(P均<0.05);與陽性對照組比較,BSEA 中、低劑量組足腫脹度高(P均<0.05),而高劑量組足腫脹度與陽性對照組比較差異無統計學意義(P>0.05)。陽性對照組及BSEA 高、中、低劑量組腫脹抑制率分別為45.56%、35.57%、27.24%、14.19%。
2.2 BSEA 的體外抗炎作用 從斑籽木BSEA 中分離得到4 個化合物,分別鑒定為2,3-反式-6,7,4′-三甲氧基黃烷醇(1)[16]、α-亞麻酸(2)[17]、亞麻酸甲酯(3)[18]、甘油亞麻酸酯(4)[19]。化合物2 在50 μmol/L 濃度下對細胞生長無影響,細胞存活率>90%。進一步對化合物2 進行NO 生成抑制活性評價,結果顯示化合物2 在50 μmol/L 濃度下的NO 生成抑制率為(82.52 ± 0.54)%,IC50值為(22.79 ± 1.48)μmol/L,其抑制活性優于陽性對照藥L-NMMA[NO 生成抑制率為(57.42 ± 1.41)%,IC50值為(33.74 ± 2.13)μmol/L]。
2.3 BSEA 的作用機制 分子對接結果顯示,化合物2 與iNOS、PPARα、NF-κB、IL-1β 和TNF-α 的結合能分別為-7.3、-6.7、-6.4、-6.2、-5.9 kCal/mol,提示其可能通過以上5 個靶標發揮抗炎作用。化合物2 的C-1 位羰基氧與iNOS 的Tyr-483 氨基酸殘基形成氫鍵作用,18-CH3與Tyr-485 殘基形成π-σ 作用,與Met-349、Leu-119 殘基形成Alkyl-Alkyl 作用,與Phe-482 殘基形成π-Alkyl 作用;C-1 位羥基與PPARα 的His-274 殘基形成氫鍵作用,18-CH3與Cys-275、Ile-272、Val-332、Ile-339 殘基形成Alkyl-Alkyl作用;C-1位羰基氧與NF-κB 的Ser-164、Gly-163、Gly-165、Lys-166 殘基形成氫鍵作用,C-1 位羧基H與Thr-167 殘基形成氫鍵作用,18-CH3與Arg-204 殘基形成Alkyl-Alkyl作用;C-1位羧基H和羰基氧分別與IL-1β 的Asn-129、Tyr-127 殘基形成氫鍵作用,18-CH3與Pro-28 殘基形成Alkyl-Alkyl 作用;C-1 位羧基H 和羰基氧分別與TNF-α 的Gln-125、Arg-82殘基形成氫鍵作用,18-CH3與Tyr-87 殘基形成Alkyl-Alkyl作用。見表1。

表1 化合物2的分子對接結果
3 討論
炎癥是機體受到內外侵害或感染后所發生的一種防御反應,具體表現為紅、腫、熱、痛甚至功能障礙[20]。通常情況下,炎癥可以激活免疫系統,抵抗多種刺激,從而保護機體免受傷害或感染。但過度、長期的炎癥反應可能會導致細胞損傷或代謝紊亂,進而引發一系列疾病,包括動脈粥樣硬化、糖尿病、心肌梗塞、癌癥以及神經退行性疾病等[21]。在炎癥反應的發生和消退過程中,通常需要多種細胞和細胞因子等的參與,它們往往相互協同或拮抗,共同影響機體的免疫應答和炎癥反應[22]。
NO具有廣泛而重要的生物學調控功能,在炎癥的發生、發展過程中起著重要作用。當免疫細胞遭受炎癥介質或微生物內毒素等的刺激時,會產生大量iNOS,iNOS 通過催化L-精氨酸生成NO 進行免疫應答。因此抑制NO 生成是檢測抗炎活性的直接指標。LPS 是革蘭陰性菌細胞壁的主要組成成分,可誘導巨噬細胞釋放炎癥因子,從而引發炎癥反應。將小鼠巨噬細胞RAW264.7 用LPS 誘導iNOS 的生成,同時加入待測樣品處理,通過Griess 法測定培養基在570 nm 波長下的吸光值可檢測亞硝酸鹽[23]。因此,可通過測定樣品對LPS 誘導的小鼠RAW264.7巨噬細胞內NO生成的抑制作用,評價其抗炎活性。
分子對接技術屬于計算機輔助藥物設計的重要組成部分,是將配體小分子放入受體活性口袋中,通過變化小分子配體的空間構象,按照幾何、能量及化學環境互補的原則來評價配體與受體相互作用的強弱,從而預測其結合模式和親和力的方法。近年來,分子對接技術在活性成分篩選和作用機制研究等方面有著廣泛應用[24]。中國科學院昆明動物研究所黃京飛課題組利用分子對接技術,從21 940 個小分子化合物中獲得了2 355 個候選抗中風藥物,包括1 564個單一靶向藥物和791個多靶點藥物,并解釋了多種抗中風植物潛在的作用機制,為抗中風藥物的研發奠定了基礎[25]。
本研究采用角叉菜膠致小鼠足跖腫脹模型,考察斑籽木BSEA 的體內抗炎作用。結果顯示,與模型組相比,BSEA 高、中劑量組均能顯著抑制角叉菜膠所致小鼠足跖腫脹。同時,腫脹抑制率也表明各給藥組對小鼠的足腫脹有較好的改善作用。采用多種色譜方法從BSEA中分離鑒定了4個化合物,均為首次從斑籽木屬植物中分離得到,進一步加深了對斑籽木化學成分的認識。通過抗炎活性評價發現其中含量較大的化合物2具有潛在的抗炎活性。采用基于AutoDock Vina 的CB-Dock2 平臺對化合物2 進行分子對接,結果表明其與炎癥相關靶標iNOS、PPARα、NF-κB、IL-1β 和TNF-α 具有較好的親和力,其中與iNOS 蛋白結合最好,該結果提示化合物2 的抗炎作用可能與以上5 個靶點相關,后續可針對該靶點進行其抗炎作用機制的研究。
本研究為斑籽木在抗炎方面的相關應用提供了一定的科學依據,并為進一步研究斑籽木抗炎藥效物質基礎及其作用機制提供了依據。

