晚期癌癥患者常規治療聯合免疫治療的衛生經濟學評價
曹 磊 張偉娜 朱蔚友*
(1 江蘇省宿遷市第一人民醫院腫瘤科,江蘇 宿遷 223800;2 江蘇省人民醫院腫瘤內科,江蘇 南京 210029)
免疫檢查點是一組介導免疫調節的重要分子,作為抑制性分子控制T細胞應答。免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs),如PD-1、PD-L1、CTLA-4,在多種腫瘤的治療中顯出了顯著的療效[1],在臨床上被簡稱為“免疫治療”。針對晚期癌癥患者的治療中,多藥聯合具有協同效應,因此“免疫治療+”的模式也備受重視、不斷探索。2018年是中國免疫治療元年,國內醫療機構先后開展免疫治療,尤其是在晚期復發轉移性癌癥病人群中[2];作為比較新穎的治療,其療效與安全性值得關注,而經濟成本與效益等衛生經濟學評價[3]相關問題常被忽視。本研究目的在于研究分析“免疫治療+”策略對晚期癌癥患者的臨床獲益及衛生經濟學評價,包括長期結局與經濟負擔。
1 資料與方法
1.1 一般資料 納入2019年1月至2020年12月,在我科就診的復發、轉移性晚期癌癥患者,接受免疫檢查點抑制劑治療,并且聯合化療、放療或抗血管生成治療,對相關資料進行回顧性分析。共納入36例患者,治療前:ECOG評分為0~2分,血常規、肝腎功能、心電圖、甲狀腺功能無明顯異常,患者住院的報銷方式為職工醫保、居民醫保。排除申請經濟救助、大病報銷比例較高的貧困戶、同時具有商業醫保、單藥免疫治療的患者。根據AJCC第8版對患者進行組織學分類及TNM分期。
患者的臨床資料完整,在知情同意書上簽字,所有調查對象的臨床資料遞交倫理委員會審核并獲得批準。
1.2 聯合免疫治療策略的臨床應用與隨訪管理 經主治醫師的推薦,選擇不同的免疫檢查點抑制劑,具體為信迪利單抗[4]200 mg ivgtt d1 q3w,卡瑞利珠單抗[5]200 mg ivgtt d1 q3w,特瑞普利單抗[6]240 mg ivgtt d1 q3w,替雷利珠單抗[7]200 mg ivgtt d1 q3w,帕博利珠單抗[8]200 mg ivgtt d1 q3w,度伐利尤單抗[9]1 200 mg ivgtt d1 q3w。聯合化療、放療、抗血管生成治療的方案,因不同疾病而進行個體化選擇。每3周治療一周期,每6~8周進行一次療效評估。復查頻率為每2個月一次胸腹部CT檢查,按照RECIST1.1標準進行療效評估。如果基線評估時頭顱MR結果為陰性,治療期間患者無顱內癥狀,在評估時不常規行該檢查。緩解率是完全緩解率與部分緩解率之和。疾病控制例數為完全緩解、部分緩解與病情穩定例數之和。PFS為從免疫檢查點抑制劑開始治療至疾病進展(PD)或死亡日期,或生存患者的末次隨訪日期和無進展的日期。總生存期(OS)為自開始使用免疫檢查點抑制劑至因任何原因死亡的日期或至生存患者的末次隨訪日期。如果考慮PD時,可計劃行更全面的影像學檢查,包括PET-CT。由主治醫師判斷治療的相關不良反應,參照CTC AE5.0標準、CSCO免疫檢查點抑制劑相關的毒性管理指南,酌情減量或停藥。末次隨訪日期為2021年12月31日。
1.3 統計分析 描述性統計報告為分類變量的頻率和百分比,連續變量的中位數等。收集的數據包括年齡、性別、瘤種、組織學類型、免疫檢查點抑制劑、不良反應、無病生存期,隨訪信息直至死亡或2021年12月31日。采用Kaplan-Meier法估計生存曲線,當P<0.05時,認為其具有統計學顯著性;Pearson相關性分析費用、周期數與生存的相關性,以及不同生存期患者的平均費用、年平均遞增費用。所有統計分析均采用SPSS26.0軟件進行。
2 結果
2.1 患者臨床特征 本研究納入36例患者為對象。患者中位年齡為64歲(48~82歲);19例(52.7%)男性,17例(47.3%)女性;非小細胞肺癌6例,小細胞肺癌2例,鼻咽癌2例,膽管癌1例,惡性黑色素癌2例,肝癌1例,宮頸癌1例,淋巴瘤1例、腎盂癌1例、腎癌4例、食管癌10例、胃癌2例、胰腺癌2例、縱膈鱗癌1例;治療方案:ICIs+化療20例,ICIs+抗血管生成10例,ICIs+化放療5例,ICIs+化療+手術1例;ICIs初始治療Line:一線13例,二線16例,多線(三線及之后)7例;ICIs總費用:<5萬元10例,5~10萬元12例,10~15萬元4例,>15萬元10例;ICIs來源:國產34例,進口2例;ICIs分類:PD-1單抗35例,PD-L1單抗1例。患者的臨床特征見表1。

表1 患者的臨床特征
2.2 療效評估及不良事件
2.2.1 療效評估 臨床完全緩解(cCR)和部分緩解(PR)分別為5(13.9%)和7(19.4%)例,13例(36.1%)患者疾病穩定(SD),11例(30.6%)出現疾病進展(PD)。客觀緩解率為33.3%,疾病控制率為69.4%。其中獲得cCR的5例患者分別為腎盂癌術后多發淋巴結與骨轉移、食管鱗癌伴多發肺與淋巴結轉移、鼻咽癌放療后縱膈淋巴結轉移、膽管腺癌伴骨與多發淋巴結轉移、Ⅳ期彌漫大B細胞淋巴瘤。見表2。

表2 臨床完全緩解病例特征
2.2.2 免疫治療相關不良事件 12例疾病進展患者、3例cCR均未觀察到明顯的免疫治療相關不良反應。10例(3.2%)出現甲狀腺功能減退,予以補充甲狀腺素。9例出現皮膚毛細血管增生,經間斷口服阿帕替尼后好轉,未影響后續用藥。有2例同時出現甲狀腺功能減退與毛細血管增生。未觀察到免疫性心肌炎、肝炎等嚴重并發癥。
2.3 生存結局與費用 中位隨訪時間為15個月(4~34個月)。自開始接受免疫檢查點抑制劑治療,所有患者的中位PFS、OS分別為9、15個月,一線、二線及多線治療相比,P>0.05,無顯著統計學差異,但一線與后線治療的OS曲線呈明顯分離趨勢。多變量分析結果顯示,性別、聯合治療的方案對生存結局均無顯著性影響,P>0.05。患者的平均費用約為10.1萬元,費用最高超過20萬元,最低費用約0.6萬元。不同的醫療費用之間比較(P<0.001),提示免疫治療的直接成本越高,PFS、OS越長(圖1)。使用免疫檢查點抑制劑的周期數越高,患者的費用也相應增加,分析該周期數與PFS、OS的相關性,兩組數據的散點圖(圖2)基本呈線性關系,Pearson相關性分析結果:相關系數分別為:0.852、0.791,sig值均小于0.01。
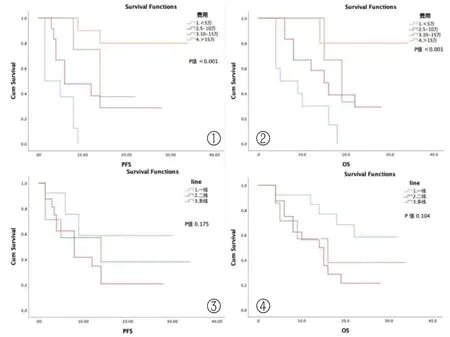
圖1 免疫治療的直接成本與PFS、OS的關系(圖①與圖②為不同費用的PFS、OS,圖③與圖④為不同治療Line的PFS、OS)
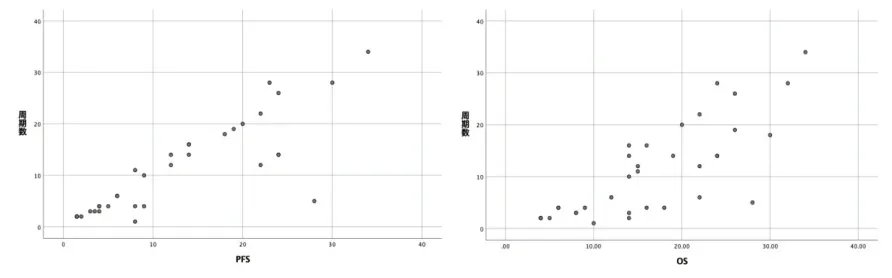
圖2 周期數與PFS、OS數據的散點圖
2.4 后續管理及成本效果分析 隨訪期間,有5例患者獲得臨床完全緩解,其中1例持續維持ICIs治療,其余4例均已停止治療。5例PR患者、3例SD患者獲得長期生存,且均在接受ICIs維持治療,2例PD患者在進展后換后線治療,至隨訪結束時仍為生存狀態。后續管理及生存情況的相關數據匯總于表3。至隨訪結束,cCR、PR、SD、PD患者使用ICIs治療的平均費用分別為14.6萬(8~25)、15.1萬(0.6~28)、10.6萬(2.8~20)、4.4萬(1.2~8),中位PFS分別為28個月(22~34)、20個月(8~24)、9個月(5~24)、2個月(1.5~4),PR、SD、PD患者的中位OS分別為22個月(10~30)、16個月(9~26)、6個月(4~14)。見表4。<1年OS、1~2年OS、>2年OS患者使用ICIs治療的平均費用分別為4.25萬、11.25萬、16.2萬,平均費用依次遞增7萬元、4.95萬元。
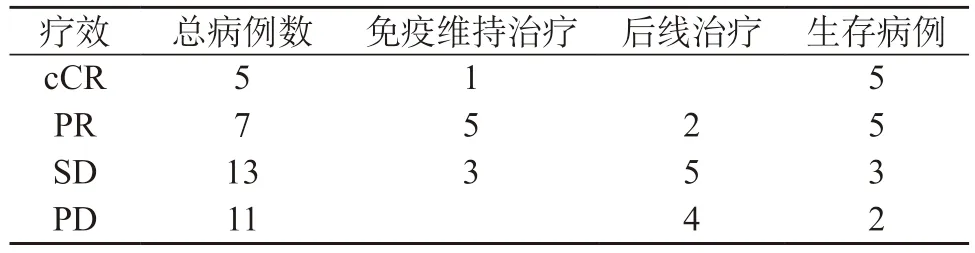
表3 后續治療管理與生存(n)

表4 ICIs的成本及效果
3 討論
免疫治療在抗腫瘤治療的歷史進程中,其主要策略是加強免疫反應,比如癌癥疫苗、過繼性免疫治療等;而免疫檢測點抑制劑的原理是阻斷免疫激活負性共刺激信號,如PD-1/PDL-1、CTLA-4、Tim-3和LAG-3等分子,特異性阻斷這些抑制信號,促進腫瘤特異性CD8+T細胞的活化、增殖與細胞因子的分泌[10],使效應細胞恢復原來的生物學功能,及時清除腫瘤細胞。晚期多發或廣泛轉移性實體瘤患者,放化療的療效已達瓶頸,為提高患者生存而選擇新藥,但新藥通常較為昂貴,所以患者的經濟水平與支付意愿是現實治療中的難點。
靶向PD-1/PD-L1的免疫檢查點單抗在許多類型腫瘤的治療中顯示出令人鼓舞的療效。越來越多的臨床研究顯示聯合治療具有更好的臨床結局[8,11]。但與放療、化療、分子靶向藥物、手術等如何聯合、優化,尤其是在晚期癌癥患者中,仍然沒有定論,在不同的治療領域、相同瘤種不同分期的疾病,以及最佳治療周期等,均是有待進一步研究。臨床試驗中PD-1/PD-L1抑制劑的劑量多為固定劑量、使用至疾病進展。某研究中[12],經治患者使用納武利尤單抗96周療程,75%存活5年以上患者之后未接受過其他治療,且5年時疾病仍未進展。研究顯示[13]:與1年治療相比,連續使用納武利尤單抗可帶來更好的生存獲益,安全性可控。該研究是一項基于社區人群的非小細胞肺癌臨床研究,更接近于真實世界數據,可為臨床醫師制訂方案提供參考。本研究的方案借鑒已發布的臨床研究、NCCN/CSCO指南等,其中一線13例、二線16例、7例為多線治療;與ICIs聯合的方案因病而異,ICIs聯合化療20例,ICIs聯合抗血管生成治療10例,ICIs聯合化放療5例,有1例為ICIs聯合化療及局部手術;與既往的報道類似[14],本文的客觀緩解率為33.3%,疾病控制率為69.4%,5例獲得cCR,其特點為淋巴結轉移相對較多,內臟轉移較少,無腦轉移病例;5例PR、3例SD患者為帶瘤生存,在接受ICIs治療后出現長期、持久的反應,呈慢病狀態;其中,一線聯合免疫治療與二線及多線相比,結果無顯著統計學差異,原因可能是本文病例數較少,但生存分析顯示出延長PFS的趨勢,提示早期接受治療,機體對治療的反應更好、耐受性更佳。整體而言,免疫治療相關的不良反應以甲減最為多見,定期監測甲狀腺功能,適時給予藥物對癥治療;毛細血管增生為卡瑞利珠單抗的特殊不良反應,口服阿帕替尼可拮抗該并發癥;二者均未見影響后續用藥,安全性可控。
新藥研發過程中受惠的是入組志愿患者,發達國家有15%以上的癌癥患者參與各類型臨床研究,而我國則不到3%[15]。新藥上市后現實世界患者面臨的問題不僅僅是數據解讀、指南推薦,更重要的是該抉擇的經濟效益比。衛生經濟學評價從成本和效果兩個方面,對既定方案進行比較、分析。直接醫療成本包括直接醫療費用、非醫療費用,間接成本是指因病導致的社會資源損失。本文僅討論分析最為直觀的自費藥物總數目,即患者自接受方案起承擔的ICIs費用。投入成本的結果可用效果、效益等評價。本文中獲得有效疾病控制的患者平均ICIs治療費用超過10萬元,獲得客觀緩解的患者平均ICIs治療費用約為15萬元,其中有1例肺癌肉瘤患者僅使用一個周期的ICIs聯合化療,獲得長達8個月的PFS,后因經濟原因拒絕繼續治療。1年OS、1~2年OS、>2年OS患者使用ICIs治療的平均費用,隨著生存時間的延長,平均費用依次遞增7萬元、4.95萬元,增幅下降與藥物的慈善贈藥政策有關。共有超過30%的患者愿意支付10萬元以上,來延長生存、改善生活質量,但也增加部分患者的經濟負擔,不能代表整體患者的支付意愿。“以患者為中心,以臨床價值為導向”是醫藥研發遵循的基本原則[15],藥物是為人而生產,不是為追求利潤而制造,但實踐中企業成本回收、患者經濟支出是個難以平衡的博弈。在國家大力支持基本醫療保險、醫保納入新藥速度加快的前提下,可在一定程度上緩解該壓力。關注疾病對患者的身心影響,尤其是對治療的預期以及治療所帶來的經濟負擔,提高依從性,使療效最大化并降低衛生資源損耗。
以免疫治療為核心的基礎上聯合抗血管生成治療、化療、放療、手術或介入治療等方式已被臨床接受,而圍繞免疫治療的衛生經濟學評價,需要醫院、公共衛生保健等部門從經濟學的角度充分考慮最佳資源配置。但如何精準聯合,最大限度地提高療效、降低不良反應以及兼顧經濟效益與醫療價值,需進一步研究。

