PKMYT1在乳腺癌中表達的生物信息學分析及實驗用細胞系篩選
安彥榕 賈永峰
乳腺癌(breast cancer,BC)是一種在臨床特征和分子特征上均具有異質性的惡性腫瘤,仍是全球女性中最普遍的疾病且是和腫瘤相關死亡最主要的原因。全球每年新發病例近170萬,死亡人數超過52萬[1,2]。乳腺癌是癌癥導致死亡的第二大原因,約占女性診斷腫瘤的30%[2,3]。雖然手術為主的治療方法可以提高早期乳腺癌患者的遠期生存率,但由于缺乏有效的治療手段,晚期乳腺癌患者的5年生存率較低,因此迫切需要研究乳腺癌的分子調控機制,尋找新的且合適的治療靶點[4]。PKMYT1是WEE家族的成員,最早被報道為一種能夠有效磷酸化Thr14和Tyr15的激酶[5]。據報道,PKMYT1通過抑制細胞周期相關蛋白(如Cyclin A、CDK1和CDK2)的活性來抑制細胞周期的進程[6]。在最近的報道中,PKMYT1也被發現驅動多種腫瘤的進展[7]。然而,PKMYT1在乳腺癌進展中的作用和機制尚不清楚。在本研究中,分析了PKMYT1在乳腺癌進展中的重要作用及影響,并驗證了PKMYT1在乳腺癌各細胞系中的表達情況,提示其可能在乳腺癌發生和惡化等過程中起到重要作用。
材料與方法
1.數據處理及分析:從TCGA數據庫中下載乳腺癌RNA轉錄組數據和臨床數據,并使用R語言軟件(Rx64 4.0.2版本)對其進行分析,其中包括113例正常樣本和1109例腫瘤樣本。采用Limma包進行差異基因表達分析、GSEA及KEGG富集分析以及生存分析。差異表達基因(DEGs)的閾值設為|fold-change|>2和錯誤發現率(FDR)<0.05,富集結果的FDR閾值設置為0.05[8]。
2.生物信息學分析:除利用TCGA數據庫進行分析外,還通過其他數據庫進行驗證。基因表達譜和交互分析工具(GEPIA 2)是一個在線工具,可提供腫瘤和正常組織中差異基因表達的信息、相關分析以及基于廣泛的RNA測序數據患者的生存分析。此外,使用包含54675個基因和10461個癌癥樣本(包括4929個乳腺癌樣本)的Kaplan-Meier Plotter數據庫來評估PKMYT1對乳腺癌患者生存率的影響。TIMER 2.0可對PKMYT1在泛癌中的差異表達進行分析。HPA數據庫收集了基因在泛癌細胞系中的表達情況,可對PKMYT1進行分析。
3.細胞培養:人類正常乳腺上皮細胞系MCF10A和乳腺癌細胞系MCF-7、MDA-MB-231、MDA-MB-468、HCC1937以及小鼠乳腺癌細胞系C127、4T1、EMT6、E0771均購自武漢普諾賽(Procell)生命科技有限公司。DMEM培養基、1640培養基、胰酶及牛胎血清(FBS)購自美國Gibco公司。MCF10A采用專用培養基購自武漢普諾賽(Procell)生命科技有限公司;MDA-MB-231、HCC1937、EMT6細胞均采用1640培養基(90%1640培養基+10%FBS),其他細胞均采用DMEM培養基(90%DMEM培養基+10%FBS),置于細胞培養箱(37℃、5%CO2)內培養[9]。當細胞匯合度為80%~90%時進行傳代,保持細胞良好的生長狀態,取對數增長的細胞進行后續研究。
4.總RNA提取及實時熒光定量PCR:根據制造商的說明,使用碧云天RNAeasyTM動物RNA抽提試劑盒(離心柱式)提取總RNA。互補DNA (cDNA)通過TIANGEN Fastking一步法除基因組cDNA第一鏈合成預混試劑反轉錄總RNA獲得,并用于TRANS PerfectStartTMGreen qPCR SuperMix的實時定量聚合酶鏈反應(qRT-PCR)實驗。人細胞系采用GAPDH作為內參,鼠細胞系采用ACTB作為內參。人類PKMYT1上游引物:5′-CATGGCTCCTACGGAGAGGT-3′,下游引物:5′-ACATGGAACGCTTTACCGCAT-3′。人類GAPDH上游引物:5′-GGAGCGAGATCCCTCCAAAAT-3′,下游引物:5′-GGCTGTTGTCATACTTCTCATGG-3′。小鼠PKMYT1上游引物:5′-GTACCCCCATCCCAGTTCCA-3′,下游引物:5′-TCTGAGGTCTCACACAGGAAA-3′。小鼠ACTB上游引物:5′-GTGCTATGTTGCTCTAGACTTCG-3′,下游引物:5′-ATGCCACAGGATTCCATACC-3′。PKMYT1相對表達量用 2-ΔΔCt表示,ΔΔCt = CtPKMYT1-CtGAPDH/ACTB,ΔΔCt=ΔCt樣本-ΔCt參考樣本[10]。

結 果
1.PKMYT1在乳腺癌中高表達且可能成為新型腫瘤標志物:通過TCGA數據庫下載的乳腺癌轉錄組數據,對其1222例乳腺樣本(N:113/T:1109)進行差異分析及配對差異分析。經差異分析發現,P<0.001說明PKMYT1在正常和腫瘤樣本中的表達差異有統計學意義,且在腫瘤樣本中高表達(圖1A);經配對差異分析可知,P≤2×10-16說明PKMYT1對于同一個樣本癌旁組織和癌組織中的表達是有差異的,且在癌組織中表達更高(圖1B);同時PKMYT1在乳腺癌中的差異表達在GEPIA 2(圖1C)及TIMER2.0(圖1D)數據庫中加以驗證,其結果一致,PKMYT1均在乳腺癌中高表達,提示PKMYT1可能在乳腺癌發生和惡化等過程中起到重要作用。其中TIMER2.0數據庫分析發現PKMYT1在多種腫瘤中均為高表達且具有差異,提示PKMYT1可能成為新型腫瘤標志物。
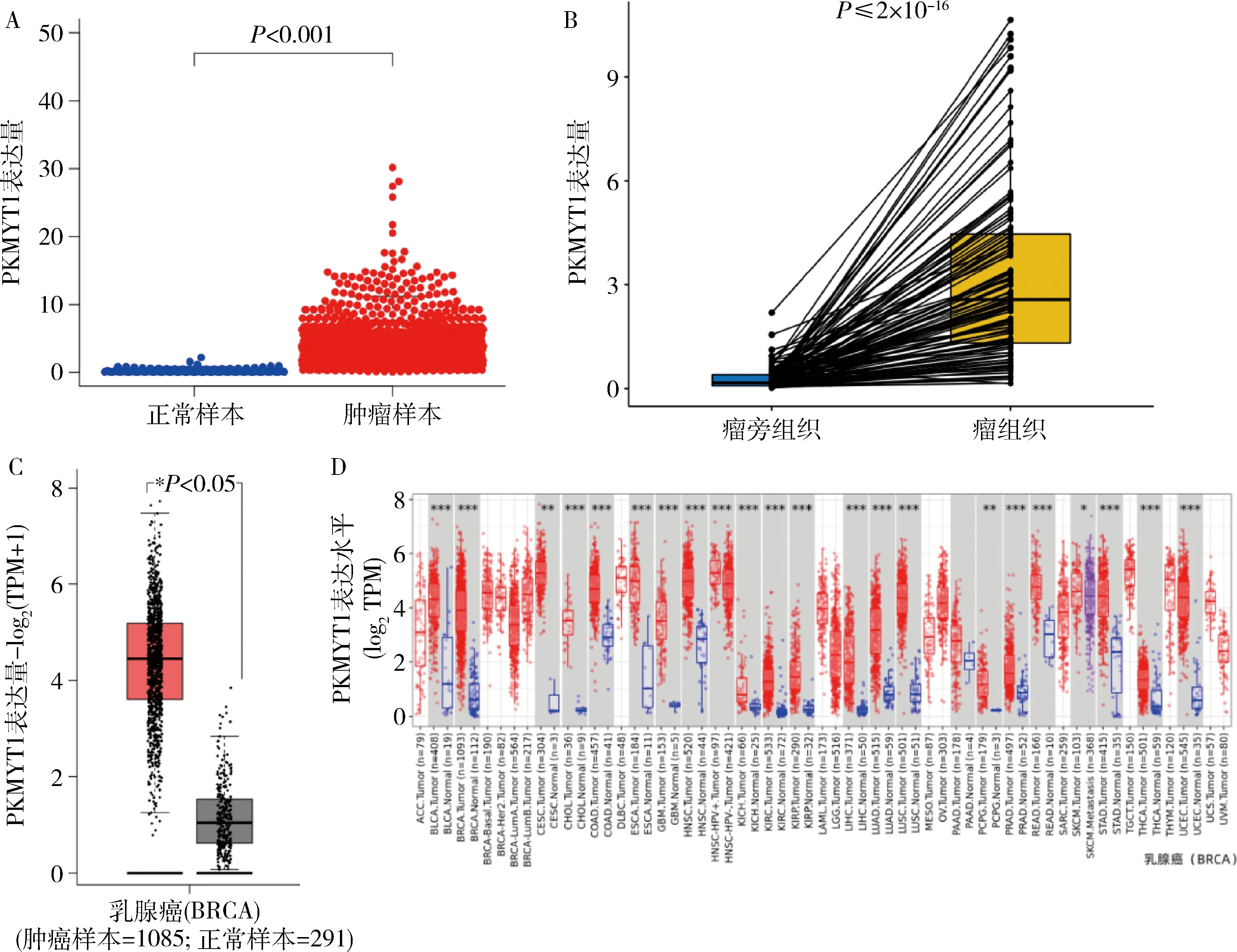
圖1 PKMYT1在乳腺癌中的差異表達A.PKMYT1在TCGA數據庫中的差異分析;B.PKMYT1在TCGA數據庫中的配對差異分析;C.PKMYT1在GEPIA 2數據庫中的差異分析;D.PKMYT1在TIMER 2.0數據庫中的差異分析
2.PKMYT1在乳腺癌中影響腫瘤分期及原發腫瘤直徑:將TCGA獲取的1222例乳腺樣本的轉錄組數據及臨床數據應用Perl軟件及R語言軟件的Limma及Ggpubr包對數據進行合并及臨床相關性分析。PKMYT1在乳腺癌中與年齡、腫瘤分期(Ⅰ~Ⅱ期及Ⅰ~Ⅲ期)及原發腫瘤直徑(T、T1~2、T1~3、T1~4)相關,差異有統計學意義(P<0.05),而與性別、遠處轉移(M)、淋巴結轉移無關(N),差異無統計學意義(P>0.05,圖2)。
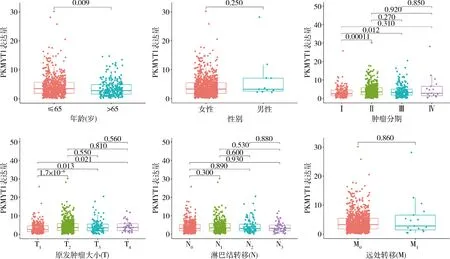
圖2 PKMYT1在乳腺癌中的臨床相關性分析
3.GSEA功能富集分析提示PKMYT1在乳腺癌中與腫瘤生長、增殖相關:利用GSEA(GSEA_4.0.3版本)分析PKMYT1在乳腺癌中的功能及通路,進而了解PKMYT1在乳腺癌中發揮的作用。分析結果顯示當PKMYT1高表達時,經554例樣本的功能富集分析顯示與細胞周期、DNA復制、同源重組等功能性關系較高,則說明PKMYT1在乳腺癌中可能對癌細胞的生長、增殖相關(圖3A);低表達時則與胞外基質受體相互作用、TGF-β信號通路、MAPK信號通路等相關(圖3中B和C),差異有統計學意義(P<0.05,表1,表2)。

表1 PKMYT1高表達功能富集結果(554個樣本)

表2 PKMYT1低表達功能富集結果(555個樣本)

圖3 PKMYT1在乳腺癌中的功能富集分析A.PKMYT1高表達時GSEA多通路富集圖; B.PKMYT1低表達時GSEA多通路富集圖; C.PKMYT1參與重要通路的KEGG詳情
4.PKMYT1為乳腺癌的高風險因素且與其生存相關:通過Kaplan-Meier Plotter來評估PKMYT1對乳腺癌患者生存率的影響,結果發現PKMYT1顯著影響乳腺癌患者的生存,其HR=1.22提示為高風險因素,且差異有統計學意義(P<0.001,圖4)。PKMYT1低表達組的生存率更高,說明當PKMYT1高表達時對乳腺癌是有促進作用的。
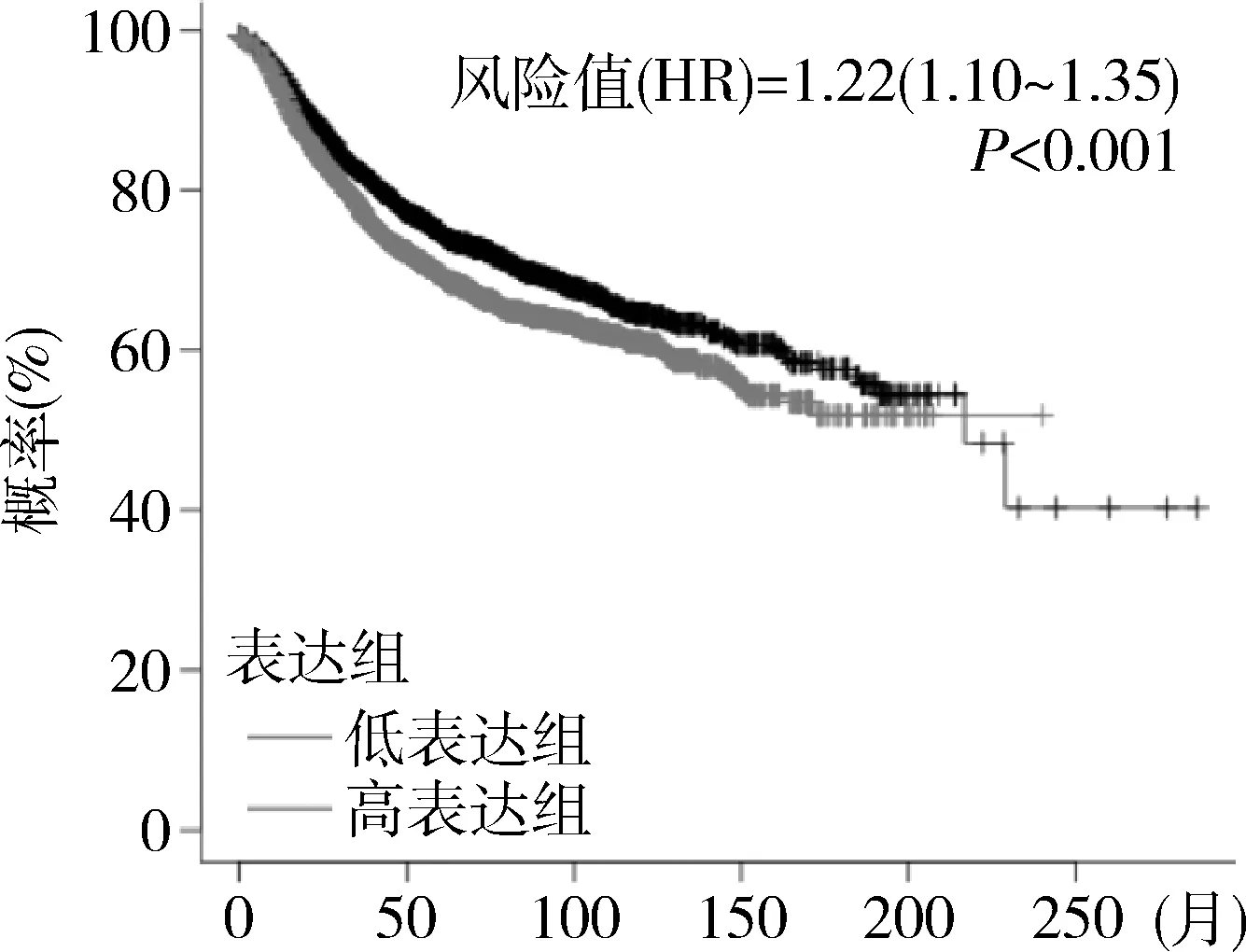
圖4 PKMYT1在乳腺癌中的生存分析
5.PKMYT1在乳腺癌各細胞系中的表達情況:經在線工具HPA數據庫分析發現PKMYT1在泛癌各細胞系之間的差異表達,其中以MCF-7的表達量是最高的,其nTPM值可達127.5,證明PKMYT1在乳腺癌中高表達(圖5A)。為此選取了5種人乳腺細胞系及4種小鼠乳腺癌細胞系做驗證,為選擇PKMYT1高表達的細胞系進行后續的功能驗證。經前期的差異分析及細胞系表達分析,通過qRT-PCR技術檢測了1種人類正常乳腺上皮細胞系MCF10A和4種人類乳腺癌細胞系MCF-7、MDA-MB-231、MDA-MB-468、HCC1937以及4種小鼠乳腺癌細胞系C127、4T1、EMT6、E0771中PKMYT1的相對表達水平。結果驗證了PKMYT1在人乳腺癌細胞系中以正常乳腺細胞系為參照表達由高到低的細胞系依次為MDA-MB-231、MDA-MB-468、MCF-7、HCC1937(圖5B);PKMYT1在小鼠乳腺癌細胞系中的表達由高到低依次為4T1、E0771、C127、EMT6(圖5C)。
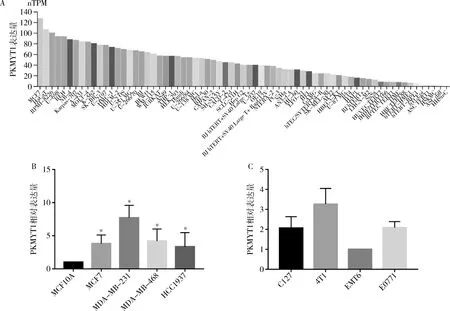
圖5 qRT-PCR檢測PKMYT1mRNA在乳腺癌細胞系中的相對表達量A.PKMYT1在泛癌細胞系中的表達情況;B.PKMYT1在人類乳腺癌細胞系中的相對表達量。與MCF10A比較,*P<0.05;C.PKMYT1在小鼠乳腺癌細胞系中的相對表達量
討 論
在生理條件下PKMYT1作為一個周期蛋白調節激酶,主要負責當CDK1與細胞周期蛋白復合時,通過磷酸化CDK1激酶作為有絲分裂(G2期到M期轉變)的負調節因子,主要介導CDK1在Thr14 上的磷酸化,可能在較小程度上參與了CDK1在Tyr15上的磷酸化[11]。PKMYT1是WEE蛋白激酶家族的一員,WEE家族包括WEE1、PKMYT1、WEE2[12]。在非惡性真核體細胞中,它們作為腫瘤抑制因子,主要生物學功能是防止在細胞復制時發生DNA改變,也作為G2檢查點維持復制的穩定。而在腫瘤細胞中,又類似于癌基因,其升高與腫瘤進展和更具侵襲性疾病以及不良預后相關[13]。一旦惡性轉化過程被誘導,WEE家族上調通過確保癌細胞的基因組不穩定性達到可容忍水平而發揮促進腫瘤的功能[7]。
在乳腺癌中PKMYT1是WEE家族唯一過表達的基因,可見PKMYT1對乳腺癌的發生、發展起著重要的作用,具體機制還有待研究[11]。肝細胞癌和結腸癌中,PKMYT1通過激活β-連環蛋白/TCF調節上皮-間質轉化,這是一個與腫瘤進展、侵襲、轉移和耐藥性相關的過程[14,15]。PKMYT1已被報道在非小細胞肺癌中控制Notch通路,特別是該途徑的關鍵成分包括Notch1、p21和Hes1,通過PKMYT1的化學抑制下調后可抑制其增殖、遷移、侵襲及促進凋亡[13]。神經母細胞腫瘤中,PKMYT1是穩定MYCN蛋白所必需的,MYCN蛋白是這種癌癥類型的關鍵原癌基因[16]。食管鱗狀細胞癌細胞系和原代細胞中,PKMYT1的表達與Akt/mTOR通路的激活相關并對其進行調節[17]。胃癌中PKMYT1表達增加可激活MAPK從而促進其惡性生物學行為[18]。卵巢癌中PKMYT1高表達,敲低PKMYT1可抑制其增殖、遷移、侵襲及遠處轉移[19]。
目前迫切需要新的、更有效的乳腺癌治療靶點,像TCGA和GEPIA這樣的公共數據庫提供了大量有價值的高通量數據。挖掘這樣的公共數據庫可以幫助識別乳腺癌的生物學標志物和治療靶點,并為乳腺癌的發展和機制研究提供見解。本研究中筆者對乳腺癌RNA轉錄組及其臨床數據進行了多方面的分析,并確定了一個新的基因PKMYT1。PKMYT1是乳腺癌數據集中腫瘤和正常樣本之間的一個差異基因,經分析PKMYT1的表達顯著影響乳腺癌患者的生存期且通過GSEA功能富集分析發現與癌細胞的生長增殖密切相關。最后通過細胞實驗驗證PKMYT1無論是在人乳腺癌細胞系中還是小鼠乳腺癌細胞系均呈高表達,在后續研究中將會挑選表達量較高的細胞系進行功能驗證。
綜上所述,本研究通過基因差異表達分析、臨床相關性分析、GSEA富集分析及生存分析發現了一個新的乳腺癌驅動基因PKMYT1,且證明了PKMYT1在多種乳腺癌細胞系中高表達。因此PKMYT1或可成為乳腺癌中一個很有前途的治療靶點,但PKMYT1影響乳腺癌發生、發展的具體機制有待于進一步開展實驗研究予以證實。

