基于環境DNA宏條形碼的鄱陽湖真核浮游植物多樣性研究
郭婷 付智豪 周春花 陳金萍 歐陽珊 吳小平
摘要:探索鄱陽湖真核浮游植物多樣性,可為環境DNA監測水生態系統的應用及標準化提供基礎資料。于2019年4月在鄱陽湖北部通江水道湖區、中部鄱陽湖湖區和南部人工養殖湖泊區共設18個采樣點,采集鄱陽湖環境水樣,針對真核浮游植物18S rDNA 基因的V9區域進行PCR擴增,高通量測序并結合生物信息學技術分析鄱陽湖浮游植物的群落組成。結果表明,基于環境DNA宏條形碼技術鑒定到浮游植物10門24綱54目101科166屬,其中綠藻門和硅藻門種類較為豐富。中部區域的浮游植物群落多樣性和均勻度較高,且鄱陽湖浮游植物整體豐富度較高。非度量多維尺度分析(NMDS)表明,中部與北部區域(P=0.004)、南部與北部區域(P=0.011)之間群落結構差異顯著。冗余分析表明,葉綠素a、pH、流速對各區域的浮游植物群落影響較顯著。環境DNA宏條形碼作為一種新興的生物多樣性監測手段,可快速檢測鄱陽湖浮游植物生物多樣性及其空間分布,為鄱陽湖生物多樣性監測以及生態系統健康評估提供新的技術手段。
關鍵詞:環境DNA宏條形碼;浮游植物;多樣性;群落結構;鄱陽湖
中圖分類號:Q145? ? ? ? 文獻標志碼:A? ? ? ? 文章編號:1674-3075(2023)05-0067-09
浮游生物是水生生態系統的重要參與者之一,能夠維持水體環境中食物網的結構和功能(Rubin & Leff, 2007),浮游植物是水生態系統的主要初級生產者(Reynolds, 1984),其群落和分布特征可以反映水體的環境變化和營養狀態(Reynolds et al, 1993;Chen et al, 2003;Wu et al, 2011)。目前,對于浮游植物的傳統定量調查研究都是通過采集水樣固定后沉淀,然后使用顯微鏡對其進行形態分類并計數(胡鴻鈞和魏印心, 2006;Soares et al, 2011)。傳統的監測方法在形態鑒定方面存在一定困難,需掌握專業的分類學知識。浮游生物種類繁多且個體微小,導致難以實現大量樣本鏡檢,容易產生人工誤差(Xiao et al,2014;Bucklin et al,2016);此外,傳統方法較難估計浮游植物的生物多樣性,監測通常僅限于某些群體(Eiler et al,2013;Visco et al, 2015)。
近年來,快速發展的環境DNA (eDNA)技術提供了新的解決方案,可以更容易評估生態系統的生物多樣性。從最簡單的意義上講,環境 DNA 是從任何類型的環境樣本(土壤、水和空氣等)中提取DNA,無需分離特定生物體(Thomsen & Willerslev, 2015)。環境DNA宏條形碼(eDNA metabarcoding)技術通過對環境DNA序列分析即可檢測物種的存在,無需干擾或者觀察實際生物體(Bohmann et al,2014;Thomsen & Willerslev,2015),可用于描述具有高質量參考庫的環境DNA的分類組成,提供了一種高效率、非侵入性的生物多樣性調查方法,同時也提供了克服基于形態分類法生物評估局限性的機會(Yang & Zhang,2019)。但該方法也存在豐度較低的物種被過濾、采樣流程等過程缺乏統一標準等問題(Bush et al, 2019)。Bombin等(2020)使用環境DNA宏條形碼技術,利用部分LSU rDNA和23S rDNA質體分子標記,闡述了墨西哥北部灣濱海的藻類多樣性。
鄱陽湖是長江流域最大的通江湖泊,對維持區域生態平衡具有重要意義(Li et al, 2019)。盡管人類活動和非生物因素對鄱陽湖的生態系統造成了較為嚴重的影響,但其作為中國最大的淡水湖泊,為本地經濟發展提供了豐富的資源。因此,持續和長期的水質及生物監測對于保護這一生態系統至關重要(Wu et al,2013)。鄱陽湖浮游植物群落結構的動態變化及驅動機制成已成為研究熱點(Chen et al,2013),但鮮見利用環境DNA宏條形技術的相關研究。本研究將環境DNA宏條形碼技術應用于鄱陽湖浮游植物群落調查,旨在揭示鄱陽湖浮游植物的組成及空間分布,為鄱陽湖水體環境變化監測提供一種新的技術手段,這種方法可長期穩定監測生態系統變化并有機會識別一些響應外部干擾的早期信號。
1? ?材料與方法
1.1? ?樣品采集
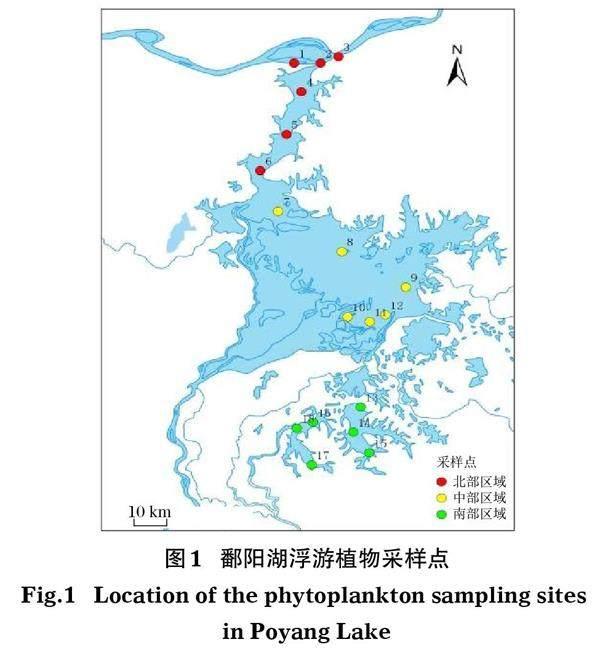
根據各樣點的地理位置,將鄱陽湖劃分為3個采樣區域,共設18個采樣點(圖1),即北部區域(1~6)主要是通江水道湖區,中部區域(7~12)為鄱陽湖湖區,南部區域(13~18)為人工養殖湖泊,即青嵐湖和軍山湖2個湖汊。于2019年4月進行水樣采集,每個采樣點使用容量為1 L的有機玻璃采水器采集樣品,每個樣點重復3次。樣品保存在已滅菌并可密封的廣口瓶中,置于冰盒上盡快送回實驗室過濾。每個樣品使用0.45 μm的混合纖維素濾膜 (天津津騰)和真空蠕動泵(Rocker400, 中國臺灣)進行抽濾。為了防止在抽濾過程中的DNA污染,在每次抽濾樣品的同時,過濾同體積的超純水作為空白對照。在樣品抽濾完成之后,將富集DNA的濾膜分別裝入在2 mL離心管中,-20℃保存直至提取。
1.2? ?DNA提取
獲取的樣本采用DNeasy Blood & Tissue Kit試劑盒(DNeasy plant kit, QIAGEN, 德國)進行濾膜DNA的提取,最后用60 [μ]L Elution Buffer洗脫DNA,保存于-20℃冰箱。為確保操作過程無污染,提取1張未使用的濾膜作為空白對照。使用Qubit (Thermo Fisher Scientific,中國)測量DNA濃度。
1.3? ?PCR擴增
利用通用引物針對真核浮游植物18S rDNA 基因的 V9 區域(長度約130 bp)進行PCR擴增(Amral-Zettler et al, 2009),并設置陰性對照,確保測定過程中未受到DNA污染。引物前帶有8個堿基的barcode。25 μL反應體系包括正反向引物(10 μM)各1 μL,5×reaction buffer 5 μL, 5×GC buffer 5 μL, dNTP(2.5 mM) 2 μL, DNA 模板2 μL, ddH2O 8.75 μL, Q5 DNA Polymerase 0.25 μL。反應條件如下:98℃預變性2 min,30個循環包括98℃變性15 s、55℃退火30 s、72℃延伸30 s,72℃最后延伸5 min。
每個樣品重復擴增3份,將同一樣品的PCR產物混合通過2%的凝膠電泳進行檢測,PCR陰性對照和空白對照的樣本均未出現擴增條帶,表明在采樣及實驗操作過程中均未受污染。
1.4? ?高通量測序
將上述獲取的DNA樣本送至上海派森諾生物科技有限公司進行高通量測序,采用Illumina Miseq平臺對樣本DNA片段進行雙端(Paired-end)測序。通過QIIME軟件(Quantitative Insights Into Microbial Ecology, v1.8.0,http://qiime.org/)調用USEARCH(v5.2.236, http://www.drive5.com/usearch/)檢查并剔除嵌合體序列;之后調用UCLUST序列比對工具(Edgar, 2010)對前述獲得的序列按97%的序列相似度進行歸并和OTU劃分,并選取每個OTU中豐度最高的序列作為該OTU的代表;最后,利用QIIME軟件獲取每個OTU所對應的分類學信息。18S rRDA的參考數據庫為 Protist Ribosomal Reference (PR2) (Guillou et al, 2013)。
1.5? ?數據分析
物種分類信息使用NCBI中的taxonomy數據庫進行校對。
測定每個取樣點的水深(WD),使用校準后的多參數水質檢測儀(YSI,美國)分別測量并記錄濁度(Turb)、水溫(WT)、鹽度(Sal)、溶解氧(DO)和pH,使用葉綠素計(HL-168C06,中國)測量葉綠素濃度(Chl-a),使用流速儀(FP111, Global Water,精度為0.1 m/s)測量流速(V)。每個樣點另外再采集500 mL水樣保存在樣品瓶中帶回實驗室,紫外分光光度法分析測定總氮(TN)和總磷(TP)含量。將每個采樣點的水體理化因子求平均得到每個區域的水體理化因子值。
本文采用物種分類關系圖表示部分浮游植物的物種組成。利用Chao 1指數(Chao1 index)反映群落豐富度,香農指數(Shannon index, H['])、辛普森指數(Gini-Simpson index, GS)反映群落多樣性程度,Pielou均勻度指數(Pielou evenness index, J['])度量群落中相對物種豐富度。基于Bray-Curtis距離矩陣進行非度量多維尺度分析(NMDS),通過相似性分析(ANOSIM)判別樣本組間差異。采用降趨對應分析(DCA)完成對模型的選擇,對浮游植物群落和環境因子的關系進行RDA分析。利用相關性Heatmap圖直觀觀察各個群落與環境因子之間正負相關性程度。采用物種優勢度(Y)表示浮游植物類群某一OTU所占的優勢程度。各指數計算公式如下:
式中:ni為第i種OTU的個數,N為所有OTU總個數,fi為第i種OTU在各采樣點出現的頻率。本文將優勢度Y ≥ 0.02的OTU確定為優勢種(白海鋒等,2021)。
以上數據在R語言、軟件SPSS 26.0.0.0、軟件Canoco 5 (賴江山, 2013)、圖圖云平臺(https://www.cloudtutu.com)、生科云平臺(https://www.bioincloud.tech)以及基因云平臺完成(https://www.genescloud.cn)完成。
2? ?結果
2.1? ?水環境因子
鄱陽湖水體理化因子的空間分布見表1。3個區域的水溫、溶解氧、總氮和總磷差異不明顯。水溫在20.17~22.12℃,溶解氧在7.26~8.66 mg/L,總氮在1.46~1.90 mg/L,總磷在0.12~0.16 mg/L。各區域的水深、濁度、鹽度、流速、pH和葉綠素a的差異較大,北部平均水深達到了9.17 m,流速達到了0.45 m/s,pH、總氮、總磷也比其他2個區域更高,中部的平均濁度最大(31.95),南部最小(8.82)。葉綠素a含量中部最高(12.89 [μ]g/L)。中部和南部的水體pH呈弱堿性,北部水體呈弱酸性。
2.2? ?藻類物種組成及空間分布
根據區域將環境DNA宏條形碼測序得到的OTU進行注釋并分類,共檢測到2 135個OTU,隸屬于10門24綱54目101科166屬188種(種未顯示) (表2)。其中,硅藻門(345個OTU)和綠藻門(679個OTU)的種類最豐富,而定鞭藻門(8個OTU)未注釋到屬,褐藻門(12個OTU)僅注釋到科。因此物種分類關系圖只顯示這4個門,且因未注釋到屬的OTU相對較多,均以未注釋到顯示。硅藻門中的圓篩藻綱相對豐度最高,綠藻門中共球藻綱溪菜目的溪菜科相對豐度最高,同時也存在一些OTU未能準確鑒定到目或其他分類單元(圖2)。從OTU的分布區域來看,南部的OTU數目比中部和北部的多。硅藻門的OTU主要分布在北部,綠藻門的OTU主要分布在南部,甲藻門、裸藻門的OTU主要分布在中部,金藻門、隱藻門的OTU則主要分布在南部。
在鄱陽湖檢測到的浮游植物群落組成序列相對豐度見圖3。北部硅藻門的相對豐度最高,其次是綠藻門,均為優勢類群;與北部不同的是,中部和南部區域綠藻門的相對豐對最高,其次是隱藻門,也均為優勢類群。在整個調查區域內,褐藻門和定鞭藻門的相對豐度均較低。
2.3? ?優勢OTU的確定及其空間分布
在2 135個OTU中,共有6個被確定為優勢OTU (表3)。其中,隱藻門2個,綠藻門2個,硅藻門1個,裸藻門1個。中部和南部OTU2的優勢度最大(0.05和0.11),屬于隱藻門隱藻綱隱藻目,在南部和中部占絕對優勢;北部OTU8的優勢度最大(0.05),屬于硅藻門圓篩藻綱海鏈藻目。OTU4的優勢度為0.08,對應綠藻門共球藻綱溪菜目,但僅在南部出現;OTU48的優勢度為0.02,對應裸藻門裸藻綱裸藻目,是北部特有的優勢OTU,也是裸藻門唯一的優勢OTU。
2.4? ?多樣性指數
通過計算香農指數(H['])、辛普森指數(GS)、Pielou均勻度(J['])和Chao 1指數,對鄱陽湖浮游植物的群落進行多樣性分析,并繪制多樣性指數差異檢驗箱線圖(圖4)。在3個分組的樣本間,H[']、GS和J[']的變化趨勢大致相似。H[']均值為3.18(1.27~4.01),GS均值為0.87(0.59~0.96),J[']均值為0.50,最大值是0.62;中部的H[']、GS和J[']均較南部和北部的高,說明中部的浮游植物群落的多樣性和均勻度較高。Chao 1指數的平均值為726.31(385.22~1129.51),其值較大,說明鄱陽湖浮游植物群落豐富度較高。但3組樣本的各多樣性指數之間沒有顯著差異性(P>0.05)。
2.5? ?NMDS分析
對北部、中部和南部3組樣本的群落結構組成進行了NMDS分析。Stress值為0.0922,表明結果較好;R值大于0,說明各組之間的距離大于組內距離;整體P值小于0.01,說明分組樣本間的浮游植物群落結構組成具有極顯著性差異(圖5)。南部和北部的部分樣點距離較近,但大部分樣點之間的距離較遠,因此南、北部之間的群落結構組成具有一定的差異;進一步的ANOSIM分析表明,南部與中部之間的群落結構組成無顯著差異(R=0.263, P=0.06);中部與北部的群落結構組成具有極顯著差異(R=0.343, P=0.004);南部與北部的浮游植物群落結構組成具有顯著差異(R=0.444, P=0.011)。
2.6? ?環境因子關聯性
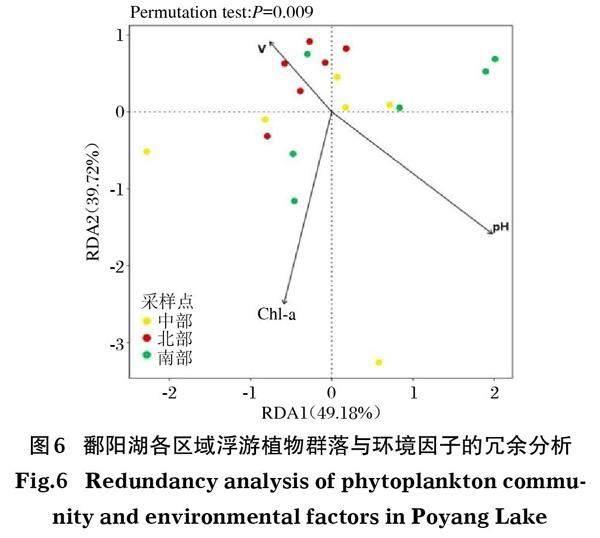
基于各門的序列數進行DCA分析,Lengths of gradient的最大值小于3,因此選擇RDA分析環境因子的關聯性。各環境因子在排序結果中的相關性指數(r)以及顯著性檢驗值(P)見表4。
由表4可見,環境因子中Chl-a和pH極顯著影響排序結果(P<0.01)。流速(V)顯著影響排序結果(P<0.05)。因此,在進行RDA分析前,去除對浮游植物群落影響不顯著的環境因子,僅使用顯著影響因子進行RDA分析。RDA分析中(圖6),Permutation test的P<0.01,即環境因子對浮游植物群落結構影響顯著,可以看出北部、中部和南部3組樣本間表現出了較高的離散性,北部區域樣本之間的離散性較南部和中部的低。大部分北部樣本與流速之間的射線夾角為銳角,說明北部區域的大部分樣本與流速為正相關關系;南部區域的大部分樣本與pH為正相關關系。從RDA圖6還可以看出,Chl-a與pH也為正相關關系,而Chl-a和pH與V為負相關關系。
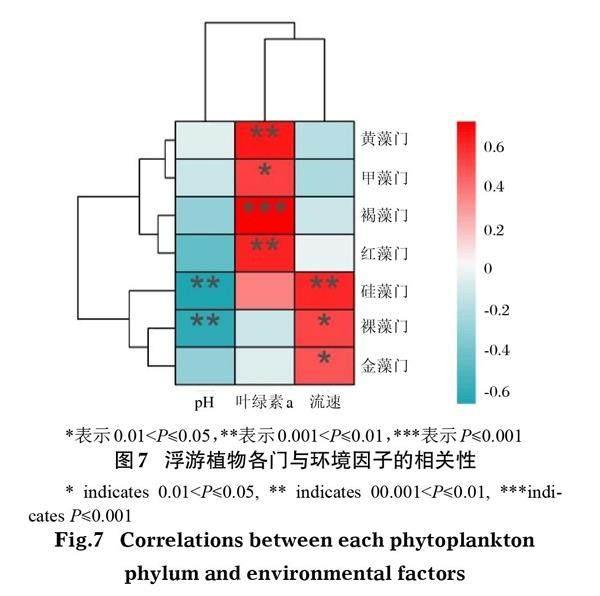
浮游植物各門與環境因子之間的相關性Heatmap分析見圖7。可以看出,黃藻門、褐藻門和紅藻門與Chl-a為極顯著正相關關系(P<0.01),硅藻門和裸藻門與pH為極顯著負相關關系(P<0.01),硅藻門與流速為極顯著正相關關系(P<0.01)。
3? ?討論
3.1? ?基于環境DNA的鄱陽湖浮游植物多樣性
本次調查表明,基于環境DNA宏條形技術的鄱陽湖區域春季浮游植物共有10門24綱54目101科166屬188種,Jia等(2020)利用傳統方法檢測到8門77屬133種。比較發現,利用環境DNA技術可以檢測到更多的物種。本研究中,硅藻門和綠藻門在群落組成中占優勢,這與以往利用傳統方法監測鄱陽湖浮游植物的情況一致(Liu et al, 2015;Cao et al,2016;Liu et al, 2020)。
物種多樣性被用來評價群落中種類組成的穩定程度及其數量分布均勻程度和群落組織結構特征,也是衡量一定區域內浮游植物資源豐富程度的客觀指標之一(陳家長等, 2009);根據香農多樣性指數大小的等級劃分見表5(孟順龍等,2016)。本研究中,北部湖區多樣性豐富(2.6~3.5)的樣點有5個,占北部湖區所有樣點的83.3%,說明北部湖區浮游植物的多樣性處于Ⅳ級,多樣性豐富;中部湖區多樣性非常豐富(>3.5)的樣點有4個,占中部湖區所有樣點的66.7%,說明中部湖區浮游植物的多樣性處于Ⅴ級,多樣性非常豐富;南部區域多樣性豐富(2.6~3.5)的點只有2個,而多樣性較好(1.6~2.5)的點有2個,均占調查樣點的33.3%,說明南部區域浮游植物的多樣性處于Ⅲ~Ⅳ級,多樣性較好或豐富。由各區域多樣性等級可以看出,北部和南部區域的多樣性比中部豐富,推測是南部區域(青嵐湖和軍山湖)人工養殖大量經濟魚類,并且以浮游植物為餌料的魚類較多,對浮游植物的消耗較大所致;而中部區域水動力學較為平穩,較為適合浮游植物的繁殖和生長。
3.2? ?環境因子對浮游植物群落結構的影響
通過環境DNA宏條形碼技術對鄱陽湖真核浮游植物的研究發現,硅藻門、綠藻門和隱藻門的相對豐度均較高,OTU數目也較多。硅藻對水環境變化極為敏感,水溫、流速等都會引起硅藻及其含量的變化(黃學輝等, 2018),硅藻門的相對豐度較高,硅藻門OTU數目也較多(圖3,表2),本研究結果與黃蘭貴等(2021)的結果一致。這是由于硅藻適宜生長溫度在10~25℃,春季溫度適宜硅藻生長(Admiraal, 1976)。硅藻門主要與流速呈極顯著正相關關系(圖7)。北部區域是鄱陽湖的通江口,流速較大(表1),對硅藻生長較為有利,這是硅藻門在北部相對豐度最高的原因;此外,常溫條件下一些單細胞綠藻生長速度也較快,導致綠藻門的相對豐度較高(彭寧彥等, 2018);隱藻綱是隱藻門僅有的1綱,其分布廣泛,常在水體中形成優勢類群(胡鴻鈞和魏印心, 2006)。
相關性熱圖中并未出現綠藻門和隱藻門(圖7),這是因為綠藻門與水溫關系為正相關(夏爽等, 2013),隱藻門的繁殖與生長主要受磷、鐵和光照影響(黃學輝等, 2018);而在RDA分析中,水溫和總磷與鄱陽湖整體浮游植物之間的關系并不顯著。營養鹽的富集有利于藻類的繁殖與生長(戴星照, 2016),但本研究中的營養鹽對鄱陽湖整體浮游植物之間的關系并不顯著,可能是春季鄱陽湖水位上漲稀釋了營養鹽濃度(吳召仕等, 2014)。
此外,本研究利用環境DNA宏條形技術檢測到了紅藻門在鄱陽湖的分布(表2),而在以往傳統的研究中均未出現紅藻門,這可能是紅藻個體較大,利用傳統方法定性采樣時較難涉及所致(張軍毅等,2021);同時,在本研究還檢測到褐藻門,但其OTU較少且僅能注釋到科水平,一方面可能是褐藻在淡水中種類極少(胡鴻鈞和魏印心, 2006);另一方面也可能是數據庫缺少序列的相關信息所致。
3.3? ?環境DNA技術用于浮游植物監測的優缺點
與傳統調查方法相比,環境DNA宏條形技術可以檢測到更多的物種,對傳統調查方法得到的物種名錄是一個補充,也可以用于評估浮游植物的生物多樣性,還能減少對分類學專家的依賴(Bombin et al, 2020)。本研究也發現環境DNA宏條形技術存在有些OTU不能鑒定到種水平的問題,這是由于參考數據庫中浮游植物序列信息不全所致。研究表明,數據庫對環境DNA技術注釋物種這一環節尤為重要,目前數據庫都在不斷更新和補充缺失物種。因此,在物種注釋時更應選擇對應關系較強、更新較頻繁的數據庫。
志謝:感謝南昌大學孫威威、王維開和劉雄軍博士在樣品采集方面提供的幫助。
參考文獻
白海鋒,王怡睿,宋進喜,等,2021. 渭河陜西段浮游植物群落結構時空變化與影響因子分析[J]. 環境科學學報, 41(8):3290-3301.
陳家長,孟順龍,尤洋,等,2009. 太湖五里湖浮游植物群落結構特征分析[J]. 生態環境學報, 18(4):1358-1367.
陳康,孟子豪,李學梅,等,2022. 鄱陽湖流域柘林水庫秋季浮游植物群落結構及其構建過程驅動機制[J]. 湖泊科學, 34(2):433-444.
戴星照,2016. 鄱陽湖科學考察[M]. 上海:上海科學技術出版社.
胡鴻鈞,魏印心,2006. 中國淡水藻類[M]. 北京:科學出版社.
黃蘭貴,殷環環,張航,等,2021. 鄱陽湖出口浮游植物群落與環境因子分析[J]. 水利水電快報, 42(8):77-82.
黃學輝,陳傳紅,袁軼君,等,2018. 鄱陽湖浮游植物群落季節性變化分析[J]. 江西化工, (2):180-184.
賴江山,2013. 生態學多元數據排序分析軟件Canoco5介紹[J]. 生物多樣性, 21(6):765-768.
孟順龍,肖代,陳小麗,等,2016. 豐、枯水期里下河腹地典型水體浮游動物群落結構與水質評價[J]. 水生態學雜志, 37(6):76-83.
彭寧彥,戴國飛,張偉,等,2018. 鄱陽湖不同湖區營養鹽狀態及藻類種群對比[J]. 湖泊科學, 30(5):1295-1308.
吳召仕,張路,劉寶貴,等,2014. 鄱陽湖豐水期水體中葉綠素a含量空間分布及其與環境因子的關系[J]. 濕地科學, 12(3):286-292.
夏爽,張琪,劉國祥,等,2013. 人工試驗湖泊浮游藻類群落的生態學研究[J]. 水生生物學報, 37(4):640-647.
張軍毅,孫蓓麗,朱冰川,等,2021. 基于分子標記的藻類鑒定研究進展[J]. 湖泊科學, 33(6):1-20.
Admiraal W, 1976. Influence of light and temperature on the growth rate of estuarine benthic diatoms in culture[J]. Marine Biology, 39(1):1-9.
Amral-Zettler L A, Mccliment E A, Ducklow H W, et al, 2009. A method for studying protistan diversity using massively parallel sequencing of V9 hypervariable regions of small-subunit ribosomal RNA genes[J]. PloS One, 4(12):e6372.
Bohmann K, Evans A, Gilbert M T, et al, 2014. Environmental DNA for wildlife biology and biodiversity monitoring[J]. Trends in Ecology & Evolution, 29(6):358-367.
Bombin S, Wysor B, Lopez-Bautista J M, 2020. Assessment of littoral algal diversity from the northern Gulf of Mexico using environmental DNA metabarcoding[J]. Journal of Phycology, 57(1):269-278.
Bucklin A, Lindeque P K, Rodriguez-Ezpeleta N, et al, 2016. Metabarcoding of marine zooplankton: prospects, progress and pitfalls[J]. Journal of Plankton Research, 38(3):393-400.
Bush A, Compson Z G, Monk W A, et al, 2019. Studying Ecosystems With DNA Metabarcoding: Lessons From Biomonitoring of Aquatic Macroinvertebrates[J]. Frontiers in Ecology and Evolution,DOI: 10.3389/fevo.2019.00434
Cao J, Chu Z S, Du Y, et al, 2016. Phytoplankton dynamics and their relationship with environmental variables of Lake Poyang[J]. Hydrology Research, 47(S1):249-260.
Chen Y W, Qin B Q, Teubner K, et al, 2003. Long-term dynamics of phytoplankton assemblages: microcystis-domination in Lake Taihu, a large shallow lake in China[J]. Journal of Plankton Research, 25(4):445-453.
Eiler A, Drakare S, Bertilsson S, et al, 2013. Unveiling distribution patterns of freshwater phytoplankton by a next generation sequencing based approach[J]. PLoS One, 8(1):e53516.
Guillou L, Bachar D, Audic S, et al, 2013. The protist ribosomal reference database (PR2): a catalog of unicellular eukaryote small sub-unit rRNA sequences with curated taxonomy[J]. Nucleic Acids Research, 41(D1):597-604.
Jia J J, Gao Y, Zhou F, et al, 2020. Identifying the main drivers of change of phytoplankton community structure and gross primary productivity in a river-lake system[J]. Journal of Hydrology, 583(C):124633.
Liu X, Qian K M, Chen Y W, 2015. Effects of water level fluctuations on phytoplankton in a Changjiang River floodplain lake (Poyang Lake): Implications for dam operations[J]. Journal of Great Lakes Research, 41(3):770-779.
Li K, Liu X J, Zhou Y, et al, 2019. Temporal and spatial changes in macrozoobenthos diversity in Poyang Lake Basin, China[J]. Ecology and Evolution, 9(11):1-13.
Liu X J, Lu Q F, Zhou Y, et al, 2020. Community characteristics of phytoplankton and management implications in Poyang Lake Basin[J]. Limnology, 21(2):207-218.
Reynolds C S, 1984. Phytoplankton periodicity-the interactions of form, function and environmental variability[J]. Freshwater Biology, 14(2):111-142.
Reynolds C S, Padisák J, Sommer U, 1993. Intermediate disturbance in the ecology of phytoplankton and the maintenance of species diversity: a synthesis[J]. Hydrobiologia, 249(1/3):183-188.
Rubin M A, Leff L G, 2007. Nutrients and other abiotic factors affecting bacterial communities in an Ohio River (USA)[J]. Microbial Ecology, 54(2):374-383.
Soares M C S, Lobo L M, Vidal L O, et al, 2011. Light microscopy in aquatic ecology: methods for plankton communities studies[J]. Methods in Molecular Biology, 689:215-227.
Thomsen P F, Willerslev E, 2015. Environmental DNA—an emerging tool in conservation for monitoring past and present biodiversity[J]. Biological Conservation, 183(1):4-18.
Visco A J, Apothoz-Perret-Gentil L, Cordonier A, et al, 2015. Environmental monitoring: inferring diatom index from next-generation sequencing data[J]. Environmental Science & Technology, 49(13):7597-7605.
Wu N C, Schmalz B, Fohrer N, 2011. Distribution of phytoplankton in a German lowland river in relation to environmental factors[J]. Journal of Plankton Research, 33(5):807-820.
Wu Z S, Cai Y J, Liu X, et al, 2013. Temporal and spatial variability of phytoplankton in Lake Poyang: The largest freshwater lake in China[J]. Journal of Great Lakes Research, 39(3):476-483.
Xiao X, Sogge H, Lagesen K, et al, 2014. Use of high throughput sequencing and light microscopy show contrasting results in a study of phytoplankton occurrence in a freshwater environment[J]. PLoS One, 9(8):e106510.
Yang J H, Zhang X W, 2019. eDNA metabarcoding in zooplankton improves the ecological status assessment of aquatic ecosystems[J]. Environment International, 134:105230.
(責任編輯? ?萬月華)
Diversity of Eukaryotic Phytoplankton in Poyang Lake based
on Environmental DNA Metabarcoding
GUO Ting1, FU Zhi‐hao1, ZHOU Chun‐hua1, CHEN Jin‐ping1, OUYANG Shan1,2, WU Xiao‐ping1,2
(1. College of Life Science, Nanchang University, Nanchang? ?330031, P.R. China;
2. Ministry of Education, Key Laboratory of Environment and Resource Utilization of Poyang Lake,
Nanchang University, Nanchang? ?330031, P.R. China)
Abstract:In this study, the new technology of environmental DNA (eDNA) metabarcoding was used to explore the phytoplankton community in Poyang Lake, focusing on species composition, spatial distribution, and community diversity. We aimed to provide basic data for the application and standardization of eDNA for monitoring aquatic ecosystems. Poyang Lake was divided into three regions and a total of 18 sampling sites were selected, including the channel connecting north Poyang Lake to the Yangtze River (Site 1-6), central Poyang Lake (Site 7-12) and the aquaculture area of south Poyang Lake (Site 13-18). Water samples were collected in triplicate at each sampling site during April of 2019. The V9 region of the 18S rDNA gene in eukaryotic phytoplankton was amplified and high-throughput sequencing and bioinformatics were used to analyze the community composition of phytoplankton in Poyang Lake. A total of 2 135 Operational Taxonomic Units (OTUs) of phytoplankton were obtained, consisting of 188 phytoplankton species from 166 genera, 101 families, 54 orders, 24 classes and 10 phyla. Chlorophyta and Bacillariophyta had high species richness. The phytoplankton community richness in Poyang Lake was generally high, and community diversity and evenness were higher in the central area of Poyang Lake. Non-metric multidimensional scale (NMDS) analysis shows that there were significant differences in the phytoplankton community structure between central and northern Poyang Lake (P=0.004), and between the southern and northern areas (P=0.011). Redundancy analysis (RDA) shows that chlorophyll-a, pH, and flow velocity greatly effected on the phytoplankton community in all areas of the lake. In conclusion, eDNA metabarcoding was used to rapidly assess phytoplankton biodiversity and spatial distribution in Poyang Lake and it provides a new and effective tool for monitoring the biodiversity and ecosystem health of Poyang Lake.
Key words:environmental DNA metabarcoding; phytoplankton; diversity; community structure; Poyang Lake
收稿日期:2021-12-11? ? ? 修回日期:2023-04-11
基金項目:江西省大學生創新創業訓練計劃重點項目(202210403062);國家重點研發計劃“藍色糧倉”重點專項(2018YFD0900801)。
作者簡介:郭婷,1995年,女,碩士研究生,研究方向為生物多樣性。E-mail: Guotingsx@163.com
通信作者:周春花,1979年生,女,博士,副教授,主要從事生物多樣性研究。E-mail: zhouchunhuajx@hotmail.com

