S/C對Fenton處理切削液的優選與污泥分析
張曉晨,葛霖鍇,2,來文娟,來文艷,崔安順,2,張延青,齊元峰,*
(1.青島理工大學 環境與市政工程學院,青島 266525;2.青島水務環境能源有限公司,青島 266000;3.蘇州根基科技有限公司,蘇州 215000)
切削液以化學合成類基礎油為主要原料,輔以防銹劑、鈍化劑和消泡劑等多種添加劑調配而成,具有冷卻、潤滑、防銹、清洗等功能[1],是一種廣泛應用于機械加工行業的基礎耗材。經過多次循環使用后,切削液因不可避免的污染而變質,變質后的廢棄切削液有機污染物含量高、毒性大,若不能進行及時有效的處理,將對自然環境和人體健康造成嚴重危害[2]。因此,廢棄切削液被列入《國家危險廢物名錄》,危險廢物代碼HW09,900-006-09[3]。
當前廢棄切削液的處理以聯合工藝處理為主,通常先采用化學破乳技術進行初步油水分離[4],再對分離得到的切削液廢水進行后續處理,處理方式主要有膜分離法、生物法、高級氧化法等。膜分離法操作簡單,但濃差極化引起的膜通量下降制約了膜技術在切削液廢水處理中的應用[5];生物法處理成本低、效率高,但對待切削液廢水往往需要聯合更多的預處理工藝以滿足生化法的進水要求[6];以Fenton法為例的高級氧化法則主要通過產生的強氧化性自由基對有機物進行分解或直接礦化,目前被廣泛應用于廢水的處理中[7]。但Fenton氧化法由于鐵鹽的使用,會不可避免地產生Fenton污泥[8],污泥的產量直接關聯污泥處理費用,進而影響整個工藝的處理成本,因此,Fenton法應用于廢棄切削液的過程中,關注切削液廢水處理效果的同時考慮Fenton污泥的產量和性質具有重要意義。目前,焚燒、熱解和固化等熱處理方法成為Fenton污泥的主要處理方式[9],熱處理是一個極其復雜的物理-化學變化過程,包含水分的脫除、有機物的揮發等多類復雜反應,然而關于Fenton污泥熱處理過程的研究卻鮮有報道。
在此背景下,本文首次提出了將CODcr去除量和Fenton污泥產量結合為S/C(去除單位質量CODcr的污泥產率)指標作為Fenton運行的參數優選指標,考察Fenton法對廢棄切削液破乳后產生廢水CODcr的處理效果,基于TG/DSC等熱性質分析方法以及SEM,XRD,XPS等測試方法對Fenton法處理切削液廢水產生污泥(Fenton Sludge,FS)進行系統的分析。
1 實驗材料和方法
1.1 材料和試劑
實驗藥品:H2O2(30%,密度1.12 g/mL)購自上海國藥集團;Fe2SO4·7H2O(純度≥99.7%)、PAC(純度≥98%)和PAM(陽離子型)購自上海麥克林生物試劑有限公司。廢棄切削液取自青島立博汽車零部件精密鑄造有限公司。利用PAC和PAM對廢棄切削液進行化學破乳分離預處理[10],得到的切削液廢水水質見表1。

表1 切削液廢水性質
1.2 實驗方法
將100 mL的切削液廢水注入250 mL燒杯中并放置在磁力攪拌器上,設置轉速為400 r/min后用1 mol/L的H2SO4溶液調節水樣的初始pH。隨后將一定質量的Fe2SO4·7H2O投加到水樣中,并分4次等時間間隔投加一定體積的H2O2。待反應結束后采用1 mol/L的NaOH溶液調節水樣pH至8.50并靜置沉淀30 min。將最佳實驗條件下得到的Fenton污泥(Fenton Sludge,FS)進行水洗處理后(消除因pH調節產生的Na2SO4),放在恒溫干燥箱中干燥6 h(設置溫度為105 ℃)后研磨至100 目,放置在玻璃瓶中,根據FS熱性質進行熱處理。
1.3 測試方法
測試水樣先經0.45 μm濾膜過濾,隨后對其pH,CODcr測試三次取均值;廢水CODcr去除率計算方法為式(1),S/C計算方法為式(2)。采用TG,DSC測試FS的熱性質;采用EDS測FS的元素成分含量;采用SEM觀察FS的形貌特征;采用XRD對FS進行物相分析;采用FTIR,XPS測試FS的化學性質。
(1)
式中:C去除率為CODcr的去除率;C0為切削液廢水的初始CODcr,mg/L;V0為初始切削液廢水的體積,L;Ce為Fenton反應結束后水樣的CODcr,mg/L;Ve為Fenton反應結束后水樣的體積,L。
(2)
式中:S/C為去除單位質量CODcr的污泥產率,mL/mg;S為Fenton反應結束后靜置30 min的污泥體積,mL/L;C為Fenton反應去除的CODcr質量,mg/L;S30為Fenton反應結束后靜置30 min的污泥體積百分比,%;C0為切削液廢水的初始CODcr,mg/L;V0為初始切削液廢水的體積,L;Ce為Fenton反應結束后水樣的CODcr,mg/L;Ve為Fenton反應結束后水樣的體積,L。
2 結果與討論
2.1 最佳Fenton反應條件的選擇
2.1.1m(Fe2+)∶m(H2O2)對Fenton反應的影響
Fe2+促使Fenton反應的發生。當切削液廢水CODcr=9000 mg/L,初始pH=5.5,分4次在反應時間為0,25,50和75 min時添加H2O2,每次1.5 mL(共計6 mL),共反應100 min。Fe2+和H2O2的質量比對CODcr去除率、污泥SV30和S/C的影響結果如圖1(a)所示。當m(Fe2+)∶m(H2O2)<1∶2時CODcr去除率呈現升高的趨勢,并在m(Fe2+)∶m(H2O2)=1∶2時達到最高的79.11%,而隨著m(Fe2+)∶m(H2O2)的持續升高,CODcr去除率卻降低到65%。這是因為當H2O2投加量一定時,隨著FeSO4·7H2O投加量的增加,體系中激發出更多的·OH降解污染物,導致CODcr去除率的升高(式(3))[11];繼續增加FeSO4·7H2O,體系中·OH會被過量的Fe2+所消耗,減少了污染物的氧化比例,導致CODcr去除率的降低。而SV30值和FeSO4·7H2O的添加量呈現明顯的線性關系,也就是FS的產量與FeSO4·7H2O的添加量呈正相關。同時,S/C曲線和CODcr去除率曲線呈現完全相反的樣式。越低的S/C代表著越高的FeSO4·7H2O利用率,因此,以此為優選依據認為m(Fe2+)∶m(H2O2)=1∶2是最佳的FeSO4·7H2O投加比例。

Fe2++H2O2+H+→Fe3++H2O+·OH
(3)
2.1.2 H2O2投加量對Fenton反應的影響
H2O2是產生·OH的主要因素,當切削液廢水CODcr=9000 mg/L,初始pH=5.5,以m(Fe2+)∶m(H2O2)=1∶2的比例投加FeSO4·7H2O,分4次在反應時間為0,25,50和75 min時添加H2O2,共反應100 min,H2O2投加量對CODcr去除率、污泥SV30和S/C的影響結果如圖1(b)所示。隨著H2O2投加量的升高,CODcr去除率呈現出先增后減的趨勢,當H2O2投加量為70 mL/L時,CODcr去除率達到最高的81.67%。這是因為提高H2O2投加量,體系中產生的·OH也隨之增加(式(3)),能夠充分降解水中的污染物,提升CODcr去除效果。但隨著H2O2的繼續投加,過量的H2O2會消耗體系中的·OH(式(4)),產生氧化性相對較弱的HO2·[11](·OH=2.8 V;H2O2=1.763 V;HO2·=1.65 V),弱化Fenton的氧化能力。并且過量的H2O2也會導致出水CODcr升高。除此之外,由于FeSO4·7H2O投加量以固定的m(Fe2+)∶m(H2O2)比例添加, SV30曲線會伴隨著H2O2投加量的增多呈現出逐漸升高的趨勢。同時,S/C值在H2O2投加量大于70 mL/L后呈現出突然上升趨勢,這源于CODcr去除效率的降低和不斷升高的SV30值,因此最佳H2O2投加量為70 mL/L。
H2O2+·OH→H2O+HO2·
(4)
2.1.3 初始pH對Fenton反應的影響
過低/過高的pH 值會對·OH的產量有巨大影響。當切削液廢水CODcr=9000 mg/L,以m(Fe2+)∶m(H2O2)=1∶2的比例投加FeSO4·7H2O,分4次在反應時間為0,25,50和75 min時添加H2O2,每次1.75 mL(共計7 mL),共反應100 min,水樣初始pH對CODcr去除率、污泥SV30和S/C的影響結果如圖1(c)所示。隨著水樣初始pH值的升高,CODcr去除率在pH=5.5時達到最高(81.67%),初始pH低于5或者高于5.5時,CODcr的去除率明顯下降。同時,污泥SV30從58.50%緩慢增加到63.48%,并無明顯變化。從圖2中可以看到,隨著第1次H2O2的加入,反應體系pH呈現劇烈下降,而隨著H2O2的第2,3和4次添加,pH幾乎保持不變。由于在初始pH環境下,4次加入H2O2的量和時間均一致,CODcr去除率的差別與第一次添加H2O2所在pH的條件直接有關。逐漸升高水樣的初始pH,溶液中的Fe2+會轉變為Fe(OH)+,進而轉變為Fe(OH)2[12]。當pH=5.5左右時,Fe2+幾乎全以Fe(OH)2存在,而Fe(OH)2激發H2O2產生·OH的反應速率是Fe2+的1個數量級[13],因此提高廢水的初始pH值,CODcr去除效果具有明顯的提升。但過高的pH也會加快Fe(OH)2的析出[14],致使 CODcr去除率在pH>5.5后明顯下降。此時,從S/C值可知,水樣初始pH=5.5為最優點。
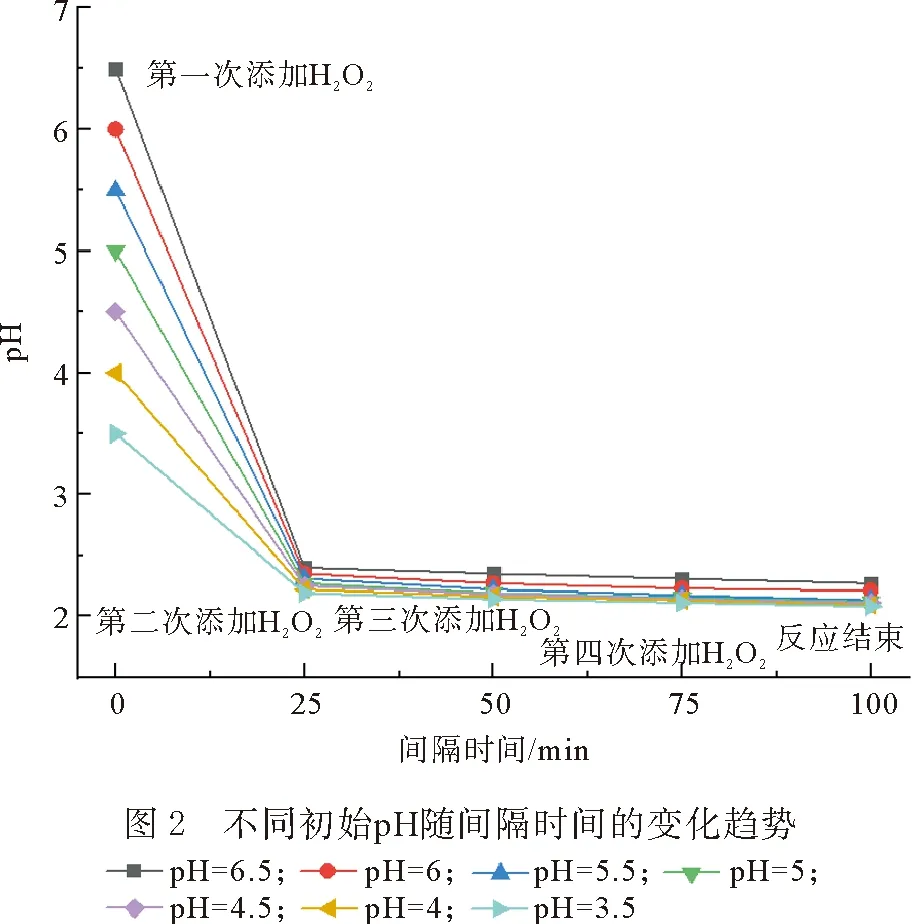
2.1.4 H2O2投加間隔時間對Fenton反應的影響
乙肝表面抗原(HBsAg)陽性率11.1%、丙型肝炎抗體(抗-HCV)陽性率0.35%、梅毒螺旋體特異性抗體(抗-TP)陽性率1.87%、人類免疫缺陷病毒抗體(抗-HIV)陽性率0.02%、總陽性率11.43%,這四種傳染性標志物陽性率遠高于普通流行病學(見表1)。
當切削液廢水CODcr=9000 mg/L,初始pH=5.5,以m(Fe2+)∶m(H2O2)=1∶2的質量比投加FeSO4·7H2O,分4次投加7 mL(每次1.75 mL)H2O2,H2O2的投加間隔時間對CODcr去除率、污泥SV30和S/C的影響結果如圖1(d)所示。隨著H2O2投加間隔時間的增加,CODcr去除率呈現出上升趨勢,SV30和S/C呈現出下降趨勢,在H2O2投加間隔時間為25 min時CODcr去除率達到81.67%,S/C為7.5×10-2mL/mg,繼續延長投加間隔時間,CODcr去除率、S/C、SV30幾乎保持不變,出現該現象的原因是由于在調節H2O2的投加間隔時間初期,更長的反應時間有利于·OH的有效產出,以此降解水中的污染物,然而隨著投加間隔時間的增長,Fenton反應有充足的反應時間充分完成,隨后體系內達到穩定狀態,因此繼續增加反應時間CODcr去除率、SV30和S/C并無明顯變化,因此綜合考慮認為最佳的投加間隔時間為25 min。
2.2 Fenton污泥分析
2.2.1 Fenton污泥熱性質分析
近些年來市政污泥的熱處理技術不斷發展,尤其是污泥熱處理技術獲得了較多的實際運行以及研究關注,因此對FS進行了TG/DSC測試,測試結果如圖3所示。由圖3(a)可知,Fenton污泥在整個升溫過程中的總失重率為15.59%,并且在174.51 ℃處出現了第一個臺階狀,在424.93 ℃處出現了第二個臺階狀,這表明升溫過程中的失重為兩個連續的階段(第一階段失重未結束,第二階段失重便開始發生)。結合DTG曲線中呈現肩膀狀的兩處特征峰(兩峰的峰值溫度分別為107.75和248.51 ℃)可知,第一段失重發生在174.51 ℃以前,失重率為6.19%;第二段失重發生在174.51~424.93 ℃,失重率為9.40%。由圖3(b)可知,在DSC曲線中同樣出現了兩處峰,第一處為吸熱峰(峰值溫度117.46 ℃),第二處為放熱峰(峰值溫度237.18 ℃)。因此,FS的熱處理過程中存在至少兩個類型的反應依次發生。在500 ℃之后的升溫過程中無明顯的質量和能量變化,說明FS在熱處理過程中主要的反應發生在424.93 ℃之前。據此可以推測第一階段反應主要是Fenton污泥中吸附水和層間水的脫出以及有機物的揮發,對應著吸熱現象;第二階段反應主要為Fenton污泥中鐵氧化物的轉變,對應著放熱現象。

圖3 FS 在升溫速率為10 ℃/min下的TG/DSC曲線
2.2.2 FS的XRD,FT-IR分析
FS的熱性質分析結果表明,在熱處理溫度超過500 ℃后,明顯的失重和熱值變化已不再被觀察到,因此表明FS在超過500 ℃的處理溫度后,內部除了因微弱的鹽類水解反應而產生極微量的氣體逸散之外,已不再發生任何重要反應。以500 ℃熱處理作為對比依據,對兩種樣品FS-1(未500 ℃熱處理)、H-FS-1(500 ℃熱處理)進行表征測試。
兩種樣品的XRD測試結果如圖4所示。由圖4(a)可以看出,FS-1中未檢出任何晶體,這說明FS中物質以非晶體的形式存在。然而當FS-1被500 ℃熱處理后(即H-FS-1),在2θ為24.20,33.25,35.69,41.01,49.56,54.07,57.62,62.54和64.09 °處卻出現了9個衍射峰,分別對應Fe2O3的(012)(014)(110)(113)(024)(116)(112)(214)和(300)晶面。同時,2θ為62.54,64.09°處的衍射峰也對應著FeOOH的(002)(112)晶面。Fe2O3和FeOOH晶體的生成表明FS中的非晶物質主要以鐵化合物形式存在。據研究可知[15],這種將堿液直接滴入Fe3+溶液中得到的沉淀物并不是傳統意義上的Fe(OH)3,而是不定形的水合氧化鐵(HFO)。

圖4 FS-1,H-FS-1的XRD,FT-IR檢測結果
由圖4(b)可以看出,在FS-1中,波長1620 cm-1處為吸附水分子的振動峰[16],波長3350 cm-1處為-OH的特征峰[17],波長454 cm-1為Fe-O特征峰[18]。而在熱處理后的H-FS-1中吸附水分子振動峰消失;但在3317 cm-1處仍可觀察到微弱的-OH特征峰(2.2.4節中將通過XPS測試進一步確定H-FS-1中-OH的存在),454 cm-1處Fe-O峰值偏移到475,543 cm-1處形成新的Fe-O特征峰。FS-1中存在Fe-O特征峰和大量-OH的特征峰源于FS中HFO的存在,Fe-O特征峰的偏移證明了Fe2O3和FeOOH的生成,而從H-FS-1中并未完全消失的-OH特征峰可以推斷出少量FeOOH的存在。綜上可知,在FS的熱處理過程中HFO穩定性降低,逐漸轉變為Fe2O3。在此過程中可能會因局部受熱不均等原因伴隨著少量FeOOH的生成。
2.2.3 FS的SEM-EDS分析
如圖5所示,FS-1(圖5(a))的主要元素成分為Fe,O和C,分別占總質量的48.00%,34.46%,7.12%,由此可知HFO是FS的主要成分。H-FS-1(圖5(c))的主要元素成分也為Fe,O和C,分別占總質量的51.09%,37.22%,3.12%,與FS-1相比,H-FS-1中C元素含量的降低源自熱處理過程中有機污染物的揮發,而Fe,O元素的含量占比幾乎未變說明HFO向Fe2O3和FeOOH的轉變是FS在熱處理過程中的主要反應。在SEM圖像中可以明顯地觀察到上述變化。在熱處理前的FS-1中存在大量的松散態顆粒,這些顆粒并無明顯的形態特征,對應著無定形的HFO。而在熱處理后的H-FS-1中出現大量球狀物質和部分桿狀物質,未觀察到松散顆粒,球狀物質和桿狀物質分別對應著Fe2O3晶體以及FeOOH晶體。

圖5 FS-1,H-FS-1的EDS和SEM測試結果
2.2.4 FS的XPS分析
采用XPS技術對FS-1,H-FS-1中的O元素和Fe元素化學狀態進行分析。由圖6(a)可以看出,711.2 和724.9 eV分屬于Fe 2p3/2和Fe 2p1/2的結合能,719.1 和733.2 eV均屬于振蕩衛星峰的結合能,均屬于三價Fe的特征[19],可見熱處理前后Fe元素的價態保持不變,均以三價Fe的形式存在于FS中。由圖6(b)可以看出,530.1 eV屬于Fe-O鍵的結合能,531.4 eV屬于-OH鍵的結合能[20]。經熱處理后,H-FS-1相比較于FS-1,Fe-O鍵峰面積明顯增大,-OH鍵峰面積相應減少。這表明熱處理前后的FS均含有鐵氧化物,而-OH鍵的減少源自于Fenton污泥中水分的脫出和HFO的轉變,但未完全消失也證明了含-OH化合物的存在,可以進一步的說明熱處理后的產物具有FeOOH,與上述表征結果分析一致。

圖6 FS-1,H-FS-1的XPS圖譜
3 結論
1) 將Fenton污泥產生量作為考察指標之一,通過S/C指標優選出了最佳反應條件,即m(Fe2+)∶m(H2O2)=2∶1,初始pH=5.5,H2O2投加量70 mL/L,H2O2間隔投加時間25 min。
2) TG/DTG/DSC曲線表明,Fenton污泥在熱處理過程中的兩個連續失重反應均發生在500 ℃之前。XRD,FT-IR,SEM測試結果表明,在FS熱處理過程中,無定形的HFO會轉變為球形的Fe2O3晶體和少量桿狀的FeOOH晶體;EDS測試結果表明,Fenton污泥的主要成分為無定形的HFO,HFO的轉變是第二階段的主要反應;XPS測試結果表明,Fe元素均以三價Fe的形式存在于熱處理前后的FS中的同時,也進一步證明熱處理后FS中FeOOH的存在。

