微生物菌劑對連作地塊草莓生長、土壤養分及微生物群落的影響
楊肖芳 郭 瑞 姚燕來 朱為靜 洪磊東 洪春來 朱鳳香 王衛平
(1浙江省農業科學院園藝研究所,浙江 杭州 310021;2浙江省農業科學院環境資源與土壤肥料研究所,浙江 杭州 310021;3湘湖實驗室,浙江 杭州 311231)
草莓(Fragaria×ananassaDuch.)為薔薇科草莓屬多年生草本植物,因果實色澤艷麗、口感鮮美,且富含維生素、礦質元素、胡蘿卜素、鞣酸、類黃酮和花青素等多種營養物質而深受消費者喜愛,擁有較大市場需求量[1]。據聯合國糧農組織(Food and Agriculture Organization of the United Nations,FAO)最新統計,2018年世界草莓總產量達到833.71萬噸,我國草莓年生產量占世界草莓總產量的35.6%,是世界草莓生產量最大的國家[2]。設施農業的興起實現了草莓的周年生產,但重茬導致的連作障礙問題嚴重制約了草莓的生產和發展[3]。草莓連作障礙形成的原因主要包括土壤理化性質劣變[4-6]、土壤微生物群落變化[7-8]以及化感物質自毒作用[9-11]等。而土壤微生物群落結構的失衡是造成草莓連作障礙的主要原因[12]。研究發現,隨著草莓連作年限的增長,土壤中的細菌、放線菌種類及數量呈現逐年減少的趨勢,而土壤中真菌的種類及數量明顯增加[13]。許多真菌,如灰霉病菌(Botrytis cinerea)[14]、草莓黃斑球藻菌(Sphaerotheca macularisf.sp.fragariae)[15]、炭疽病菌(Colletotrichum acutatum)[16]、草莓尖孢鐮刀菌(Fusarium oxysporumf.sp.fragariae)[17]等是引起草莓病害的罪魁禍首。隨著人們對生態平衡和可持續發展的重視,生物防治成為解決連作障礙的熱點,其中微生物菌劑的研發與應用在生物防治中發揮重要作用[18]。
微生物菌劑的施用不僅能夠抑制病原菌的生長,改善土壤微生物群落結構[19],還具有增加土壤有效養分含量[20]、提高草莓品質[21]等作用。常用的微生物菌劑菌株資源有芽孢桿菌、假單胞菌、放線菌、固氮菌和乳酸菌等,其中芽孢桿菌微生物菌劑應用廣泛[22-28]。研究表明,某些枯草芽孢桿菌具有抑制草莓根腐病菌、尖孢鐮刀菌和灰霉病菌的功能[29-30]。劉紫英等[31]篩選出的L501 枯草芽孢桿菌能夠降解草莓連作自毒障礙物質苯甲酸,且對根腐病具有拮抗作用,能夠用于修復草莓重茬。柳曉磊等[32]研究發現,含有枯草芽孢桿菌和地衣芽孢桿菌的混合微生物菌劑能夠顯著提升土壤中有效磷、速效鉀和堿解氮的含量。Hong 等[33]發現,芽孢桿菌(Bacillus velezensisCE100)能夠抑制草莓真菌病害并提高產量。周艷孔等[21]發現,向土壤施用植物乳桿菌和解脂耶羅威亞微酵母菌等混合微生物菌劑,不僅能夠顯著促進草莓植株生長和提高產量,而且可以增加果實中可溶性固形物和維生素C的含量。本研究采用大田試驗探究施用不同微生物菌劑對草莓生長和產量的影響,并對草莓土壤中的養分含量和微生物群落進行分析,探索微生物菌劑促生、抗病的作用機制,旨在為草莓產業的可持續發展提供生防材料和理論支撐。
1 材料與方法
1.1 試驗材料與方案
試驗于2020年9月—2021年4月在浙江省農業科學院海寧市楊渡科研創新基地大棚(120.4114°E,30.4406°N)進行,試驗地連續種植草莓10年,土壤基本理化性質為有機質25.87 g·kg-1,全氮1.55 g·kg-1,堿解氮146.49 mg·kg-1,有效磷118.82 mg·kg-1,速效鉀123.35 mg·kg-1,pH值6.58,電導率(electrical-conductivity,EC)0.69 μs·cm-1。供試草莓品種為浙江省農業科學院園藝研究所培育的越心,定植時間為9月6日,收獲開始時間為11月20日,結束時間為次年4月20日;供試微生物菌劑由浙江省農業科學院環境資源與土壤肥料研究所研制,K1 號抗病菌劑為單一微生物菌劑,其主要成分是解淀粉芽孢桿菌WSW1(對尖孢鐮刀菌、茄病鐮刀菌等多種病原菌有顯著拮抗作用),有效活菌數量為1.01×109CFU·mL-1;NKY1 號抗病促生菌劑為復合微生物菌劑,由解淀粉芽孢桿菌WSW1和阿耶波多氏芽孢桿菌JHIJ2-2(具有解磷、解鉀、產吲哚乙酸和產嗜鐵素等功能)組成,有效活菌數量為2.1×109CFU·mL-1;供試復合肥購于杭州好多收農資店,N-P2O5-K2O 組成為17-17-17。
試驗采用塑料大棚雙層保溫促成設施栽培方式,在同一大棚內設置1 個對照和2 個微生物菌劑處理。所有處理按照常規施用肥料即底肥每畝撒施兔糞1 000 kg、菜籽餅300 kg和復合肥15 kg后灌水悶棚,悶棚結束后定植草莓苗,后期均追施4 次膨果肥(15-5-30),每次2 kg,共8 kg。CK 處理不施用菌劑;T1 處理施用單一微生物菌劑(K1號抗病菌劑),T2處理施用復合微生物菌劑(NKY1 號菌劑),T1 和T2 處理所使用的菌劑均為成品菌劑,定植時分別用T1 和T2菌劑100倍液蘸根,然后每隔30 d澆灌T1和T2菌劑150倍液,每次每株100 mL;對照用清水蘸根,清水澆灌。每個處理試驗小區面積為20 m2,每小區草莓種植數為200株,株行距為22 cm×45 cm,重復3次,隨機排列。
1.2 測定指標及方法
1.2.1 草莓生長指標和產量的測定 在試驗期間(11月20日—4月20日)定期對每個處理的成熟草莓采摘并進行健康草莓單株產量和小區草莓總產量的測定;在草莓計產結束后統計草莓植株的存活率并采集植株樣品,每個小區隨機選擇20 株統計其莖長、根長和根重。
1.2.2 土壤理化性質的測定 草莓收獲結束后(4月20日),采用五點取樣法對每個小區0~20 cm 的土壤進行采集。依據《土壤農化分析》[34]的方法進行土壤理化性質的測定,其中土壤有機質(organic matter,OM)含量采用氧化還原法經高溫消煮后進行滴定,全氮(total nitrogen,TN)含量采用半微量凱氏定氮法用酸標準溶液滴定,堿解氮(available nitrogen,AN)含量采用堿解擴散法用酸標準溶液滴定,有效磷(available phosphorus,AP)含量采用NaHCO3浸提后用TU-1810紫外可見分光光度計(北京普析通用儀器有限責任公司)檢測,速效鉀(available potassium,AK)含量用CH3COONH4浸提后用BWB-1 火焰分光光度計(BWB Technologies,英國)檢測,pH 和EC 值分別用PB-10 pH計(德國Sartorius 公司)和DDSJ-308F 電導率儀(上海儀分科學儀器有限公司)進行測定(水土比為2.5∶1)。
1.2.3 土壤微生物多樣性的測定 對草莓收獲結束后采集的土壤樣品進行微生物多樣性測定。高通量測序分析由上海美吉生物醫藥科技有限公司完成。主要試驗流程:取0.25 g 充分混勻的土壤樣品,采用Powersoil?DNA 提取試劑盒(MOBIO Laboratories Inc.,美國)提取土壤微生物總的基因組DNA,用瓊脂糖凝膠電泳檢測純度和濃度,并稀釋至1 ng·μL-1。分別采用帶標記的細菌通用引物515F(5'-GTGCCAGCMGCC GCGG-3')-806R(5'-GGACTACHVGGGTWTCTAAT-3')和真菌通用引物ITS1F(5'-CTTGGTCATTTAGAGGAA GTAA-3')-ITS2R(5'-GCTGCGTTCTTCATCGATGC-3')特異性引物擴增土壤細菌16S rRNA 基因區域和土壤真菌ITS 基因區域。之后按照美吉公司提供的標準方法,在Illumina MiSeq 平臺(美國Illumina 公司)上將原始數據進行質量過濾和合并后,在97%的相似水平下進行聚類、獲得分類操作單元(operational taxonomic unit,OTU)。對OTU 序列進行物種注釋,并分別在各個分類水平統計各樣本的群落組成。使用QIIME 1.9.1 計算ACE 指數、Chao1 指數、香農指數(Shannon)和辛普森指數(Simpson)。
1.3 數據處理與分析
采用Microsoft Excel 2016 軟件處理試驗數據;運用GraphPad Prism 9 軟件的單因素方差分析(ANOVA)和Tukey 檢驗功能進行差異顯著性檢驗,并用GraphPad Prism 9 軟件制作圖表;運用Canoco5 軟件進行相關性冗余分析。
2 結果與分析
2.1 微生物菌劑對草莓生長和產量的影響
由圖1-A 可知,與CK 相比,施用微生物菌劑處理(T1、T2)均能促進草莓植株的生長。T1 和T2 的植株莖長分別較CK 顯著增加41.73%和34.41%(圖1-B),植株根長顯著增加10.99%和16.45%(圖1-C);T1 的植株根重較CK 增加17.67%,但未達到顯著水平,T2的植株根重分別較CK 和T1 顯著增加72.52% 和46.61%(圖1-D)。
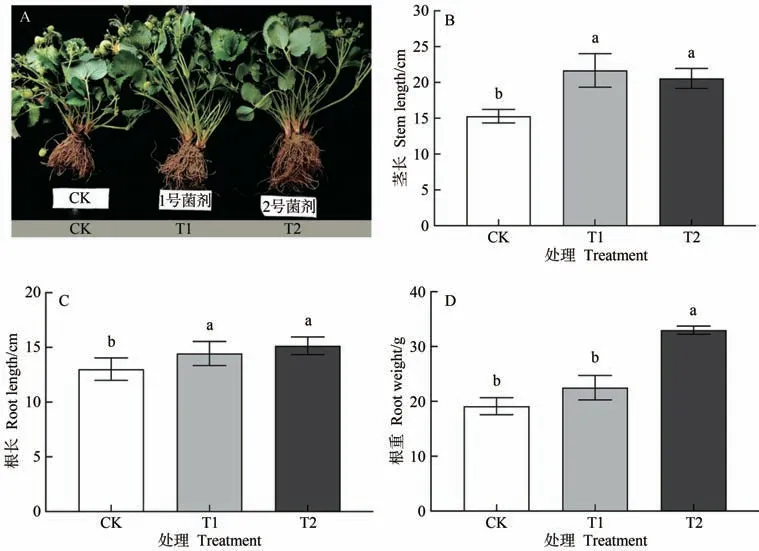
圖1 不同處理下草莓莖長、根長和根重的變化Fig.1 Changes in strawberry stem length,root length and root weight under different treatments
由圖2 可知,CK 植株存活率為64.26%,T1、T2 植株存活率顯著高于CK,分別達到了82.25% 和89.45%。對于健康的草莓植株,CK、T1、T2 單株草莓平均產量分別為554.68、573.98、603.94 g,且各處理間無顯著差異,表明T1、T2 并不會提高健康草莓植株的單株平均產量。與CK 相比,T1 和T2 草莓總產量分別顯著提高30.16%和41.79%。草莓總產量與植株存活率之間存在線性相關關系,表明不同處理間草莓總產量的增加主要得益于植株存活率的提高。

圖2 不同處理下草莓存活率和產量的變化Fig.2 Changes in strawberry survival rate and yield under different treatments
2.2 微生物菌劑對草莓土壤理化性質的影響
由表1 可知,CK 和T1 土壤pH 值無顯著差異,T2土壤pH 值顯著低于CK 和T1,分別降低3.51%和4.10%。與CK 相比,T1、T2 均不同程度地顯著增加了土壤EC 值,分別增加8.19%和22.93%。三組處理的EC 值均在500 μs·cm-1以上,呈輕度鹽漬化趨勢[35]。T1、T2 土壤有機質和全氮含量較CK 無顯著差異。與CK 相比,T1、T2 的土壤堿解氮含量分別顯著降低11.49%和6.28%。CK 和T1 土壤有效磷之間無顯著差異,T2 土壤有效磷含量分別較CK 和T1 顯著增加18.31%和20.01%;T1 和T2 土壤速效鉀含量分別較CK 增加16.27%和55.27%,其中T2 顯著高于CK 和T1;這可能是微生物菌劑中的微生物具有解磷和解鉀作用導致的。
2.3 微生物菌劑對草莓土壤微生物群落結構的影響
2.3.1 不同處理下土壤微生物OTU 水平群落組成分析 如圖3所示,土壤細菌測序結果中,三組處理共有OTU 數為2 960 個,占總細菌總OTU 數量的99.62%。土壤真菌測序結果中,三組處理共有的OTU 數為264 個,占真菌總OTU 數量的39.46%,CK、T1、T2 處理特有OTU 數分別占真菌總OTU 數量的5.98%、22.87%、7.03%。上述結果表明,三組處理土壤細菌組成較為相似,而真菌組成差異較大。
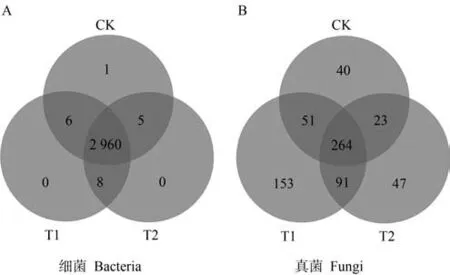
圖3 土壤細菌(A)和真菌(B)在OTU水平上的群落組成韋恩圖Fig.3 Venn diagram of community composition of soil bacteria(A)and fungi(B)at the OTU level
2.3.2 不同處理下土壤微生物門水平群落組成分析 在門水平上分別對不同處理土壤中細菌和真菌豐度排名前十的物種進行差異性分析。由圖4 可知,細菌群落中所有處理的優勢菌門均為厚壁菌門(Firmicutes),占26.06%~27.97%,其次為變形菌門(Proteobacteria)和綠彎菌門(Chloroflexi)。與CK相比,T1、T2 中類芽孢桿菌門(Gemmatimonadota)的相對豐度分別降低0.62 和1.01 個百分點,其中T2 處理達到顯著水平(P<0.05);T1、T2 擬桿菌門(Bacteroidota)的相對豐度分別增加了0.67 和0.49 個百分點,其中T1達到顯著水平(P<0.05)。真菌群落中所有處理的優勢菌門均為子囊菌門(Ascomycota),占64.4%~71.08%。施用微生物菌劑均提高了土壤中羅澤菌門(Rozellomycota)和毛霉菌門(Mucoromycota)的相對豐度。與CK 相比,羅澤菌門和毛霉菌門在T2 中的相對豐度分別顯著增加3.51(P<0.05)和0.49 個百分點(P<0.001);T1、T2 中擔子菌門(Basidiomycota)的相對豐度分別減少6.64和5.19個百分點,但未達到顯著水平。從門水平上看,微生物菌劑的施用對細菌群落影響較小,而對真菌群落影響較大。
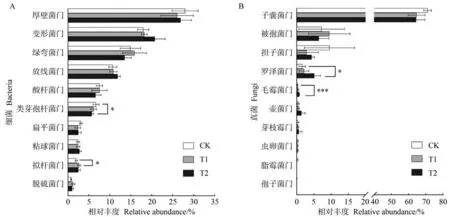
圖4 土壤細菌(A)和真菌(B)在門水平上的群落組成差異圖Fig.4 Diagram of differences in community composition of soil bacteria(A)and fungi(B)at the phylum level
2.3.3 不同處理下土壤微生物屬水平群落組成分析 在屬水平上分別對不同處理土壤中細菌和真菌豐度較高的十個物種進行差異性分析。由圖5 可知,細菌群落中所有處理的優勢菌屬均為芽孢桿菌屬(Bacillus),占10.08%~10.98%。與CK 相比,T1、T2 中鞘氨醇單胞菌屬(Sphingomonas)的相對豐度分別降低0.27 和0.19 個百分點,其中T1 達到顯著水平(P<0.05)。真菌群落中所有處理的優勢菌屬均為曲霉屬(Aspergillus),占40.12%~54.74%。與CK 相比,T1、T2 中曲霉屬的相對豐度分別降低8.78 和14.62 個百分點,青霉屬(Penicillium)的相對豐度分別降低1.65和1.79 個百分點,均在T2 達到顯著水平(P<0.01);T1、T2 中根霉屬(Rhizopus)的相對豐度分別增加了0.16 和0.49 個百分點(P<0.001),假霉樣真菌屬(Pseudallescheria)的相對豐度分別增加0.31和1.98個百分點(P<0.05),均在T2達到顯著水平。從屬水平上同樣看出,微生物菌劑的施用對細菌群落影響較小,而對真菌群落影響較大,其中T2對真菌群落組成的影響大于T1。
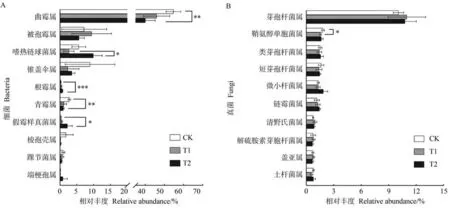
圖5 土壤細菌(A)和真菌(B)在屬水平上的群落組成差異圖Fig.5 Diagram of differences in community composition of soil bacteria(A)and fungi(B)at the genus level
2.4 微生物菌劑對草莓土壤微生物群落多樣性的影響
2.4.1 不同處理對土壤細菌群落多樣性的影響 由表2 可知,從細菌群落豐富度指數角度分析,與CK 相比,T1、T2 的土壤細菌群落ACE 指數分別降低1.03%和0.43%,Chao1 指數分別降低1.07%和0.56%。從細菌群落多樣性指數角度分析,CK、T1、T2土壤細菌群落的Shannon 指數分別為6.77、6.74、6.79,Simpson 指數分別為0.003 3、0.003 5、0.003 2,各處理間無顯著差異。綜上,微生物菌劑的施用對土壤細菌群落的豐富度和多樣性影響較小。
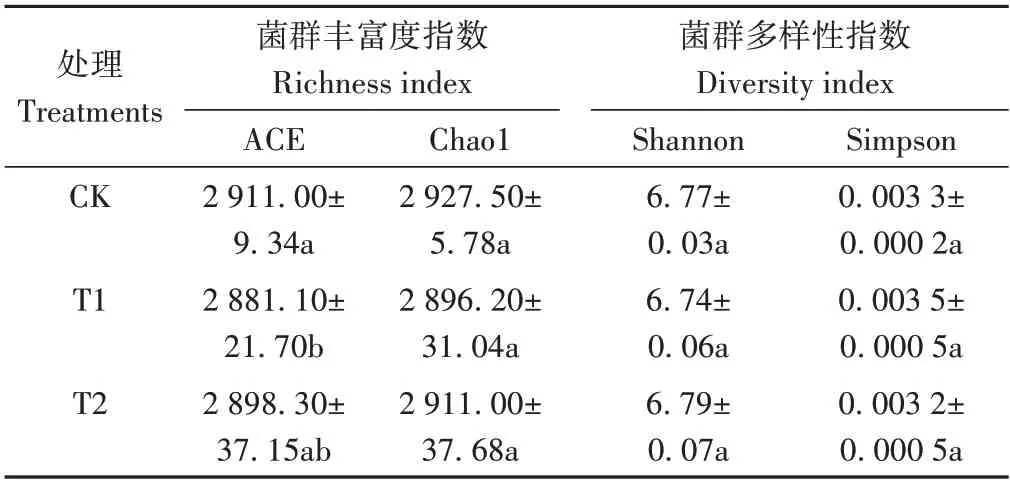
表2 不同處理下土壤細菌群落的Alpha多樣性指數變化Table 2 Changes of Alpha diversity index of bacterial community under different treatments
2.4.2 不同處理對土壤真菌群落多樣性的影響 如表3所示,從真菌群落豐富度指數角度分析,與CK 相比,T1、T2 的土壤真菌群落ACE 指數分別顯著增加36.95%和22.16%;Chao1 指數分別顯著增加36.76%和19.61%。從真菌群落多樣性指數角度分析,T1 和T2 的土壤真菌群落Shannon 指數分別較CK 顯著增加了22.52%和34.23%;Simpson 指數分別降低25.81%和54.84%。表明微生物菌劑的施用明顯提高了土壤中真菌群落的豐富度和多樣性。
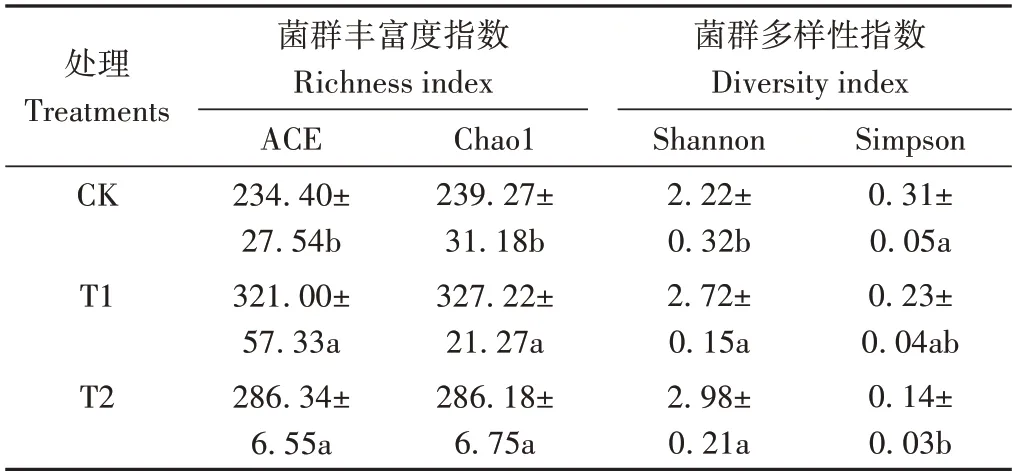
表3 不同處理下土壤真菌群落的Alpha多樣性指數變化Table 3 Changes of Alpha diversity index of fungal community under different treatments
2.5 不同處理下草莓土壤微生物群落結構與土壤理化性質的相關性分析
將細菌和真菌群落中豐度排名前十的屬與土壤環境因子pH值、電導率(EC)、堿解氮(AN)、有效磷(AP)、速效鉀(AK)進行冗余分析。由圖6可知,CK、T1、T2分布在不同的區域,表明不同處理對土壤理化性質和微生物群落結構具有較大的影響。T2與AP、AK、EC處于同一方向,與pH 值為相反方向,表明T2能夠提高土壤速效養分含量,但會造成土壤EC值增加和pH值降低。
圖6-A為細菌群落-土壤環境因子冗余分析圖,其軸1 特征值為33.65%,軸2 特征值為20.20%,兩軸共同解釋了53.85%的信息。其中AN是影響細菌群落結構的主要土壤因子,鞘氨醇單胞菌屬(Sphingomonas)相對豐度與AN 呈正相關,蓋亞屬(Gaiella)、清野氏菌屬(Planifilum)、芽孢桿菌屬(Bacillus)、類芽孢桿菌屬(Paenibacillus)、短芽孢桿菌屬(Brevibacillus)相對豐度與AN 呈負相關。AP、AK、EC 對細菌群落結構影響較大,微小桿菌屬(Microvirga)、鏈霉菌屬(Streptomyces)、土桿菌屬(Tumebacillus)相對豐度與AP、AK、EC呈正相關,解硫胺素芽胞桿菌屬(Aneurinibacillus)與AP、AK、EC呈負相關。
圖6-B為真菌群落-土壤環境因子冗余分析圖,其軸1特征值為44.78%,軸2特征值為19.92%,兩軸共同解釋了64.70%的信息。其中AK、EC 是影響真菌群落結構的主要土壤因子,假霉樣真菌屬(Pseudallescheria)、端梗孢屬(Acrophialophora)、嗜熱鏈球菌屬(Mycothermus)相對豐度與AK、EC 呈正相關,被孢霉屬(Mortierella)、梭孢殼屬(Thielavia)、曲霉屬(Aspergillus)、青霉屬(Penicillium)、踝節菌屬(Talaromyces)、錐蓋傘屬(Conocybe)相對豐度與AK、EC呈負相關。其次對真菌群落結構影響較大的土壤因子為AN,根霉屬(Rhizopus)相對豐度與AN呈負相關關系。大量致病真菌相對豐度與CK 呈正相關關系,而與T1、T2呈負相關關系,表明微生物菌劑施用能夠有效改善土壤真菌群落結構。
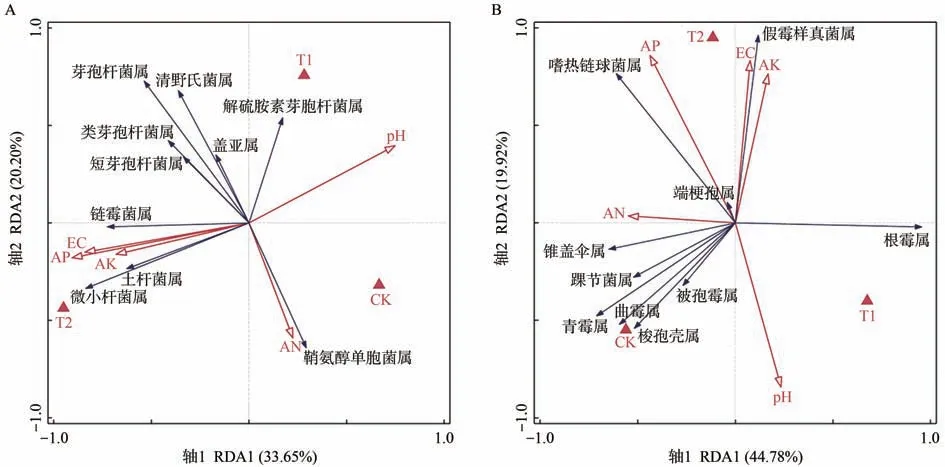
圖6 土壤細菌群落-土壤環境因子(A)和真菌群落-土壤環境因子(B)冗余分析Fig.6 Redundancy analysis of soil bacterial community - soil environmental factors(A)and fungal community - soil environmental factors(B)
3 討論
3.1 微生物菌劑對草莓生長和產量的影響
多年連作使得草莓長勢變弱、抗病能力變差,雖然采用農藥防治在一定程度上減少了病害發生,但植株恢復能力差,死苗率高,造成草莓減產問題突出[36]。連作造成的地下部土壤微生物組成和養分失衡和草莓病害是導致草莓死亡進而造成減產的重要原因。近年來,單一或復合微生物菌劑對不同作物生長、產量以及土壤性狀影響的研究取得了較大進展[37-39]。如果菌種之間存在協同作用,兩種或者多種抗病菌和促生菌混合制成的復合微生物菌劑將對土壤連作障礙的防治和植株生長具有更好的效果[39]。本研究發現,單獨施用抗病菌解淀粉芽孢桿菌WSW1(T1)能夠顯著促進草莓植株的生長,提高草莓的存活率和產量,表明抗病菌解淀粉芽孢桿菌WSW1 在田間也具有良好的抑菌作用;復合施用抗病菌解淀粉芽孢桿菌WSW1 和促生菌阿耶波多氏芽孢桿菌JHIJ2-2(T2)能夠進一步提高草莓的存活率和產量,表明促生菌阿耶波多氏芽孢桿菌JHIJ2-2能夠為草莓提供更多的養分以促進草莓生長,提高草莓抗病性。綜上,抗病菌解淀粉芽孢桿菌WSW1 和促生菌阿耶波多氏芽孢桿菌JHIJ2-2 之間可能存在協同作用,復合施用更有利于土壤連作障礙的防治和草莓的增產。
3.2 微生物菌劑對土壤養分的影響
微生物菌劑的施用會影響土壤養分循環過程,進而影響植物對養分的吸收和生長[40]。本研究中,復合微生物菌劑的施用能夠顯著增加土壤有效磷和速效鉀含量,這可能是由于微生物菌劑中所使用的芽孢桿菌具有解磷和解鉀的功能。目前已有大量具有解磷、解鉀功能的芽孢桿菌從土壤中被篩選出來,且證實將其添加到土壤中能夠顯著提高土壤有效磷和速效鉀含量[41-42]。本研究發現,與對照相比,施用微生物菌劑的土壤堿解氮含量顯著降低,這可能是由于微生物菌劑的施用促進了植株的快速生長,植株吸收了大量堿解氮從而導致土壤堿解氮含量降低[43]。
3.3 微生物菌劑對土壤微生物群落的影響
土壤微生物是土壤生態系統的重要組成部分,能夠促進土壤有機質的分解和養分的吸收、轉化[44]。土壤微生物群落結構的失衡是導致草莓連作障礙的主要原因[45]。本試驗表明,微生物菌劑處理能夠很大程度地增加土壤真菌的豐富度和多樣性,但對土壤細菌群落的影響較小,這與前人研究結果一致[19,32]。
大量研究發現,土壤細菌群落中的主要優勢菌門通常為變形菌門和綠灣菌門,厚壁菌門所占的比例低于上述兩個細菌門[12,32,46]。而本研究中厚壁菌門成為優勢菌門,這可能是土壤中的芽孢桿菌屬比例較高所致,其菌群組成差異可能與地域有很大關系。真菌群落中的優勢菌門為子囊菌門,其在土壤中的比例遠高于其他真菌門類,與大量關于土壤多樣性的研究發現一致[28,46]。
本研究發現,微生物菌劑的施用增加了土壤中芽孢桿菌屬的豐度,這可能是所施用微生物菌劑中的解淀粉芽孢桿菌WSW1 和阿耶波多氏芽孢桿菌JHIJ2-2在土壤中達到了良好定殖的體現。有研究發現,曲霉屬的黃曲霉菌能夠侵染農作物,導致相關農產品被黃曲霉毒素污染,危及食品安全和人類健康[47]。也有研究證實,曲霉屬和青霉屬均能分泌赭曲霉毒素A 等有毒次級代謝產物,具有強烈毒性[48]。本研究中,曲霉屬是真菌群落中的優勢屬,微生物菌劑的施用減少了曲霉屬以及青霉屬的相對豐度,具有減少作物毒素積累的潛在能力。復合微生物菌劑處理(T2)能夠增加土壤中嗜熱鏈球菌屬的豐度,這可能是由于T2使土壤pH 值顯著降低,而嗜熱鏈球菌屬具有較強的耐酸性[49]。
4 結論
本研究發現,微生物菌劑特別是復合微生物菌劑的施用促進了草莓植株的生長,顯著提高了草莓存活率和產量。復合微生物菌劑的施用能夠有效改善土壤養分含量,使土壤有效磷和速效鉀含量顯著增加。同時,微生物菌劑提高了土壤真菌群落的豐富度和多樣性,但對土壤細菌群落影響較小;微生物菌劑施用導致芽孢桿菌屬豐度增加,真菌曲霉屬和青霉屬的豐度降低。綜上,本研究使用的微生物菌劑特別是復合微生物菌劑對草莓生長、土壤養分和微生物群落具有良好的促進、改善作用,有利于草莓增產和連作障礙的防治。

