基于網絡藥理學和分子對接探討“黃連-茵陳”治療慢性萎縮性胃炎機制※
李 澤 楊 柳 高云霄 胡婧楠 張 彤 王小天 李博林△
(1.河北中醫學院第一附屬醫院脾胃三科,河北 石家莊 050011;2.河北省濁毒證重點實驗室,河北 石家莊 050011;3.河北省脾腎病證中醫治療技術創新中心,河北 石家莊 050011;4.河北醫科大學第四醫院呼吸內科,河北 石家莊 050011;5.河北中醫學院2022級博士研究生,河北 石家莊 050090)
慢性萎縮性胃炎(chronic atrophic gastritis,CAG)是指胃黏膜上皮遭受反復損害而導致固有腺體減少,伴或不伴腸腺化生和(或)假幽門腺化生的一種慢性胃部疾病,被公認為屬于胃癌前病變[1]。CAG屬于中醫學“胃痛”“痞滿”范疇,中醫藥在CAG的治療中發揮了重要的作用。國醫大師李佃貴教授的濁毒理論認為,濁毒貫穿于CAG發生發展的始終,并提出運用化濁解毒法治療CAG,取得了很好的臨床療效[2-3],但化濁解毒法治療CAG的具體機制以及涉及的具體蛋白靶點與通路尚不清楚。前期通過對化濁解毒法治療CAG處方進行數據挖掘表明,“黃連-茵陳”是化濁解毒法治療CAG應用頻次最高的藥對,也是處方中藥物組合關聯規則置信度最高的藥對,最能代表化濁解毒法的核心治則[4]。黃連有清熱瀉火、解毒燥濕之能,茵陳能清利肝膽脾胃濕熱,除濕滯濁停,散熱結毒聚,兩者相須為伍,一偏于利濕化濁,兼能散熱結,一偏于清熱解毒,兼可燥濕濁,實為化濁解毒之經典藥對。相關研究表明,黃連中的活性成分能夠有效抑制炎性反應,抑制相關蛋白酶活性,調節自噬,以保護胃腸黏膜[5-6];茵陳中茵陳色原酮等成分則能夠抑制脂多糖誘導的炎癥基因活化,從而發揮抗炎作用,還可以直接殺傷腫瘤細胞,抑制腫瘤細胞增殖,并促進細胞凋亡[7-8]。本研究采用網絡藥理學和分子對接的方法,分析化濁解毒法代表藥對“黃連-茵陳”治療CAG的作用靶點及可能分子機制,以期探索化濁解毒法治療CAG的具體機制以及涉及的靶點與通路,并為化濁解毒法治療CAG的臨床應用提供合理的理論依據。
1 資料與方法
1.1 一般資料
1.1.1 “黃連-茵陳”藥對有效活性化合物收集及相應靶點預測 通過中藥系統藥理學數據庫與分析平臺(TCMSP)(http://tcmspw.com/tcmsp.php)分別以“黃連”“茵陳”為關鍵詞,以口服生物利用度(OB)≥30%及類藥性(DL)≥0.18為篩選標準,對藥物有效活性化合物進行篩選。再根據有效活性化合物,運用DrugBank數據庫(https://go.drugbank.com)獲取有效活性化合物對應靶點信息,通過UniProt數據庫(https://www.uniprot.org),將物種設置為“Homo sapiens”,搜索各個靶點對應的基因簡稱并進行轉化。
1.1.2 CAG疾病相應靶點預測 通過GeneCards數據庫(https://www.genecards.org)、CTD數據庫(http://ctdbase.org)、TTD數據庫(http://db.idrblab.net/ttd/)及OMIM數據庫(https://omim.org)對CAG疾病靶點進行檢索,以“chronic atrophic gastritis”為關鍵詞,檢索完畢后對檢索疾病靶點進行整合。
1.2 研究方法
1.2.1 獲取“黃連-茵陳”藥對化合物與CAG疾病的交集靶點 通過Venn 2.1.0 網頁軟件對“黃連-茵陳”藥對化合物靶點與CAG疾病靶點進行分析對比,獲取其交集靶點并以韋恩圖形式呈現。
1.2.2 構建“藥物-化合物-靶點-疾病”全局網絡圖 將藥物及其對應化合物,化合物與疾病交集靶點導入Cytoscape 3.6.1,建立“藥物-化合物-靶點-疾病”全局網絡并進行可視化,網絡中Degree值較高的為核心有效成分。
1.2.3 蛋白質-蛋白質相互作用(PPI)網絡構建及可視化 將得到的交集靶點上傳到STRING 11.0數據庫(https://www.string-db.org),得到蛋白互作信息,并將其導入到Cytoscape 3.6.1軟件進行可視化分析,并根據Degree值獲取PPI網絡中的核心靶點。
1.2.4 基因本體(GO)功能富集分析和京都基因與基因組百科全書(KEGG)通路富集分析 將得到的交集靶點導入到DAVID 6.8數據庫(https://david.ncifcrf.gov),對交集靶點進行GO功能富集分析和KEGG通路富集分析,獲得“黃連-茵陳”治療CAG所涉及的分子功能(MF)、細胞組分(CC)、生物過程(BP)和信號通路,最后運用R語言軟件和GraphPad軟件進行可視化。
1.3 核心有效成分與核心靶點的分子對接 將篩選的核心有效成分與PPI網絡中的核心靶點進行分子對接驗證。從結構生物信息學研究合作組織(RSCB)PDB數據庫(https://www.rcsb.org)中下載關鍵靶蛋白的3D結構,并通過Pymol、AutoDock Tools 1.5.6軟件進行去水、去配體和加氫、加電荷的處理。從TCMSP數據庫中下載核心格式為Mol的化合物文件,輸出為pdbqt格式。運用AutoDock Tools 1.5.6 軟件進行分子對接以獲取其結合能,通過Pymol軟件對對接結果進行可視化。
2 結果
2.1 “黃連-茵陳”藥對活性化合物及相應靶點篩選結果 通過TCMSP數據庫,以OB≥30%及DL≥0.18為篩選標準,篩選出黃連活性化合物14個、茵陳13個,去除1個重復化合物后,得到“黃連-茵陳”藥對26個活性化合物。通過DrugBank數據庫獲取有效活性化合物對應靶點信息412個,運用UniProt數據庫對靶點進行去重并刪除其中非人類靶點,得到86個靶點。“黃連-茵陳”藥對活性化合物信息。見表1。

表1 “黃連-茵陳” 藥對活性化合物信息
2.2 CAG疾病靶點及“黃連-茵陳”藥對活性化合物與CAG疾病交集靶點篩選 根據GeneCards、CTD、TTD、OMIM數據庫檢索CAG靶點,去重后共有639個。將CAG疾病靶點與“黃連-茵陳”藥對活性化合物靶點進行對比,共得到38個交集靶點。見圖1。
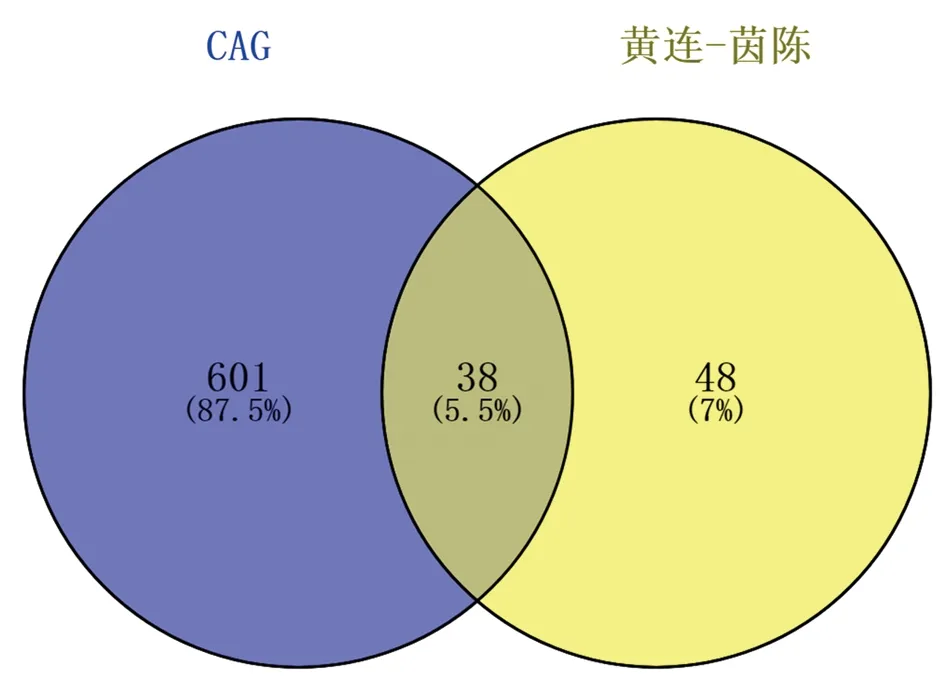
圖1 “黃連-茵陳”藥對活性化合物靶點與CAG靶點韋恩圖
2.3 “藥物-化合物-靶點-疾病”全局網絡圖 應用Cytoscape 3.6.1軟件將“黃連-茵陳”藥對活性化合物與CAG的交集靶點進行“藥物-化合物-靶點-疾病”全局網絡圖可視化,并得到Degree值排名前5的“黃連-茵陳”有效活性化合物為槲皮素、異鼠李素、β-谷甾醇、四氫小檗堿、小檗浸堿,為核心有效成分。見圖2。
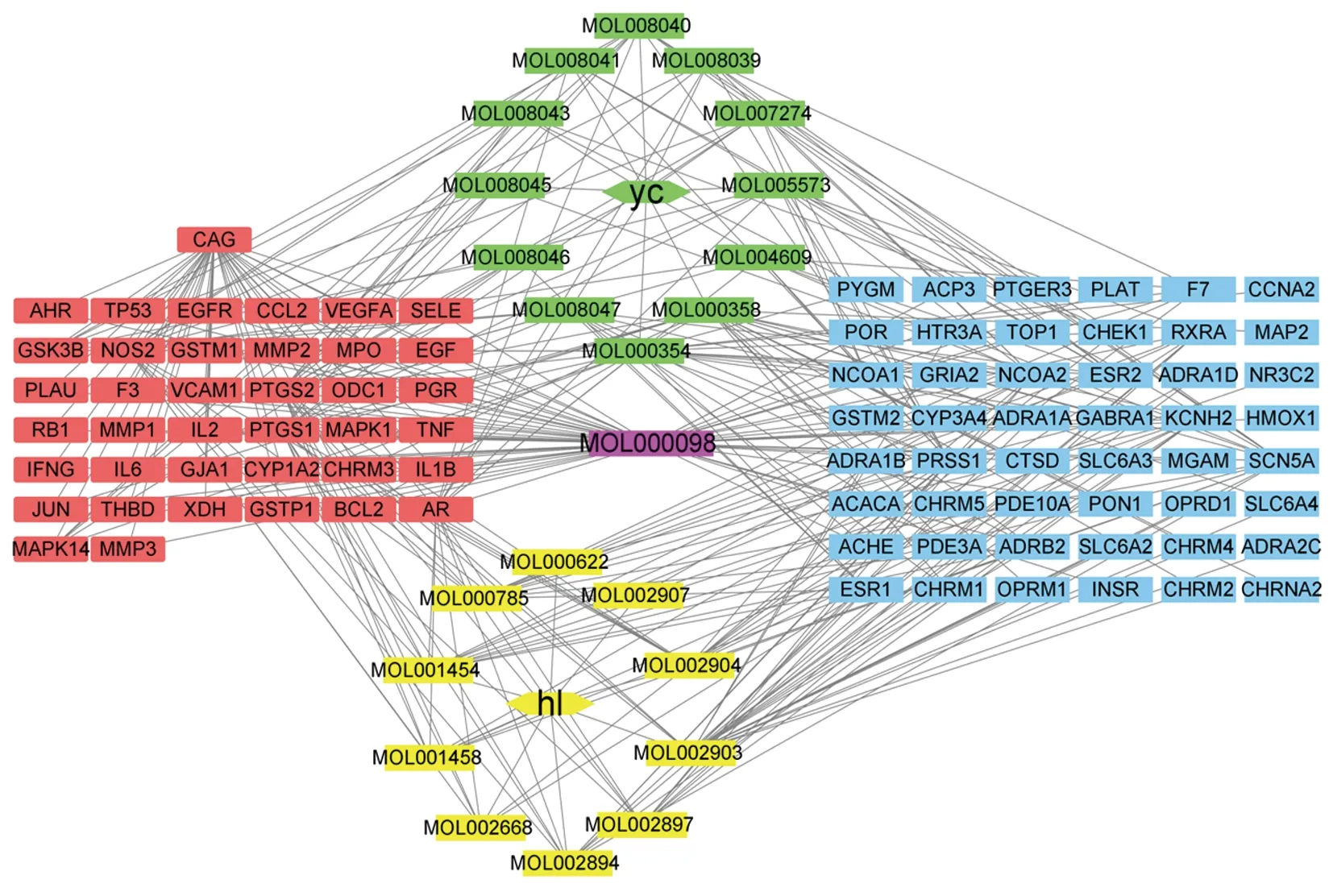
注:綠色為茵陳所屬化合物,黃色為黃連所屬化合物,紫色為黃連-茵陳共有化合物,紅色為化合物與疾病交集靶點,藍色為非交集靶點
2.4 PPI網絡分析 將“黃連-茵陳”藥對活性化合物與CAG的38個交集靶點上傳到STRING 11.0數據庫中進行PPI網絡構建,選擇“Homo sapiens”,設置high confident為0.700,得到精簡PPI網絡信息共有37個節點(刪除1個游離靶點),178個邊,其中靶點為蛋白,邊為蛋白之間作用關系,平均Degree值為9.37,高于平均Degree值的靶點蛋白有16個,包括白細胞介素6(IL-6)、腫瘤壞死因子(TNF)、Ju-Nana原癌基因(JUN)、IL-1β、絲裂原活化蛋白激酶1(MAPK1)等。見圖3、表2。
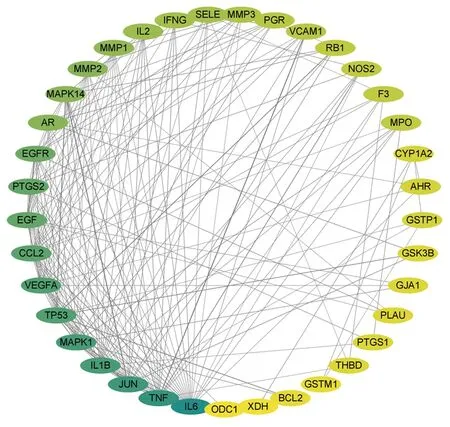
注:節點顏色越黃說明其Drgree值越大,顏色越藍其Drgree值越小;節點之間連線越粗聯系越緊密,越細聯系越少
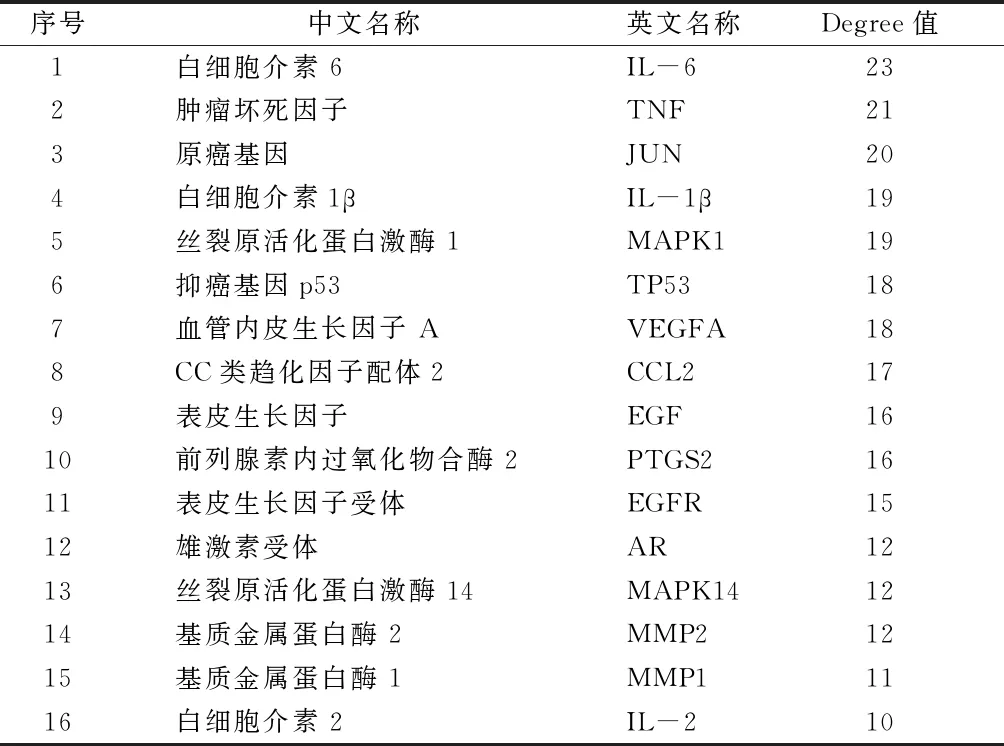
表2 PPI網絡圖中大于平均Degree值的靶點蛋白信息
2.5 GO功能富集分析與KEGG通路富集分析 對“黃連-茵陳”藥對活性化合物與CAG的38個交集靶點分別進行GO功能富集分析與KEGG通路富集分析。通過GO功能富集分析,得到BP 98個,包括基因表達的正調控、細胞對脂多糖的反應、基因表達負調控、細胞增殖的正調控、脂多糖介導的信號通路等;CC 21個,包括細胞外空間、胞外區、細胞表面、線粒體、分泌顆粒等;MF 18個,包括酶結合、轉錄因子結合、細胞因子活性、過氧化物酶活性等。通過KEGG通路富集分析,得到“黃連-茵陳”治療CAG的通路54條,包括癌癥信號通路、TNF信號通路、MAPK信號通路、NF-κB信號通路、EGFR通路等。并進一步繪制了相關性較大的癌癥信號通路圖。見圖4、5、6。
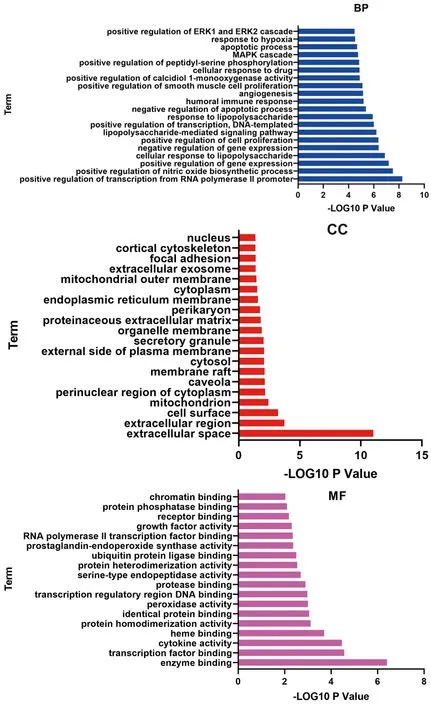
圖4 交集靶點蛋白GO功能富集分析柱狀圖
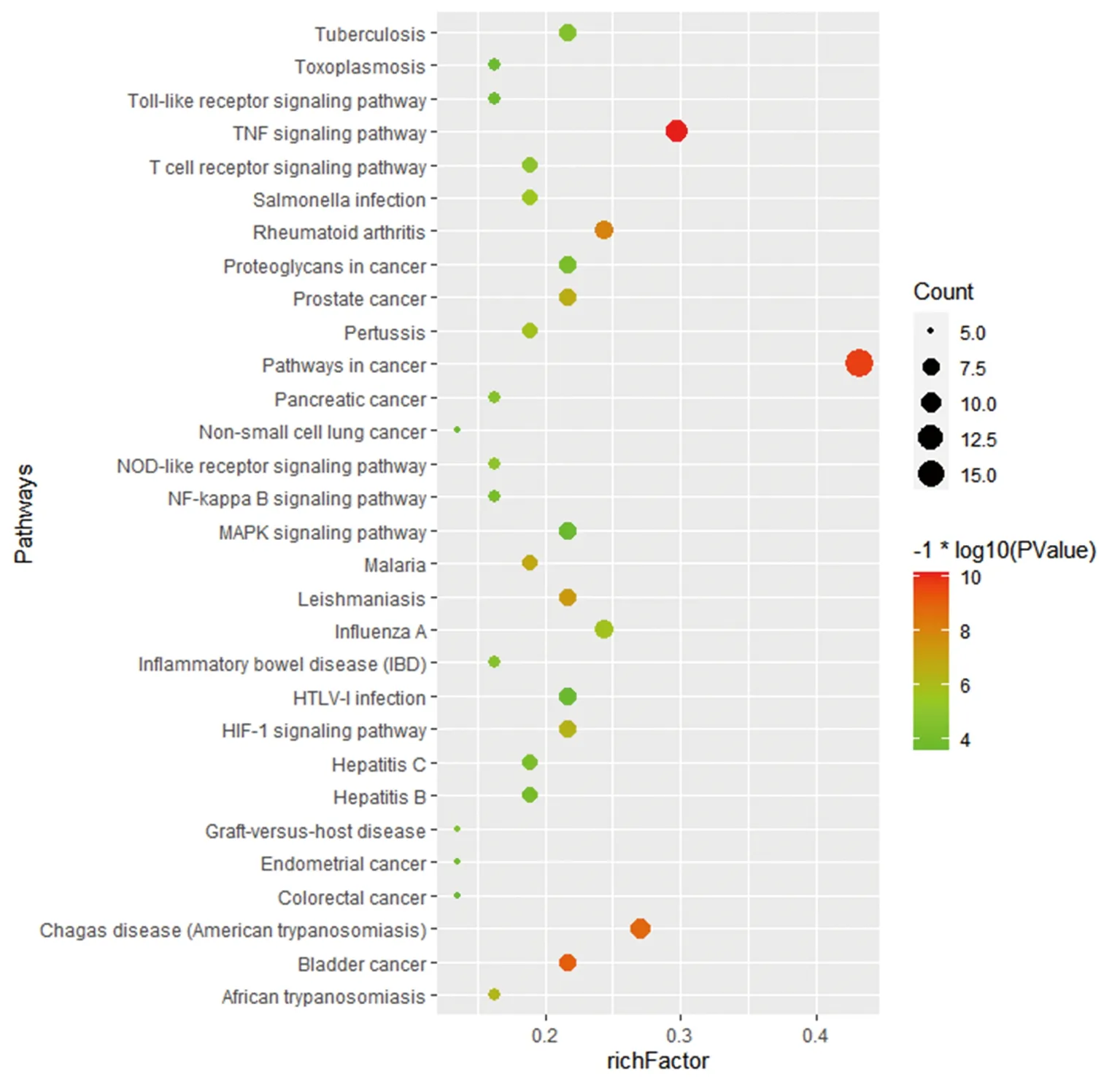
圖5 交集靶點蛋白KEGG通路富集分析氣泡圖
注:紅色靶點為富集分析癌癥信號通路所涉及基因
2.6 分子對接結果 根據“藥物-化合物-靶點-疾病”全局網絡中Degree值選擇前5個“黃連-茵陳”有效活性化合物,包括槲皮素(MOL000098)、異鼠李素(MOL000354)、β-谷甾醇(MOL000358)、四氫小檗堿(MOL002903)、小檗浸堿(MOL002904);根據PPI網絡中Degree值選擇前5個核心靶蛋白,包括IL-6、TNF、JUN、IL-1β、MAPK1。將化合物活性成分與核心靶點蛋白進行分子對接以計算其結合能,化合物與靶蛋白結合能越低,其結合越穩定,越可能相互作用,且結合能量<0代表兩者結合有活性,結合能小于-5 kJ/mol代表結合能活性較高,并對結合能活性較強的2組化合物和蛋白分子對接模式可視化。見圖7、8、9。
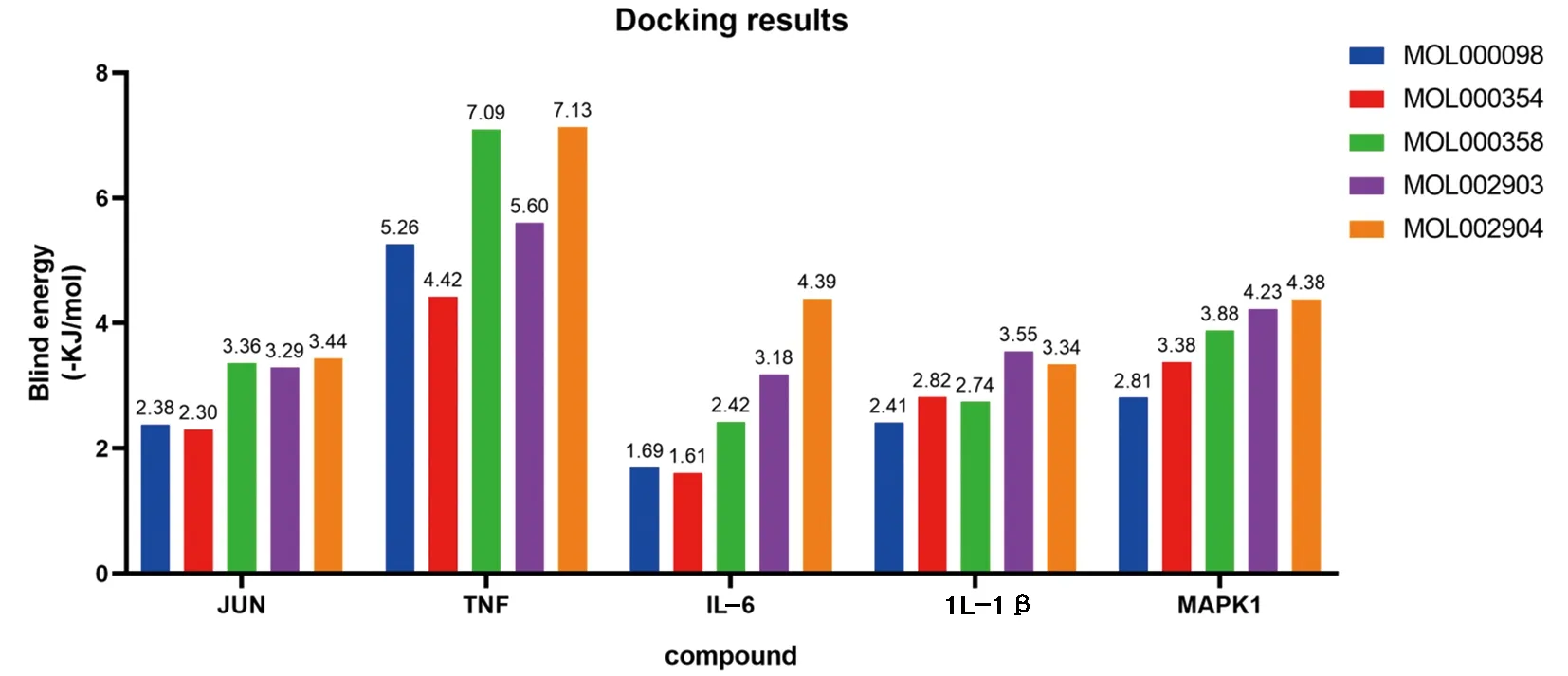
圖7 化合物活性成分與核心靶點蛋白分子對接結合能柱狀圖

圖8 小檗浸堿與TNF對接結果
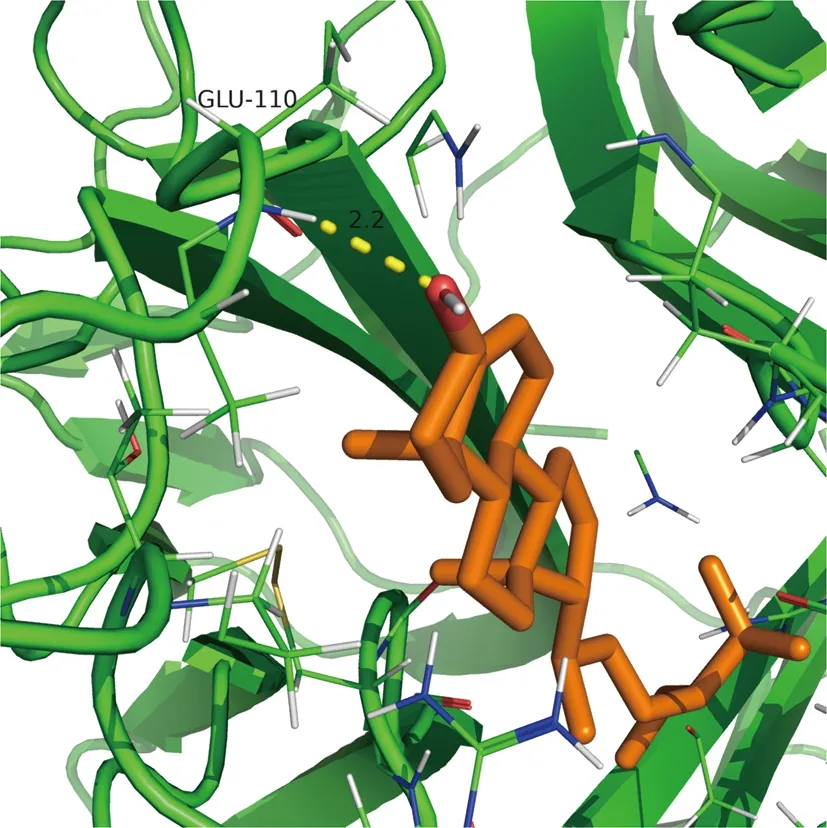
圖9 β-谷甾醇與TNF對接結果
3 討論
我國是胃癌的高發國家,其發病率和死亡率均位居前列,且其癥狀和疾病進展程度不完全相符,胃癌早期患者并無特殊癥狀,因此CAG作為胃癌前病變一直都是臨床關注的重點。現代醫學研究認為,幽門螺桿菌(Hp)是CAG發生的主要病因之一,Hp的致病因素包括脲酶、鞭毛、空泡毒素A(VacA)、細胞毒素相關基因抗原(CagA)等,其中VacA和CagA起著關鍵作用,感染VacA陽性菌株可導致細胞空泡化和凋亡,而感染CagA陽性菌株則可導致嚴重的胃炎和胃癌。CagA是一種關鍵的毒力因子,可以通過啟動細胞核因子κB(NF-κB)、MAPK及細胞質蛋白酪氨酸磷酸酶/細胞外調節蛋白激酶(SHP-2/ERK)途徑,以轉錄和翻譯環氧化酶2(COX-2)、細胞間黏附分子-1(ICAM-1)、誘導型一氧化氮合酶(iNOS)、活性氧(ROS)、IL-6、IL-8、干擾素γ(INF-γ)、TNF-α等細胞因子,從而導致廣泛的炎性反應,促進胃的慢性炎癥、萎縮,乃至于發展為胃癌[9]。最新的胃癌發病機制學說是“炎—癌轉化機制”,該理論認為胃癌的發生發展是在胃的慢性炎癥基礎上伴隨化生、增生而成,同時相關隊列研究亦支持了該觀點[10-12]。因此,及時阻斷甚至逆轉CAG的發展對于防止胃癌的發生有著重要的意義。現代醫學對CAG治療尚無針對性的有效辦法,而中醫藥在阻斷“炎—癌轉化機制”方面頗有成效,李佃貴教授提出的化濁解毒法在CAG治療中有著深遠前景[3]。本研究通過數據庫篩選及網絡圖構建得到“黃連-茵陳”與CAG交集靶點38個,PPI平均Degree值較高的靶點有IL-6、TNF、JUN、IL-1β、MAPK1等,與之相對應的有效活性化合物23個,其中關聯頻數較高的化合物為槲皮素、異鼠李素、β-谷甾醇、四氫小檗堿、小檗浸堿等。
槲皮素是黃酮類化合物,研究表明槲皮素可以抑制Hp的生長,減輕Hp感染小鼠的炎癥和胃損傷,具體機制可能通過降解NF-κB因子,防止NF-κB核轉位,抑制致炎因子如TNF-α、IL-1β、IL-6、IL-8的基因表達,抑制炎癥介質前列腺素、白三烯的形成,阻止組胺的釋放,從而發揮抗炎作用[13-15]。槲皮素還具有抗氧化作用,能緩解Hp感染產生的自由基所引起的胃黏膜細胞DNA氧化損傷[16]。
黃連中的小檗堿類成分在體內外試驗中能有效消滅Hp,并能抑制Hp在生物表面上的黏附,還能抑制Hp中N-乙酰轉移酶活性來控制Hp的生長[17-18]。小檗堿還可抑制促炎基因IL-6、轉化生長因子β(TGF-β)、IL-1β的表達,上調黏膜和小鼠腹腔巨噬細胞中抗炎基因IL-10的表達,通過減弱B淋巴細胞活化因子觸發的輔助性T淋巴細胞17(Th17)反應,減輕Hp誘導的慢性胃炎,從而發揮抗炎作用[19]。此外,小檗堿還能抑制上皮細胞凋亡,抑制炎性反應,同時降低TNF-α和iNOS水平,以減輕Hp誘導的胃黏膜炎癥[20]。除了小檗堿類成分外,黃連中的棕櫚堿可以通過靶向調控脲酶活性位點巰基來發揮抗Hp作用,從而抑制脲酶活性和脲酶成熟,減緩Hp對胃黏膜損傷[21]。
TNF-α是一種促炎細胞因子,能促進IL-1、IL-6的產生,加強炎性反應,還有促進細胞分化和增殖的作用。TNF-α可以通過抑制糖原合酶激酶3β(GSK3b)來促進胃上皮細胞中的神經緊張蛋白信號傳導[22]。此外,在腫瘤微環境中TNF-α/1型腫瘤壞死因子受體(TNF-α/TNFR1)信號的激活,可通過誘導還原型輔酶Ⅱ氧化酶組織者1(Noxo1)和鳥嘌呤核苷酸結合蛋白α14(Gna14)促進胃腫瘤的發展,這有助于維持腫瘤細胞處于未分化狀態[23]。
IL-6最初作為B淋巴細胞刺激因子,既能誘導單純CD4+T淋巴細胞分化為Th17細胞,又可抑制調節性T淋巴細胞(Treg)發育,從而促進胃黏膜炎癥的發展。Hp感染的早期胃癌,IL-6水平也高于無Hp感染,根除Hp后IL-6水平顯著下降[24]。此外,Hp可誘導ROS的產生,并通過刺激IL-6上調來調節信號轉導和轉錄激活因子3(STAT3)激活,從而促進細胞生長,并刺激生長因子產生,促進細胞增殖、遷移和致癌轉化[25]。
IL-1β基因的多態性和IL-1β產生的增加與Hp感染相關胃癌的風險有關,Hp感染與IL-1β基因多態性協同作用,不僅參與胃癌前病變,還可以通過下調氫-鉀-ATP酶(H+-K+-ATP)和抑制胃泌素的表達,抑制胃酸分泌來促進胃癌的發生[26]。同時,IL-1β還通過激活NF-κB增加癌細胞的侵襲,從而增強基質金屬蛋白酶-9(MMP-9)表達[27]。有研究發現,IL-1β通過MAPK和ROS刺激IL-8的表達,參與胃癌的血管重建[28]。
MAPK1又稱細胞外信號調節激酶,是MAPK家族的一個成員,主要負責生長因子受體的信號傳導。MAPK通路參與了胃癌和正常上皮細胞的細胞運動調節,調節胃癌中MMP的活性,從而影響細胞遷移和侵襲[29]。此外,磷酸化的MAPK1可激活NF-κB從胞漿轉運到細胞核,進一步激活IL-8基因表達,IL-8常被認為是CAG的診斷標記物[30]。MAPK1還可以調節胃上皮細胞的周期進展、增殖,MAPK1活性的抑制則會導致細胞周期G0/G1階段阻滯[31]。
MAPK14又稱p38,參與細胞生長、分化、細胞周期進展和細胞凋亡,以及炎癥過程。研究表明,MAPK14信號參與調節上皮間質轉化(EMT)和EMT觸發的ROS的產生[32]。MAPK14還可誘導p60和p55亞基的表達,形成NF-κB二聚體,激活NF-κB通路[33]。
EGFR屬于受體酪氨酸激酶群,EGFR信號通路通常在細胞增殖、分化和生長中發揮重要作用。Hp感染與表皮細胞生長因子(EGF)激活和EGFR表達上調有關,可增強細胞的運動性,導致癌細胞的侵襲和轉移[34],EGFR激活后還可通過其下游靶點Akt和B淋巴細胞瘤-2(Bcl-2)家族成員,發揮抗胃上皮細胞凋亡作用[35]。Hp可激活胃上皮細胞肝素結合性表皮生長因子(HB-EGF)基因表達和EGFR酪氨酸磷酸化,觸發EGFR信號激活,從而促進IL-8的產生,并啟動胃上皮細胞的腫瘤轉化[36]。Hp菌株還可通過HB-EGF、EGF受體誘導激活胃泌素啟動子[37],Hp刺激后的HB-EGF、MMP-7及胃泌素協同介導胃癌患者EMT激活并導致基質浸潤[38]。
Hp誘導MAPK的激活和原癌基因c-Fos、c-Jun活化,參與了胃上皮細胞的癌轉化,促進腺癌的發生[39]。腫瘤抑制因子p53控制著細胞對DNA損傷和致癌應激的反應,Hp誘導的p53失調是增加感染個體胃癌風險的潛在機制[40]。VEGFA是炎癥和腫瘤相關血管生成的關鍵調節因子,Hp可以激活VEGFA基因表達,其主要是通過MAPK、c-Jun氨基末端激酶(JNK)及NF-κB等多種信號途徑調控[41]。
通過分析“黃連-茵陳”藥對治療CAG的KEGG通路富集分析得到相關通路54條,涉及癌癥信號通路、TNF信號通路、MAPK信號通路、NF-κB信號通路EGFR信號通路等。MAPK通路主要介導宿主細胞基因轉錄、有絲分裂、運動、黏附、代謝及細胞凋亡。Hp感染和MAPK激活的聯合作用很可能會導致胃上皮細胞細胞周期進展、增殖及凋亡的改變[29]。NF-κB是一種重要的轉錄因子,通過調節致炎細胞因子和趨化因子基因的表達,參與多種免疫或炎性反應的激活,Hp已被證明可以激活胃癌細胞中NF-κB,并使炎細胞因子的表達增加[9]。TNF家族是一類多功能促炎細胞因子,可激活與細胞存活、凋亡、分化炎性反應相關的信號通路。EGFR信號通路通常在細胞增殖、分化和生長中發揮重要作用[34]。Hp感染與EGF的激活和EGFR表達的上調有關,增強了細胞的運動性以及導致了癌癥的侵襲和轉移[34]。
化濁解毒法是國醫大師李佃貴教授依據客觀的理論基礎和長期的臨床實踐,提出治療CAG的辨治觀點,其認為因徒清熱解毒則濕濁不去,徒化濁利濕則熱毒不除,而化濁解毒法的運用可使毒除濁化,可達氣行血暢,積除郁解,痰消火散,恢復脾升胃降之生理功能,脾氣上升,胃之津液得下,胃氣和降,胃得陰血濡養,萎縮的腺體可緩慢恢復正常[42-43]。本研究基于網絡藥理學與分子對接技術對“黃連-茵陳”藥對抗CAG的活性成分、潛在靶點和作用機制進行了初步預測。從26種化合物中篩選得與CAG的交集靶點38個,這些靶點可能通過抗炎、抗氧化、正向調控細胞凋亡、負向調控血管內皮增生、保護細胞外基質等方面實現治療作用。本研究還挖掘了54條“黃連-茵陳”藥對防治CAG的潛在信號通路,涉及炎癥/感染、表觀遺傳、細胞分化和生長周期等。本研究證明了 “黃連-茵陳”藥對治療CAG的機制涉及多靶點、多通路和多途徑,而且靶點和信號通路之間互有調控、交叉、協同,形成一個復雜的信號網絡系統,也對“黃連-茵陳”藥對治療CAG的具體分子信號通路進行了初步揭示,為下一步的實驗研究、藥物研發提供了理論基礎。鑒于網絡藥理學和分子對接技術還沒有完善,后期仍需具備相應科研能力的團隊開展動物實驗驗證所得的結果。

