鞣花酸通過調控miR-1254表達抑制口腔鱗癌HSC3細胞增殖、遷移和侵襲的機制
鄧瑩瑩 呂永利 夏天 劉進 劉淼
口腔鱗狀細胞癌,簡稱口腔鱗癌,是頜面部常見的惡性腫瘤,其發病率呈增長趨勢[1]。由于口腔鱗癌侵襲性較高,易發生淋巴結轉移和遠處轉移,患者術后易復發,其治療面臨較大挑戰[2]。因此,急需尋找治療口腔鱗癌的新途徑。鞣花酸是一種在各種軟果和堅果等植物中廣泛存在的多酚二內酯,具有抗氧化、抗炎和抗纖維化等生物活性[3-5]。隨著對鞣花酸研究的深入,發現其還具有抗腫瘤作用。研究顯示,鞣花酸可抑制皮膚基底細胞癌細胞增殖和侵襲,并誘導其凋亡,有望成為治療該腫瘤的新藥物[6];鞣花酸可通過抑制ERK1/2降低雌激素誘導的乳腺癌細胞的增殖能力[7];鞣花酸可能通過阻滯胰腺癌細胞的細胞周期進程及下調細胞中COX-2和NF-κB的蛋白表達抑制其增殖,并誘導其凋亡,發揮一定抗胰腺癌作用[8]。然而,鞣花酸能否影響口腔鱗癌細胞的惡性行為還未知。miR-1254是一種微小RNA(miRNA),其在口腔鱗癌組織中表達下調,上調miR-1254可抑制口腔鱗癌的發展進程[9]。本研究以miR-1254為切入點,探究了鞣花酸影響HSC3細胞增殖、遷移及侵襲的分子機制,以期為其用于口腔鱗癌的治療提供一定的實驗依據。
1 資料與方法
1.1 一般資料 39例口腔鱗癌組織及癌旁組織來自2018年3月至2020年3月于本院行手術治療的口腔鱗癌患者,其中男24例,女15例;平均年齡(49.35±7.58)歲。患者均首次確診,且術前未進行治療。研究符合《赫爾辛基宣言》原則。
1.2 細胞與試劑 HSC3細胞系,中國科學院上海細胞庫;胎牛血清,浙江天杭;CCK-8試劑盒、RPMI 1640培養液和BCA蛋白檢測試劑盒,北京索萊寶;miRNA提取試劑盒、逆轉錄試劑盒和PCR試劑盒,大連寶生物;E-cadherin、N-cadherin和GAPDH抗體,中國Abcam公司;引物序列、miR-1254 模擬物(mimcs)和抑制劑(anti-miR-1254)、模擬對照序列(miR-NC)和抑制劑陰性序列(anti-miR-NC),上海生工;LipofectamineTM2000試劑盒,美國Invitrogen公司。
1.3 方法
1.3.1 細胞培養:復蘇HSC3細胞,用完全培養液(含10% 胎牛血清的RPMI 1640培養液)置于CO2培養箱中培養。
1.3.2 CCK-8法檢測細胞增殖抑制率:于96孔板中接種200 μl HSC3細胞(5.0×104個/ml),培養4 h后,棄培養液,分為對照組和鞣花酸低、中、高劑量組。鞣花酸低、中、高劑量組細胞分別用含2、4、8 μg/ml[8]鞣花酸的培養液孵育細胞,對照組用不含鞣花酸的培養液孵育細胞。孵育24 h后,均加10 μl CCK-8,孵育2 h,用酶標儀(波長450 nm)檢測各孔吸光度(A)值。細胞抑制率(%)=(A對照組-A實驗組)/A對照組×100%。
1.3.3 克隆形成實驗檢測細胞克隆數:于6孔板中接種2.5 ml HSC3細胞(5.0×104個/ml),培養4 h后,棄培養液,按1.3.2分組處理。每2天更換1次,孵育14 d。棄培養液,將細胞用多聚甲醛固定及結晶紫染色后,顯微鏡觀察,計數克隆形成數。
1.3.4 劃痕實驗檢測細胞遷移:于6孔板中接種2.5 ml HSC3細胞(5.0×104個/ml),培養4 h后,棄培養液。于各孔底部劃兩條等間距的平行線,間距記為d0h,并去除劃痕間細胞。然后按照1.3.2分組處理。孵育24 h后,再次測量細胞間距離,記為d24h。劃痕愈合率(%)=(d0h-d24h)/d0h×100%。
1.3.5 Transwell實驗檢測細胞侵襲:于6孔板中接種2.5 ml HSC3細胞(5.0×104個/ml),培養4 h后,棄培養液,按照1.3.2分組處理。孵育24 h后,收集細胞,并調整各組細胞濃度為5.0×105個/ml。鋪Matrigel基質膠至Transwell小室的上室,自然晾干后,加100 μl各組細胞懸液。另在下室加500 μl完全培養液。培養24 h后,棄培養液,將細胞用多聚甲醛固定及結晶紫染色后,顯微鏡觀察,計數。
1.3.6 蛋白質印跡法檢測E-cadherin和N-cadherin蛋白表達:于6孔板中接種2.5 ml HSC3細胞(5.0×104個/ml),培養4 h后,棄培養液,按照1.3.2分組處理。孵育24 h后,用RIPA試劑獲取細胞中總蛋白,并用BCA試劑盒檢測蛋白濃度。用 SDS-PAGE實驗分離總蛋白,并轉至PVDF膜,用5%脫脂奶粉封閉2 h。于4℃冰箱中分別用E-cadherin(1∶500)、N-cadherin(1∶500)、GAPDH(1∶1 000)一抗孵育過夜,洗膜后,再在室溫下用山羊抗兔二抗(1∶2 000)中孵育1 h。加顯影液顯影,曝光拍照,ImageJ軟件分析E-cadherin、N-cadherin相對GAPDH的表達量。
1.3.7 qRT-PCR檢測miR-1254表達:①細胞接種和處理同1.3.6,孵育24 h后,收集細胞;②在液氮保護下,充分研磨組織樣本。均用miRNA提取試劑盒提取細胞和組織中總RNA,逆轉錄為cDNA后,進行擴增。引物序列:miR-1254上游5’-CTG GAAGCTGGAGCCTGCAGT-3’,下游5’-GCGAGCACAGAATTAATACGAC-3’;U6上游5’-CTCGCTTCGGCAGCACA-3’,下游5’-AACGCTTCACGAATTTGCGT-3’。2-ΔΔCt法計算miR-1254相對U6的表達量。
1.3.8 細胞轉染與處理:于6孔板中接種2.5 ml HSC3細胞(5.0×104個/ml),培養24 h后,棄培養液。將LipofectamineTM2000試劑分別與miR-1254 mimics、miR-NC、anti-miR-1254或anti-miR-NC混合均勻,加至各孔中,孵育細胞12 h。收集細胞,qRT-PCR檢測細胞中miR-1254表達,驗證轉染效果后,將細胞接種至培養板中,轉染miR-1254 mimics、miR-NC的細胞均按照對照組處理,記為miR-1254組、miR-NC組;轉染anti-miR-1254、anti-miR-NC的細胞均用含8 μg/ml 鞣花酸的培養液進行孵育,分別記為鞣花酸+anti-miR-1254組、鞣花酸+anti-miR-NC組。按照上述1.3.2~1.3.6檢測4組細胞增殖抑制率、克隆形成數、劃痕愈合率和侵襲數及細胞中E-cadherin和N-cadherin蛋白表達。

2 結果
2.1 鞣花酸對口腔鱗癌HSC3細胞增殖的影響 鞣花酸低、中、高劑量組HSC3細胞增殖抑制率均高于對照組(P<0.05),細胞克隆形成數均低于對照組(P<0.05),且呈劑量依賴性(P<0.05)。見表1。
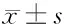
表1 鞣花酸對口腔鱗癌HSC3細胞增殖的影響 n=9,
2.2 鞣花酸對口腔鱗癌HSC3細胞遷移和侵襲的影響 鞣花酸低、中、高劑量組HSC3細胞劃痕愈合率、侵襲數及細胞中N-cadherin蛋白表達均低于對照組(P<0.05),E-cadherin蛋白表達高于對照組(P<0.05),且呈劑量依賴性(P<0.05)。見圖1、表2。

圖1 鞣花酸對口腔鱗癌HSC3細胞遷移侵襲相關蛋白表達的影響
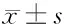
表2 鞣花酸對口腔鱗癌HSC3細胞遷移侵襲的影響 n=9,
2.3 miR-1254在口腔鱗癌組織中的表達 miR-1254在口腔鱗癌組織中的表達量為(0.27±0.05),低于癌旁組織(1.00±0.13),差異有統計學意義(t=32.731,P<0.05)。
2.4 鞣花酸對口腔鱗癌HSC3細胞miR-1254表達的影響 對照組、鞣花酸低、中、高劑量組HSC3細胞中miR-1254表達量分別為(1.00±0.00)、(1.69±0.14)、(2.76±0.23)和(3.72±0.27),4組間比較差異有統計學意義(F=354.047,P<0.05) 鞣花酸低、中、高劑量組HSC3細胞中miR-1254表達量均高于對照組(P<0.05),且呈劑量依賴性(P<0.05)。
2.5 miR-1254過表達對口腔鱗癌HSC3細胞增殖、遷移和侵襲的影響 miR-1254在miR-1254組HSC3細胞中的表達高于miR-NC組(3.32±0.26 vs 1.00±0.00,t=26.769,P<0.05),說明miR-1254組HSC3細胞中miR-1254表達較miR-NC組過表達。miR-1254組HSC3細胞增殖抑制率、E-cadherin蛋白表達均高于miR-NC(P<0.05),細胞克隆形成數、劃痕愈合率、侵襲數及細胞中N-cadherin蛋白表達均低于miR-NC組(P<0.05)。見表3、圖2。
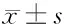
表3 miR-1254過表達對口腔鱗癌HSC3細胞增殖、遷移和侵襲的影響 n=9,

圖2 miR-1254過表達對口腔鱗癌HSC3細胞遷移侵襲相關蛋白表達的影響
2.6 下調miR-1254逆轉鞣花酸對口腔鱗癌HSC3細胞增殖、遷移和侵襲的作用 miR-1254在鞣花酸+anti-miR-1254組HSC3細胞中的表達低于鞣花酸+anti-miR-NC組(0.32±0.03 vs 1.00±0.00,t=68.000,P<0.05),說明鞣花酸+anti-miR-1254組HSC3細胞中miR-1254表達較鞣花酸+anti-miR-NC組被敲減。鞣花酸+anti-miR-1254組HSC3細胞增殖抑制率、E-cadherin蛋白表達均高于鞣花酸+anti-miR-NC(P<0.05),細胞克隆形成數、劃痕愈合率、侵襲數及細胞中N-cadherin蛋白表達均低于鞣花酸+anti-miR-NC(P<0.05)。見表4、圖3。
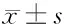
表4 下調miR-1254逆轉鞣花酸對HSC3細胞增殖、遷移和侵襲的作用 n=9,

圖3 下調miR-1254逆轉鞣花酸對HSC3細胞遷移侵襲相關蛋白表達的作用
3 討論
口腔鱗癌易復發和轉移,其治療面臨巨大挑戰。尋找低毒高效且副作用小的治療藥物來治療口腔鱗癌十分必要。近年來,由于天然植物或其活性成分因具有作用靶點多、效果強且副作用低等優點成為腫瘤治療藥物研究的重要對象。鞣花酸是一種天然多酚類物質,在各種軟果和堅果等植物中廣泛存在。本實驗結果顯示,鞣花酸對口腔鱗癌HSC3細胞增殖、遷移及侵襲具有顯著抑制作用,且呈劑量依賴性,這提示鞣花酸具有治療口腔鱗癌的潛在價值。
細胞上皮間質轉化是腫瘤細胞獲得遷移和侵襲性的關鍵[10]。上皮細胞經過轉化,獲得間質細胞表型,遷移和侵襲性增強,已形成轉移瘤[11]。E-cadherin是上皮細胞中維持細胞間結構的跨膜蛋白,N-cadherin是間質細胞的標志性蛋白。本實驗數據顯示,鞣花酸對HSC3細胞中E-cadherin蛋白表達起促進作用,而對N-cadherin蛋白表達起抑制作用,這說明鞣花酸抑制了HSC3細胞上皮間質轉化過程,提示鞣花酸抑制HSC3細胞遷移和侵襲與其抑制了細胞上皮間質轉化有關。
miRNA是一類小分子非編碼RNA,其可靶向其靶基因的表達參與調控腫瘤細胞惡性表型。既往研究顯示,多種miRNA參與口腔鱗癌的發展進程。例如,miR-19b-3p和miR-487a-3p室口腔鱗癌中表達下調的miRNA,過表達miR-19b-3p和miR-487a-3p可分別通過靶向下調RAB14、PPM1A抑制口腔鱗癌細胞的惡性行為,從而起到抑癌作用[12,13];miR-626在口腔鱗癌中表達增加,其通過靶向下調RASSF4促進口腔鱗癌的發展進程[14]。通過探究口腔鱗癌中異常表達的miRNA及其作用機制,可能口腔鱗癌發病機制的闡明及治療靶點的選擇提供新途徑。
作為一種miRNA,miR-1254參與多種疾病的發展進程。miR-1254表達的上調可導致宮頸癌細胞惡性生物學行為受到抑制[15],過表達miR-1254可通過靶向抑制MEGF6的表達降低結直腸癌細胞對奧沙利鉑的耐藥性[16];miR-1254在肝癌中表達下調,過表達miR-1254可通過下調FAIm2的表達抑制體內肝癌腫瘤生長[17]。本實驗數據顯示,miR-1254在口腔鱗癌組織中呈高表達,過表達miR-1254對口腔鱗癌HSC3細胞的增殖、遷移及侵襲發揮顯著抑制作用,與Lu等[9]報道結果一致,說明miR-1254起抑癌基因作用阻礙口腔鱗癌的發展進程,其可作為口腔鱗癌治療的分子靶點。Chen等[18]報道顯示,槲皮素可阻礙口腔鱗癌細胞增殖和侵襲,發揮抗口腔鱗癌作用,這與槲皮素上調細胞中miR-1254進而抑制CD36的表達有關。本研究結果顯示,鞣花酸呈劑量依賴性促進口腔鱗癌HSC3細胞中miR-1254的表達,而敲減miR-1254逆轉了鞣花酸對HSC3細胞增殖、遷移及侵襲的抑制作用,這提示鞣花酸可能通過上調miR-1254的表達來發揮抗口腔鱗癌作用,但其作用的miR-1254的靶基因還有待進一步探究。
綜上,鞣花酸呈劑量依賴性抑制口腔鱗癌細胞增殖、遷移及侵襲,具有治療口腔鱗癌的潛在價值,這可能與其上調細胞中miR-1254的表達有關,但其作用的miR-1254的靶基因還有待探究。同時,本研究僅在體外細胞層面進行了探究,尚需進一步在體內驗證鞣花酸的抗口腔鱗癌作用。

