甲狀腺乳頭狀癌組織中腫瘤轉移相關基因1、叉頭翼螺旋轉錄因子3水平變化與臨床病理特征及淋巴轉移的關系
吳海濱,趙愛國,苗雅云,李 帥,張冠男,湛喜梅,王文勝
(河南大學第一附屬醫院乳腺甲狀腺外科,河南 開封 475100)
甲狀腺癌是內分泌系統中最常見的惡性腫瘤之一[1],根據組織病理學特征可分為乳頭狀癌、濾泡狀癌、未分化癌等,其中甲狀腺乳頭狀癌(Papillary thyroid carcinoma,PTC)最常見,約占所有甲狀腺癌病例的85%~90%[2-3]。PTC患者經外科手術治療后可獲得較好的治療效果,但腫瘤轉移依然是影響患者預后的主要因素之一[4]。因此,篩選PTC淋巴轉移相關的分子,將有助于為PTC患者開發新的治療策略改善患者預后,提高生存率。腫瘤轉移相關基因1(Tumor metastasis-associated gene 1,MTA1)是腫瘤轉移相關的基因位點,在腫瘤細胞中呈陽性表達[5-6]。已有研究發現MTA1與腫瘤的發展有關[7]。叉頭翼螺旋轉錄因子3(Forkhead box protein 3,FOXP3)是轉錄調節因子家族中的重要成員,已被證實在PTC中發揮重要作用[8]。為了揭示FOXP3、MTA1的表達與PTC疾病進展的關系以及兩者的相關性,本研究旨擬通過檢測PTC淋巴轉移患者癌組織中MTA1、FOXP3的表達水平,分析兩者在PTC淋巴轉移中的作用以及與患者預后的關系,以利于為PTC的防治提供參考依據。
1 資料與方法
1.1 一般資料 選取2021年1月到2022年6月在本院行手術治療的111例PTC患者為研究對象,男34例,女77例;年齡(45.59±8.44)歲,其中≥45歲35例、<45歲76例。術中收集癌組織標本及癌旁組織標本。病例納入標準:診斷參考2017年WHO甲狀腺結節和分化型PTC的診斷標準[9];均進行甲狀腺全切或次全切術;術前未接受過放化療及其他特殊藥物治療。排除標準:合并其他惡性腫瘤;合并自身免疫性疾病及重要臟器功能障礙患者;有既往甲狀腺手術史;妊娠或哺乳人群。TNM分期Ⅰ+Ⅱ期69例,Ⅲ+Ⅳ期42例[TNM分期標準參考美國癌癥聯合委員會甲狀腺癌分期系統(第8版)[10]];病灶單發73例,病灶多發38例;包膜侵犯36例,無包膜侵犯75例;合并橋本甲狀腺炎12例,無橋本甲狀腺炎99例;無脈管侵犯95例,有脈管侵犯16例;無淋巴結轉移71例,有淋巴結轉移40例;腫瘤長徑≥1 cm 56例,腫瘤長徑<1 cm 55例。本研究經我院道德倫理委員會批準通過,所有樣品采集均取得患者的知情同意,符合《世界醫學協會赫爾辛基宣言》。
1.2 研究方法 免疫組織化學染色檢測MTA1、FOXP3表達:將福爾馬林固定石蠟包埋的組織切成4 μm厚的切片,70 ℃烘焙1 h,然后常規脫蠟水化。切片使用檸檬酸鹽緩沖液(10 mmol/L,pH6.0)進行抗原修復。用0.3%的過氧化氫封閉內源性過氧化物酶活性20 min。然后將標本與一抗(MTA1兔多克隆抗體,FOXP3兔多克隆抗體)在4 ℃下孵育過夜。在用檸檬酸緩沖液洗滌后,樣本加入抗體在37 ℃下孵育30 min。將載玻片沖洗進行3,3’-二氨基聯苯胺染色。細胞核用蘇木精復染。最后,組織切片用玻璃蓋玻片密封,并用光學顯微鏡觀察。由兩名對臨床數據不知情的研究人員評估代表性區域的染色強度和染色細胞百分比:染色細胞的百分比分別為1%~25%、26%~50%、51%~75%和>75%時,陽性染色評分為1、2、3或4分。無色、淡黃、黃色和棕色時,染色強度記為0、1、2或3分。通過將百分比和強度的分數相乘來計算最終的染色分數,總分0~12分。0~4分為陰性,5~12分為陽性。
1.3 統計學方法 所有統計分析均使用SPSS 22.0統計學軟件。計數資料采用[例(%)]表示,進行卡方檢驗;采用Spearman等級相關分析法進行相關性分析;采用單因素及多因素Logistic回歸風險模型分析PTC淋巴轉移影響因素;P<0.05為差異具有統計學意義。
2 結 果
2.1 MTA1、FOXP3在不同組織中的表達情況比較 111例PTC組織標本中,MTA1陽性表達率(MTA1陽性例數/癌組織總例數)為78.38%(87/111)高于癌旁組織17.12%(19/111),FOXP3在PTC組織中的陽性表達率(FOXP3陽性例數/癌組織總例數)為70.27%(78/111)高于癌旁組織13.51%(15/111),兩組比較差異有統計學意義(均P<0.05),見表1(圖1)。
2.2 PTC患者癌組織中MTA1與FOXP3表達的相關性 111例PTC組織標本中,MTA1的陽性表達87例,FOXP3陽性表達78例,兩者表達呈正相關(r=0.532,P=0.000)。
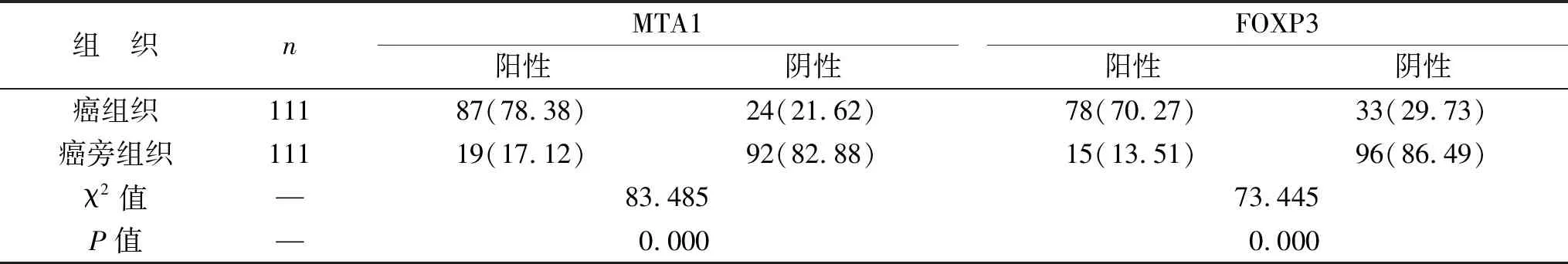
表1 MTA1、FOXP3在不同組織中的表達情況比較[例(%)]
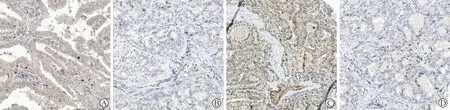
A:PTC組織FOXP3表達情況;B:癌旁組織FOXP3表達情況;C:PTC組織MTA1表達情況;D:癌旁組織MTA1表達情況
2.3 癌組織中MTA1、FOXP3表達與PTC患者臨床病理參數的關系 PTC患者癌組織中MTA1與FOXP3表達與患者年齡、性別、病灶數、橋本甲狀腺炎、腫瘤直徑、脈管侵犯無關聯(均P>0.05),與包膜侵犯、淋巴結轉移、TNM分期有關(均P<0.05),見表2。
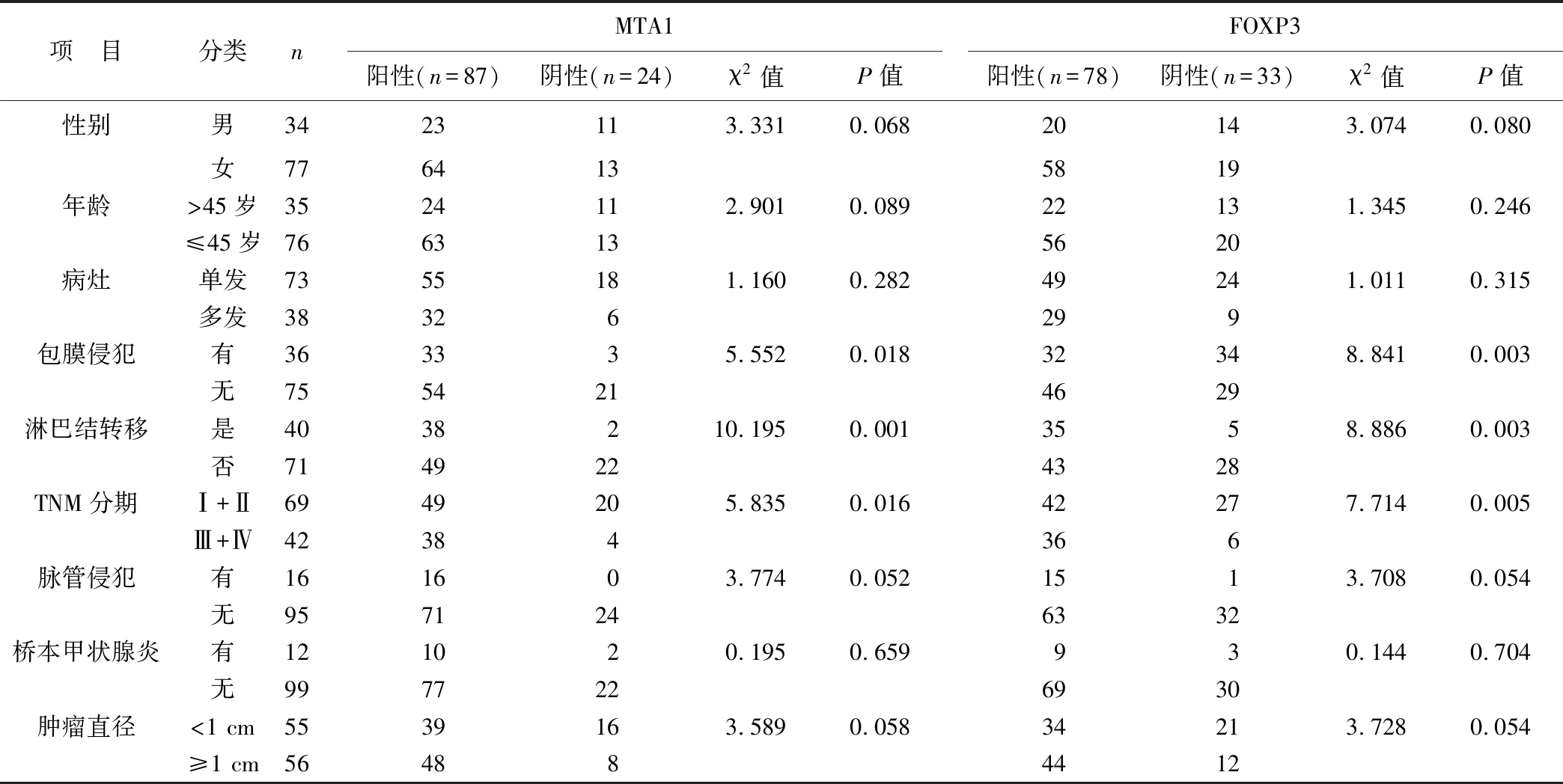
表2 癌組織中MTA1、FOXP3表達與臨床病理參數的關系(例)
2.4 影響PTC淋巴轉移的單因素分析 單因素分析結果顯示淋巴轉移患者與未轉移患者在性別、病灶數、包膜侵犯、TNM分期、脈管侵犯、MTA1及FOXP3等病理特征方面比較有統計學差異(均P<0.05),見表3。
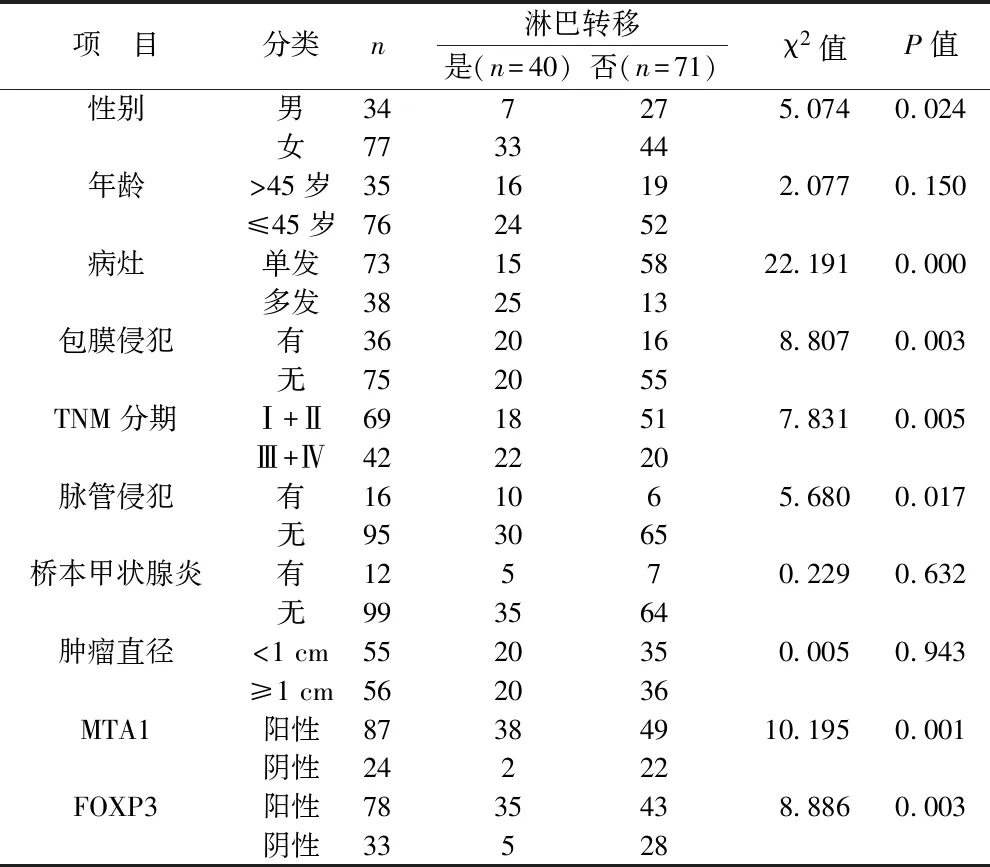
表3 影響PTC淋巴轉移單因素分析(例)
2.5 影響PTC淋巴轉移的Logistic多因素回歸分析 進一步行多因素Logistic回歸分析,以性別(男=0,女=1)、病灶(單發=0,多發=1)、TNM分期(Ⅰ+Ⅱ=0,Ⅲ+Ⅳ=1)、包膜侵犯(無=0,有=1)、脈管侵犯(無=0,有=1)、MTA1(陰性表達=0,陽性表達=1)、FOXP3(陰性表達=0,陽性表達=1)為自變量,結果顯示性別、病灶、TNM分期、包膜侵犯及MTA1、FOXP3表達均是影響PTC淋巴轉移的危險因素(均P<0.05),見表4。
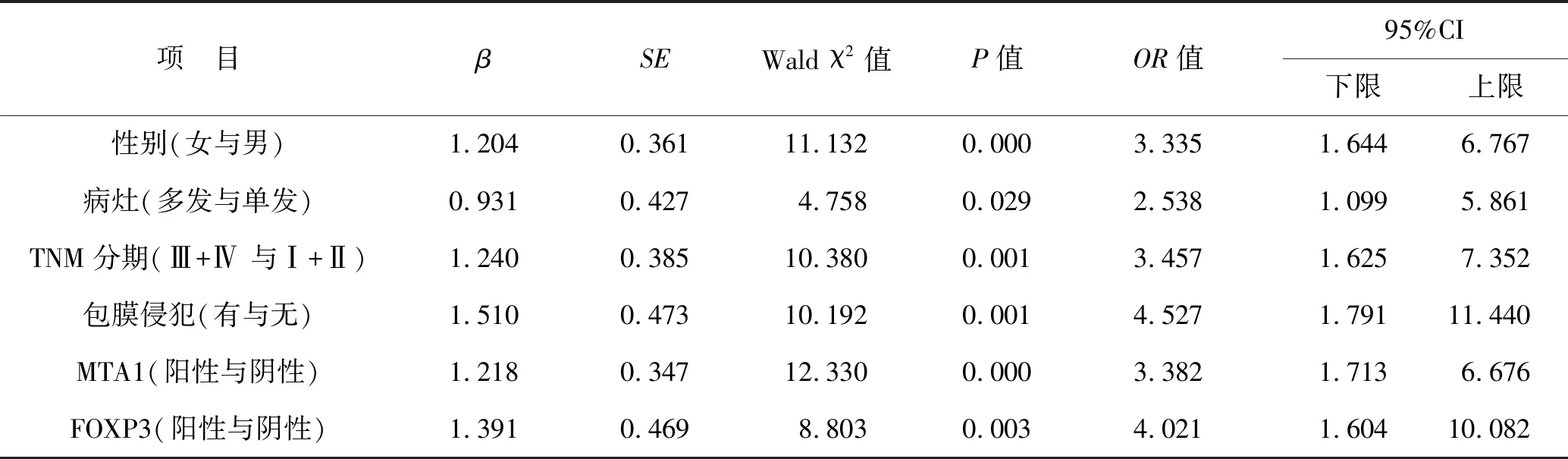
表4 影響PTC淋巴轉移的Logistic多因素回歸分析
3 討 論
近年來,隨著PTC發病率的不斷上升,它已經對世界上越來越多的人群構成了巨大的威脅,尤其是女性[11]。雖然大多數病例經及時治療后預后良好,但仍有相當比例的患者惡性程度高,總生存期較差[12]。因此,尋找與PTC淋巴轉移相關的因子,對改善預后及延長患者壽命具有重要指導價值。
MTA基因家族包括MTA1、MTA2和MTA3,該家族被發現參與調節一系列癌癥發展進程[13]。已有研究表明MTA1在多種腫瘤中存在異常高表達,并與腫瘤的侵襲、轉移等密切相關[14-15]。如董旭媛等[16]研究發現MTA1在肺癌組織中高表達,表達水平與淋巴結轉移相關。王學培等[17]研究發現MTA1過表達可促進食管癌細胞Eca-109的增殖和侵襲能力,促進腫瘤細胞血管的形成。本研究發現MTA1在PTC組織中的陽性表達率高于癌旁組織,其表達受包膜侵犯、淋巴結轉移、TNM分期影響,與以往研究結果一致[4]。進一步證明MTA1在PTC中發揮促癌基因的作用,其高表達可能會促進腫瘤細胞的淋巴轉移和侵襲,參與PTC淋巴轉移的發展過程,其作用機制可能是MAT1的高表達提高了PTC細胞的浸潤及黏附能力,并促進淋巴結內皮組織的浸潤,從而導致淋巴結的轉移。
FOXP3可通過調控T淋巴細胞,誘導免疫功能發生紊亂,從而導致癌細胞免疫逃逸[18]。近年來有多項研究顯示FOXP3在多種腫瘤疾病如甲狀腺乳頭狀癌、胃癌、肺癌、肝癌中異常表達[19-20]。趙水英等[21]研究發現FOXP3在PTC組織中表達增加,與PTC發生發展有關,可作為一種潛在的PTC分子治療靶點。然而目前還缺乏評估FOXP3參與PTC淋巴轉移進展的研究。本研究中PTC組織中FOXP3表達水平顯著高于癌旁組織,且表達水平與包膜侵犯、淋巴結轉移、TNM分期有關,提示FOXP3參與PTC的發生及發展進程,并可能在腫瘤的侵襲轉移中發揮更為重要的作用,但其具體作用機制仍需進一步研究。此外,研究發現MTA1、FOXP3在PTC組織中的表達呈正相關,提示兩者在PTC淋巴生成過程中可能存在協同作用,共同促進腫瘤細胞的惡性發展。Logistic回歸分析結果顯示性別、病灶、TNM分期、包膜侵犯與MTA1、FOXP3表達均是影響淋巴轉移的危險因素,進一步證明了MTA1、FOXP3與PTC淋巴轉移密切相關,也提示FOXP3及MTA1的異常表達與腫瘤侵襲和淋巴轉移相關,兩者共同參與腫瘤淋巴轉移的發生,并有望成為PTC診療的新靶標。
綜上所述,PTC淋巴轉移患者癌組織中MTA1、FOXP3均呈陽性表達,兩者是PTC淋巴轉移的獨立危險因素,有望成為臨床預測PTC淋巴轉移情況的有效指標,具有重要的臨床意義。但目前FOXP3及MTA1在PTC淋巴轉移中的具體作用機制尚不明確,我們將在今后的研究工作中進行完善并深入探討和分析。

