非小細胞肺癌程序性死亡配體-1表達與臨床病理特征和常見驅動基因變異的相關性研究
龍朝戀 李琨 劉子臣 張娜娜 車南穎
肺癌是全球癌癥死亡相關的主要原因,也是中國最常見及死亡人數最多的癌癥[1-2]。非小細胞肺癌(Non-small cell lung cancer,NSCLC)占肺癌總數的85%~90%[3]。針對NSCLC驅動基因的靶向治療作為肺癌治療領域最具影響力的進展之一,顯著提高患者生存期[4]。雖然靶向治療療效顯著,但耐藥無法避免,耐藥后的治療方式有限。程序性死亡受體-1(Programmed Death 1,PD-1)/程序性死亡配體-1(Programmed Death-Ligand 1,PD-L1)免疫檢查點抑制劑(Immune checkpoint inhibitors,ICIs)已經成為NSCLC患者治療的重要組成部分。目前,PD-L1抗體單藥治療患者的分層仍然基于高PD-L1評分(腫瘤比例評分[TPS]≥50%)[5]。有研究表明對于缺乏驅動基因突變的NSCLC患者,ICIs治療能顯著提高患者總體生存率[6-7]。關于NSCLC臨床病理特征和主要驅動基因改變與PD-L1表達之間的相關性已有許多研究。然而,部分研究顯示出相互矛盾的結果,并且尚未達成共識[8-13]。本研究通過回顧性分析NSCLC患者PD-L1蛋白表達與臨床病理特征和不同驅動基因突變狀態的相關性,為臨床NSCLC患者免疫治療提供理論基礎。
1 材料與方法
1.1 研究對象
回顧性收集首都醫科大學附屬北京胸科醫院病理科2019年1月—2021年12月進行PD-L1蛋白免疫組織化學染色、驅動基因檢測的NSCLC患者2 386例。其中男性1 370例,女性1 016例;年齡27~87歲,平均(62.12±10.14)歲;腺癌1 836例,鱗癌471例,其他NSCLC 79例(包括非特異性的NSCLC 28例,肺大細胞神經內分泌癌30例,腺鱗癌15例,肉瘤樣癌5例,多形性癌1例)。分期Ⅰ~Ⅲ A期1 068例,Ⅲ B~Ⅳ期1 318例。納入標準:(1)經過細胞學或組織學病理確診為NSCLC患者;(2)同時具有PD-L1蛋白免疫組織化學染色和常見驅動基因檢測的NSCLC患者。排除標準:(1)排除其他部位腫瘤轉移的病例;(2)排除臨床資料不全的病例。本研究已通過醫院倫理委員會批準,編號為(2020)年-科研-臨審第38號。
1.2 研究方法
1.2.1 PD-L1免疫組織化學染色及結果判讀 PD-L1免疫組織化學染色采用即用型單克隆鼠抗人Dako PD-L1 22C3 pharmDx(Dako,Carpinteria,CA)抗體,Dako Autostainer Link 48自動染色平臺。PD-L1蛋白免疫組織化學染色結果判讀標準:細胞膜全部或部分著色即為陽性,基于腫瘤比例評分(TPS)評估PD-L1蛋白表達,TPS定義為陽性腫瘤細胞百分比。TPS<1%為表達陰性,TPS≥1%為表達陽性:1%≤TPS≤49%為低表達,TPS≥50%為高表達。
1.2.2 基因組DNA和RNA提取 收集福爾馬林固定石蠟包埋組織蠟塊,選擇腫瘤細胞比例和數量符合要求的的蠟塊號,連續切取10張4 μm厚的石蠟包埋樣本于1.5 mL EP管內,二甲苯脫蠟,采用RecoverAllTMTotal Nucleic Acid Isolation Kit for FFPE試劑盒共提取DNA和RNA,使用Qubit 3.0熒光定量儀定量。
1.2.3 NGS測序 諾禾致源人EGFR、KRAS、BRAF、PIK3CA、ALK、ROS1基因突變檢測試劑盒(半導體測序法)由天津諾禾致源生物信息科技有限公司提供,試劑盒采用多重PCR捕獲技術和半導體測序技術檢測突變或融合。
1.2.4 統計學方法 應用SPSS 26.0軟件系統進行統計學分析。計數資料以率(%)表示,采用單因素和多因素logistic回歸分析影響PD-L1表達的因素,計算OR值(95%CI),考慮變量之間的交互作用,采用后退法進行變量篩選。P<0.05為差異具有統計學意義。
2 結果
2.1 PD-L1的表達
在2 386例NSCLC標本中,有1 093例NSCLC標本PD-L1呈陽性表達,陽性率為45.8%。PD-L1的表達情況見圖1。
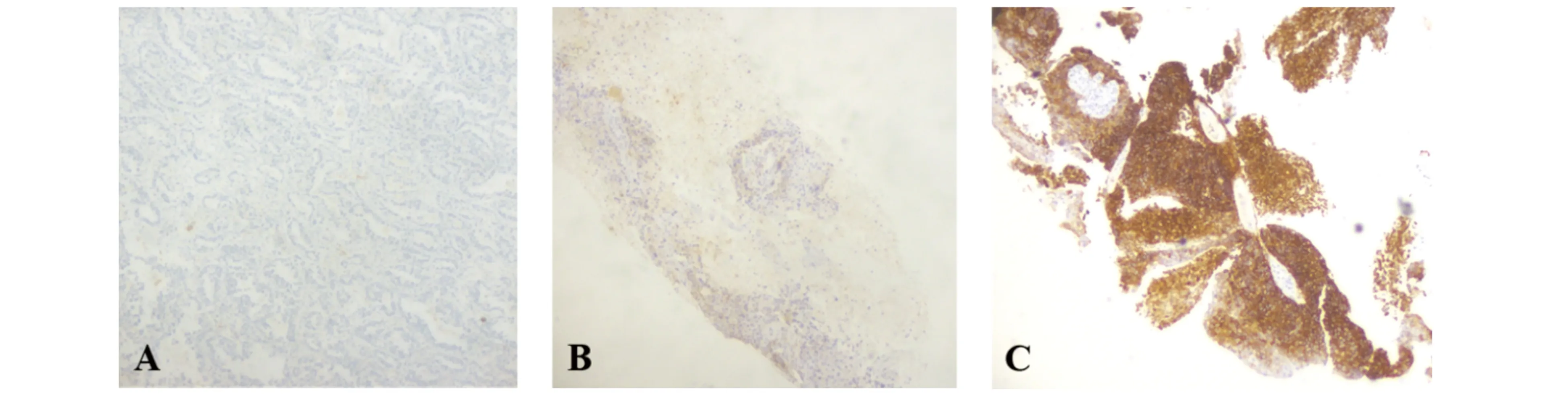
圖1 NSCLC腫瘤組織PD-L1蛋白表達
2.2 納入病例臨床病理特征與PD-L1的分布情況
納入的2 386例患者,低表達組(1%≤TPS≤49%)為62.0%(678/1 093),高表達組(TPS≥50%)為38.0%(415/1 093),不同臨床病理特征PD-L1表達存在差異(表1)。
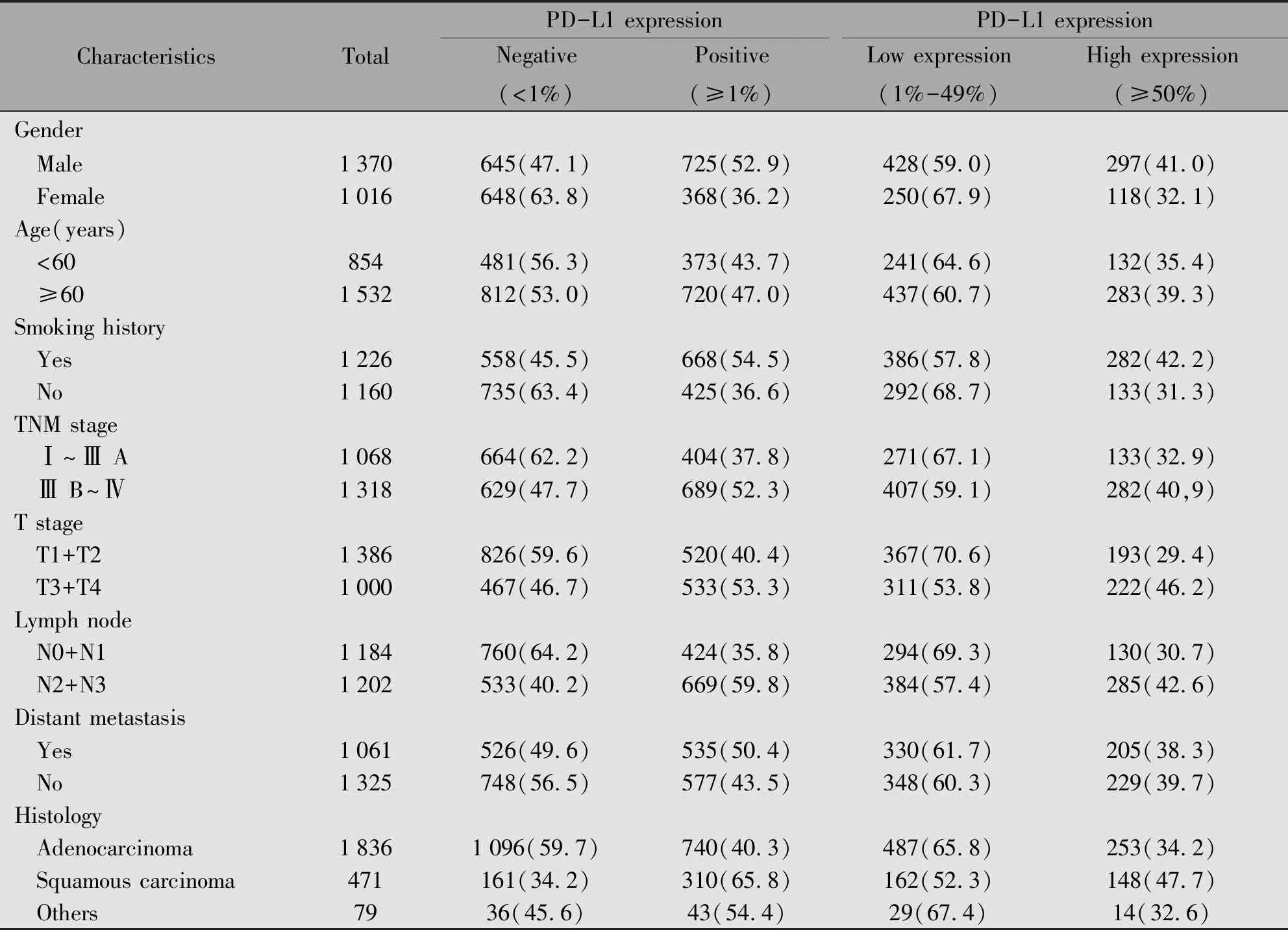
表1 2 386例NSCLC患者臨床病理特征[n(%)]
2.3 PD-L1陰性與陽性影響因素分析
對NSCLC患者PD-L1是否表達分別進行單因素及多因素logistic回歸分析,發現性別、吸煙史、TNM分期、腫瘤大小、淋巴結轉移、遠處轉移、病理亞型、EGFR突變、KRAS突變、ALK變異以及MET突變可能與NSCLC患者的PD-L1是否表達相關(P<0.05)。將上述對PD-L1是否表達有影響的因素納入多因素logistic回歸分析,發現吸煙史(OR=0.665,95%CI:0.551~0.802,P<0.001)、淋巴結轉移(OR=1.987,95%CI:1.676~2.356,P<0.001)、病理亞型(OR=1.629,95%CI:1.344~1.975,P<0.001)、EGFR突變(OR=0.801,95%CI:0.652~0.984,P=0.035)、KRAS突變(OR=0.613,95%CI:0.462~0.814,P=0.035)、ALK變異(OR=1.996,95%CI:1.322~3.015,P=0.001)和MET突變(OR=2.206,95%CI:1.137~4.281,P=0.019)是NSCLC患者PD-L1是否表達的獨立影響因素(表2)。

表2 NSCLC患者PD-L1陰性與陽性影響因素的單因素及多因素logistic回歸分析
2.4 PD-L1表達水平影響因素分析
對NSCLC患者PD-L1表達水平分別進行單因素及多因素logistic回歸分析,發現年齡、吸煙史、TNM分期、腫瘤大小、淋巴結轉移、病理亞型、EGFR突變、KRAS突變以及MET突變可能與NSCLC患者的PD-L1表達程度相關(P<0.05)。將上述對PD-L1表達水平有影響的因素納入多因素logistic回歸分析,發現淋巴結轉移(OR=1.717,95%CI:1.323~2.229,P<0.001)和EGFR突變(OR=0.576,95%CI:0.435~0.762,P=0.001)是NSCLC患者PD-L1表達水平的獨立影響因素(表3)。
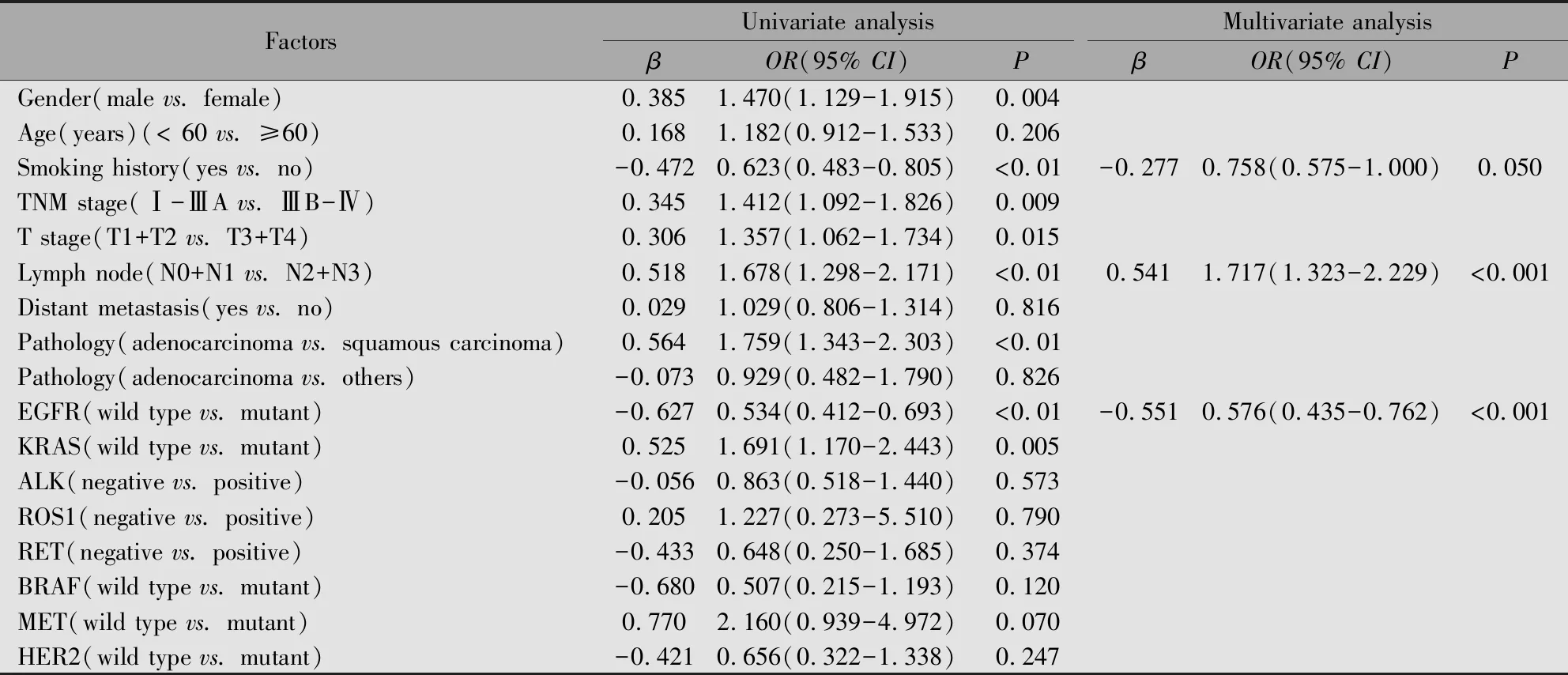
表3 NSCLC患者PD-L1高表達與低表達影響因素的單因素及多因素logistic回歸分析
3 討論
PD-L1蛋白作為ICIs治療相關分子,是相對可靠的療效預判標記物。國內外有研究報道了NSCLC中PD-L1蛋白的表達情況,但關于PD-L1表達狀態與臨床病理特征之間的關系仍沒有確切結論。
在本研究中,我們分析了2 386例NSCLC患者中臨床病理特征和驅動基因變異對PD-L1表達的影響,發現具有吸煙史、多個淋巴結轉移區域患者PD-L1表達增加,且與不吸煙、不發生淋巴結轉移或僅少許淋巴結轉移患者相比,PD-L1更高表達,與Miyazawa等[8]研究中報道的PD-L1在吸煙者、淋巴結轉移患者中高表達一致。另有多項研究表明與肺腺癌患者相比,肺鱗癌患者中PD-L1陽性表達高[9-10]。本研究也顯示肺鱗癌組PD-L1陽性表達率為65.8%(310/471),顯著高于肺腺癌(P<0.001)。
研究發現NSCLC患者基因突變狀態和PD-L1表達相關。有專家認為伴常見驅動基因突變的晚期NSCLC患者,ICIs治療獲益不明顯,應避免在這類患者中使用ICIs[11]。一些臨床研究認為在EGFR突變標本中PD-L1陽性率較高[14-16],但有其他研究表明,與EGFR野生型NSCLC相比,EGFR突變型NSCLC中PD-L1表達率較低,EGFR突變患者不能從PD-1/PD-L1抑制劑中獲益[12,14],EGFR突變患者不是抗PD-1/PD-L1免疫治療的理想候選人。本研究發現PD-L1在EGFR野生型中高表達,與部分研究結果一致。
對于其他突變,有研究認為KRAS突變、MET突變使PD-L1表達率增高[13,17-18],但對于KRAS突變有研究指出KRAS突變與PD-L1蛋白表達呈負相關[19]。研究指出伴ALK重排的NSCLC中PD-L1表達的頻率較低[11,20]。然而,其他幾項研究發現ALK可作為PD-L1表達的調節分子,正向調節NSCLC中PD-L1的表達[21-22],這與本研究顯示的伴KRAS突變、ALK變異和MET突變的NSCLC患者中PD-L1陽性表達率高的結果比較相符。另外,Elangovan等[23]發現腫瘤細胞PD-L1 TPS≥50%時,PD-L1的表達與KRAS基因突變相關,而與ALK基因突變無關,而一些研究則認為PD-L1表達水平與KRAS基因突變無關[24]。本研究也指出KRAS突變與PD-L1表達水平無關。
研究指出ROS1重排、RET重排與PD-L1蛋白低表達有關[25],但有其他研究指出伴基因重排NSCLC中PD-L1表達水平增高[26]。本研究并未發現伴ROS1重排、RET重排的NSCLC患者PD-L1蛋白表達與陰性患者之間存在統計學差異。這可能是由于伴這些突變基因的NSCLC患者PD-L1蛋白表達相關數據欠缺,造成統計偏差。
本研究也存在著一定的局限性。我們只研究了指南中推薦檢測的部分驅動基因,而缺乏其他基因變異的數據。此外對于少見/罕見突變的NSCLC,ICIs療效數據欠缺,無法給予準確的臨床評價。
未來,隨著對重要驅動基因變異的深入研究,靶向治療有望涵蓋更多的驅動變異,越來越多的NSCLC患者也將從中獲益。在ICIs治療方面,未來仍需要大量研究來明確ICIs在不同亞型驅動基因陽性的NSCLC中的療效及安全性,以便探索ICIs最佳治療策略。

