lncRNA AP000487.1在食管癌中的作用及機制研究
劉靜 褚艷杰 裴鳳華 徐睿玲 王彥博
食管癌是最常見的惡性腫瘤之一,其發病率和死亡率均較高,近年來呈上升趨勢且日趨低齡化,GLOBOCAN 2020數據顯示全球約有新發病例60.4萬,死亡病例54.4萬,在癌癥相關的死亡病例中居第七位[1]。盡管食管癌手術聯合放化療等治療手段不斷發展,但食管癌患者預后普遍較差[2-3],進展期食管癌患者5年生存率仍不足20%[4]。抑癌基因的失活和癌基因的激活在食管癌發生發展中發揮重要作用[5]。因此,臨床診療中迫切需要新的診療靶點,從而提高食管癌患者的生存期。
lncRNA在食管癌的許多生物學進程中,包括細胞的凋亡、細胞周期的調節、細胞增殖、侵襲和轉移以及腫瘤干細胞特性、放化療抗性和耐藥等方面發揮重要作用[6-7]。有研究表明,缺氧誘導lncRNA STEAP3-as1激活Wnt/β-catenin信號通路,通過阻止mA介導的STEAP3 mRNA降解促進結直腸癌進展[8]。然而,對食管癌中lncRNA的表達、作用及機制的探索還有待進一步研究。
在前期工作中,我們通過GEO和TCGA數據庫下載食管癌患者的測序數據,進行lncRNA差異表達分析,建立臨床預測模型并在數據集中驗證,發現AP000487.1在食管癌患者中差異表達且與預后高度相關[9]。然而,AP000487.1在食管癌中的作用和機制尚不明確。本研究將通過細胞生物學實驗和分子生物學方法探究AP000487.1在食管癌中的作用及其機制。
1 資料和方法
1.1 一般資料
1.1.1 人食管癌細胞株和食管正常上皮細胞株 人食管癌細胞株TE-1購自中國科學院上海生化細胞研究所;食管正常上皮細胞HEEC購自上海子實科技有限公司;人食管癌細胞株ECA109、KYSE150和EC9706由哈爾濱醫科大學附屬腫瘤醫院食管外科贈予。
1.1.2 人食管鱗狀細胞癌及癌旁組織樣本 收集哈爾濱醫科大學附屬腫瘤醫院食管外科2019年1月—12月期間19例食管鱗狀細胞癌及癌旁組織。納入標準:患者年齡40~69歲;性別不限;病理組織類型為鱗狀細胞癌;腫瘤組織大于2 cm。排除標準:其他惡性腫瘤病史及其他伴發疾病。本研究經哈爾濱醫科大學附屬腫瘤醫院倫理委員會批準(倫理編號:2020-50-IIT)。
1.1.3 基因操作工具與引物 選用RiboTM AP000487.1 Smart silencer表達載體沉默人食管鱗狀細胞癌中AP000487.1的表達。采用pEXP-RB-Mam-AmpR質粒過表達AP000487.1,上述兩種產品均委托銳博生物科技有限公司加工合成。AP000487.1、GAPDH、TNF-α、IL-1β和IL-6的引物委托賽默飛世爾科技有限公司合成及純化。所用引物具體序列如表1所示。

表1 實時定量PCR引物
1.2 實驗方法
1.2.1 細胞培養 10% FBS、1%青-鏈霉素的RPMI-1640培養液,用于培養ECA109和EC9706細胞系;10% FBS、1%青-鏈霉素的DMEM培養液用于培養TE-1和KYSE150細胞系;MEM完全培養基:10% FBS、1%青-鏈霉素的MEM培養液用于培養HEEC細胞系。細胞放置于37℃恒溫、5% CO2的培養箱中培養。
1.2.2 細胞轉染 準備無青鏈霉素的完全培養基的食管癌細胞懸液,鋪6孔板,培養24 h后轉染用;配制轉染復合物,將轉染復合物加入6孔板中,轉染24 h后進行傳代;用qRT-PCR檢測轉染細胞中AP000487.1的過表達及沉默情況。沉默及過表達AP000487.1實驗分組:Control組、Smart silencer-NC組、Smart silencer-AP000487.1組;pEXP-RB-Mam、AP000487.1組。
1.2.3 實時熒光定量聚合酶鏈反應(qRT-PCR) 使用TRI提取細胞和組織RNA。采用abm試劑盒進行逆轉錄。qRT-PCR采用SYBR熒光染料進行,其反應條件為:95℃ 10 min;95℃15 s;60℃ 30 s;72℃ 30 s,共40個循環數。用2-△△Ct計算后得到的目的基因相對表達量。
1.2.4 CCK-8實驗 96孔板每孔接種細胞總量約為1×104個。分別培養24 h、48 h和72 h取出96孔板,每孔貼壁加入110 μL CCK-8稀釋液。于酶標儀選擇450 nm為檢測波長,測量各孔的吸光度值。
1.2.5 細胞劃痕實驗 六孔板每孔接種細胞數量一般為5×105~10×105個細胞,放入細胞培養箱中過夜。次日用20 μL槍頭劃線,在0 h和24 h拍照記錄。采用Image Pro Plus 6.0軟件處理,計算細胞遷移對比距離,繪制柱狀圖并進行統計分析。
1.2.6 Transwell細胞侵襲實驗 將80 μL(50 mg/L)Matrigel凝膠稀釋液包被Transwell小室上室底部。細胞濃度為4×104/mL,將200 μL細胞懸液加入上室中。24孔板放置于培養箱中進行培養,24 h后,擦除小室上室內部的Matrigel膠和殘留的非侵入細胞,結晶紫染色拍照記錄。
1.2.7 蛋白免疫印跡(Western blot) 使用適量裂解液于冰上裂解細胞提取蛋白,BCA法檢測樣品濃度。配制SDS-PAGE凝膠電泳分離蛋白樣品。轉膜、封閉后孵育一抗,p-p65(鼠抗)按1∶1 000、p-IκBα(鼠抗)按1∶2 000比例稀釋,內參為GAPDH。孵育二抗按1∶2 000比例稀釋,采用ECL顯影液進行顯影。實驗分組:Smart silencer-NC組、Smart silencer-AP000487.1組。采用ImageJ軟件進行灰度分析。
1.2.8 統計分析 采用SPSS 19.0軟件和Graphpad Prism7.0軟件分析數據并繪圖,所有細胞實驗均重復三次以上,計量資料以均數±標準差表示,兩組間比較采用t檢驗或配對t檢驗,多組間比較采用方差分析,重復測量資料采用重復測量方差分析,P<0.05為差異具有統計學意義。
2 結果
2.1 lncRNA在食管癌組織中的表達結果
本研究中,通過qRT-PCR檢測了AP000696.1、LINC00689、LINC00900和AP000487.1在19例食管癌組織和癌旁組織中的表達情況。與癌旁組織相比,AP000487.1、LINC00900、AP000696.1在食管癌組織中表達均顯著上調,差異具有統計學意義(圖1A-C);LINC00689在食管癌組織中表達下調(圖1D)。
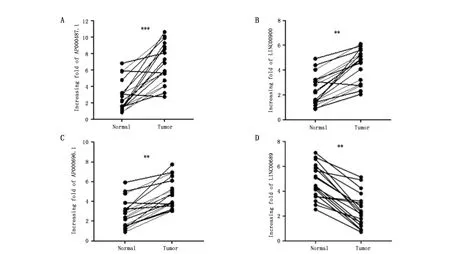
圖1 lncRNA在食管癌組織中的表達水平
2.2 lncRNA在食管癌細胞株的表達結果
qRT-PCR檢測了4個lncRNAs在食管癌細胞株ECA109、TE-1、KYSE150、EC9706和食管正常上皮細胞株HEEC中的表達情況。與HEEC相比,AP000487.1、LINC00900和AP000696.1在各食管癌細胞株中表達上調(圖2A-C);LINC00689在食管癌細胞株TE-1、ECA109、EC9706中表達顯著下調(P<0.05),在KYSE150中表達輕度下調(圖2D)。
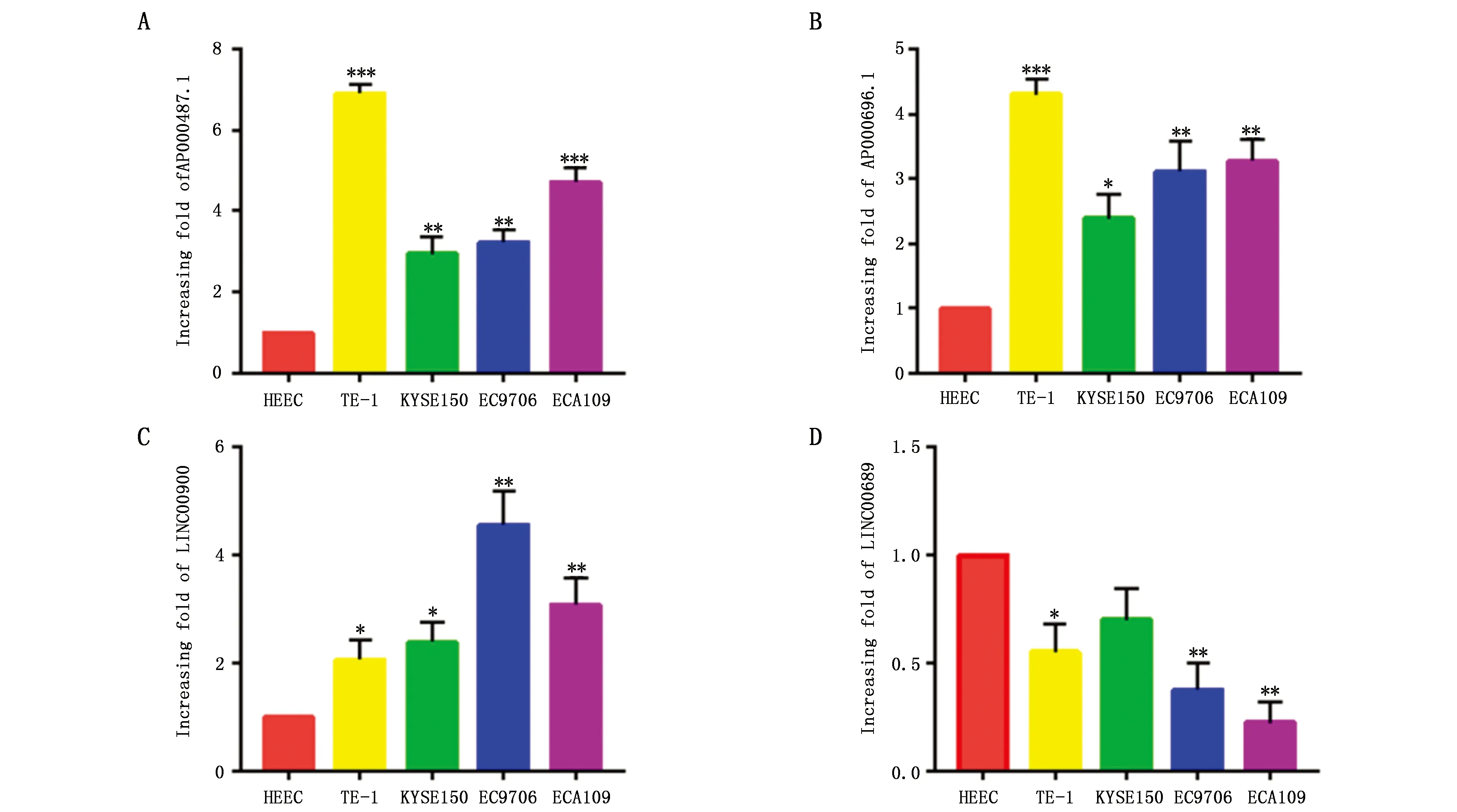
圖2 qRT-PCR檢測lncRNA在食管癌細胞株中的表達
2.3 沉默AP000487.1抑制食管癌細胞增殖、遷移及侵襲能力
為了研究AP000487.1在食管癌中的生物學功能,采用特異性的RNA抑制劑lncRNA Smart Silencer沉默AP000487.1在細胞中的表達,qRT-PCR檢測發現Smart silencer-AP000487.1組AP000487.1表達顯著下調(圖3A)。在ECA109和TE-1細胞中沉默AP000487.1表達后,探究AP000487.1對食管癌細胞增殖的影響。如圖3B所示,與Smart silencer-NC組對比,Smart silencer-AP000487.1組OD值顯著降低,細胞增殖能力顯著下降。Transwell實驗表明降低AP000487.1在食管癌細胞株中的表達可顯著抑制ECA109和TE-1細胞的侵襲能力(圖3C)。降低AP000487.1在食管癌細胞中的表達可有效抑制腫瘤細胞的遷移(圖3D)。
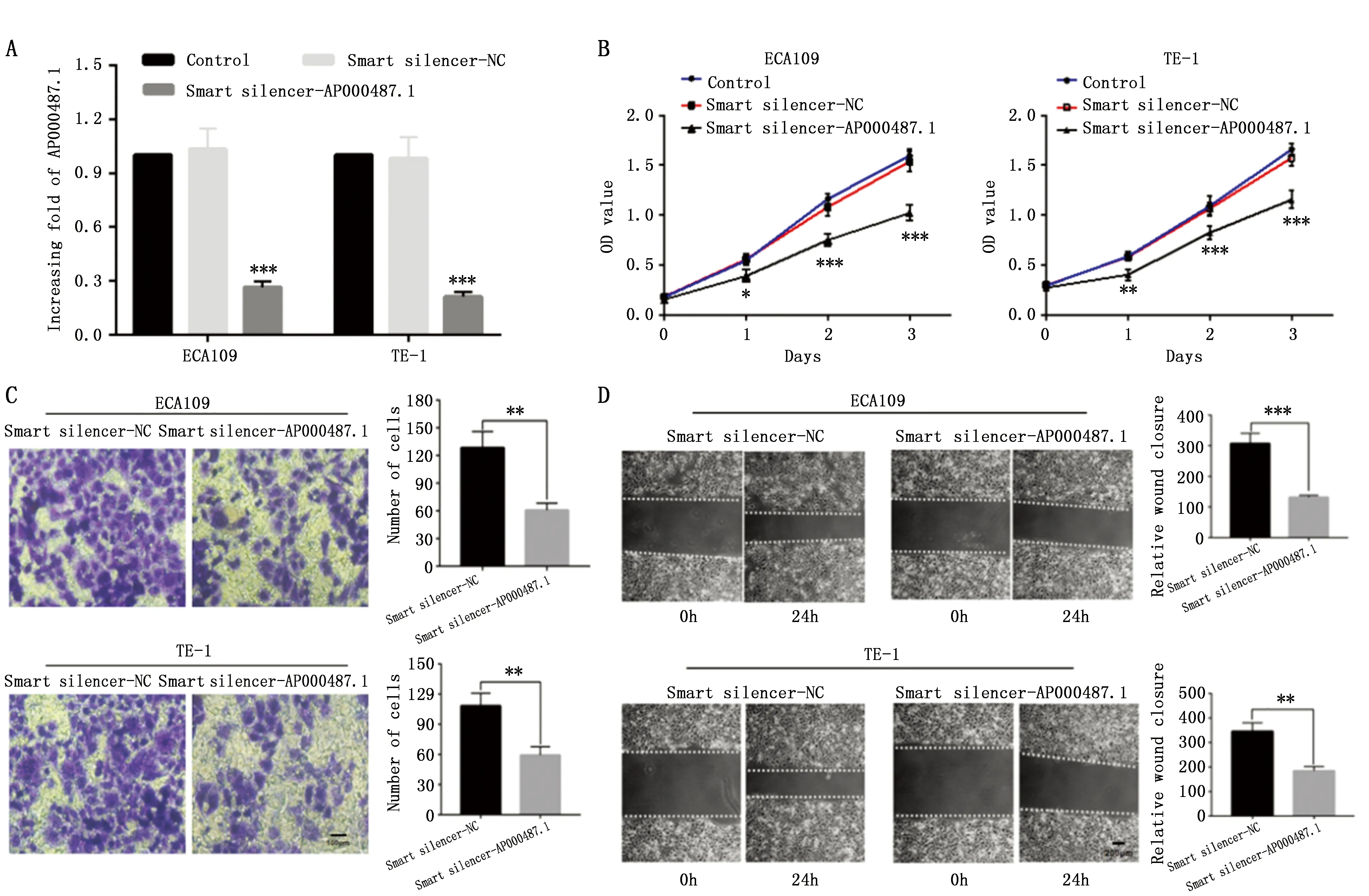
圖3 沉默AP000487.1對食管癌細胞的影響
2.4 過表達AP000487.1對促進食管癌細胞增殖、遷移及侵襲能力的影響
為了進一步研究AP000487.1在食管癌中的生物學功能,采用過表達純化質粒pEXp-RB-Mam-AmpR-AP000487.1轉染食管癌細胞株ECA109和TE-1中過表達AP000487.1,結果顯示與空白對照組和陰性對照組比較,實驗組AP000487.1表達均顯著升高(圖4A)。在ECA109細胞中過表達AP000487.1后,探究其對食管癌細胞增殖的影響。如圖4B所示,與Smart silencer-NC組對比,實驗組OD值明顯升高,細胞增殖能力顯著增強。Transwell侵襲實驗結果顯示,過表達AP000487.1組細胞侵襲數量顯著增多(圖4C)。劃痕實驗結果顯示,與陰性對照組相比,實驗組細胞遷移速度均顯著升高(圖4D),表明上調AP000487.1在食管癌細胞中的表達,可顯著提高腫瘤細胞的遷移能力。

圖4 過表達AP000487.1對食管癌細胞的影響
2.5 沉默AP000487.1對TLR/NF-κB信號通路的影響
Western blot方法發現TE-1細胞沉默AP000487.1表達后,p-p65和p-IκB表達顯著下調;AP000487.1沉默前后蛋白表達灰度值比較,差異具有統計學意義(圖5A-B)。說明在TE-1細胞沉默AP000487.1表達后,可抑制NF-κB信號通路的活化。qRT-PCR方法檢測NF-κB信號通路活化后炎癥因子的表達,實驗組TNF-α、IL-1β和IL-6表達顯著下調(圖5C)。在TE-1細胞中沉默AP000487.1后,下調NF-κB信號通路,進而影響TNF-α、IL-1β和IL-6的表達。以上結果表明,AP000487.1可能通過TLR/NF-κB信號通路調控食管癌發生發展。
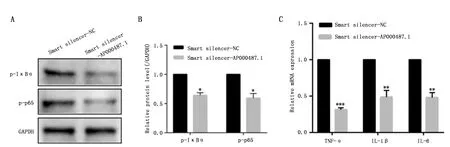
圖5 Western blot和qRT-PCR檢測TLR/NF-κB下游相關蛋白及炎癥因子的表達
3 討論
食管癌是一類具有不同分子特征的異質性疾病,由遺傳因素和環境因素等多因素共同作用發生[10]。在腫瘤進展相關研究中,發現包括lncRNA在內的分子圖譜可作為潛在的分子標記物,在病人的早期診斷、預測病人的預后及靶向治療方面發揮重要作用[11-12]。
前期研究中,我們通過生物信息技術分析揭示了4個TLR/NF-κB相關lncRNAs在食管癌預后中的作用[9],但仍需要進一步的實驗驗證其在腫瘤發展中的作用。我們檢測了19例食管癌配對組織和食管癌細胞株中4個lncRNAs的表達情況,結果顯示AP000487.1在食管癌組織中表達差異最為顯著,且在4株食管癌細胞系中表達上調。AP000487.1在食管癌組織及食管癌細胞系中均表達上調,說明其可能在食管癌的發展中發揮生物學功能。盡管如此,AP000487.1在食管癌發生發展中的作用及調控機制尚不明確。
癌細胞獲得運動和侵襲能力、促進轉移是腫瘤發展過程中最具危險性的過程[13-14]。我們選用Smart silencer沉默lncRNA的表達。Smart silencer由3條ASO和3條siRNA構成,采用優化的設計計算和較新的化學修飾方式,相比普通的siRNA具有更高的抑制效率和靈敏度。我們發現在兩種食管癌細胞系中沉默AP000487.1后,可顯著抑制食管癌細胞的增殖、侵襲和遷移情況。此外,在兩種食管癌細胞系中過表達AP000487.1,食管癌細胞的侵襲及遷移能力顯著升高,這一實驗結果也說明AP000487.1可能在食管癌的增殖、侵襲和轉移的表型獲得中發揮重要作用。
在腫瘤的發生發展中,TLR/NF-κB信號通路發揮了重要作用[15]。大部分TLRs識別其配體后最終通過激活NF-κB信號通路調控一系列與腫瘤相關的炎癥因子的表達。Jia等[16]研究發現,TLR3刺激觸發β-Catenin和NF-κB共同激活,促進乳腺癌干細胞樣表型。Rajamanickam等[17]結果表明L6H21通過阻斷TLR4-MD2/NF-κB信號通路來抑制腫瘤的侵襲和轉移,靶向TLR/NF-κB/NLRP信號通路是增強腫瘤化療和免疫治療以及對抗化療耐藥新策略[18-19]。前期研究中,我們發現AP000487.1與TLR/NF-κB信號通路高度相關。本實驗我們采用PCR法及Western blot方法檢測了TLR/NF-κB信號通路活化后相關基因及蛋白的表達。研究發現下調AP000487.1在細胞系中的表達,可顯著抑制TLR/NF-κB信號通路的活化,提示AP000487.1參與了TLR/NF-κB信號通路的調控,并進一步影響了食管癌細胞的增殖、侵襲和轉移。
綜上所述,本研究驗證了AP000487.1在食管癌中高表達,并通過分子生物學實驗證明AP000487.1可能通過TLR/NF-κB信號通路促進了食管癌的增殖、侵襲和遷移,是食管癌診療的潛在靶點。

