m6A修飾閱讀蛋白YTH在結直腸癌中的機制研究進展
陳麗名 綜述 夏敏 審校
RNA修飾可以以不同方式影響RNA的結構和功能。目前存在100多種RNA修飾[1],如5-羥甲基胞嘧啶(5-hydroxymethylcytosine,hm5C)、N1-甲基化腺嘌呤(N1-methyladenosine,m1A)和N6-甲基腺苷(N6-methyladenosine,m6A)等。m6A修飾是發生在RNA腺嘌呤的第六位氮原子上、動態可逆的RNA表觀遺傳學修飾,是真核生物中最廣泛的RNA修飾形式之一,主要位于終止密碼子附近和3′非編碼區(3′untrans-lated region,3′UTR),在3′非編碼區富集明顯[2]。m6A修飾受甲基轉移酶、去甲基化酶及甲基化閱讀蛋白共同調控。甲基轉移酶復合物包括甲基轉移酶3(Methyltransferase 3,METTL3)、甲基轉移酶14(Methyltransferase 14,METTL14)、WT1相關蛋白(WT1 associated protein,WTAP)、RNA結合基序蛋白15(RNA binding motif protein 15,RBM15)和病毒樣m6A甲基相關轉移酶(Vir like m6A methyltransferase associated,VIRMA)等;去甲基化酶包括肥胖相關蛋白(Fat mass and obesity-associated protein,FTO)和烷基B同系物5(AlkB homolog 5,ALKBH5),m6A閱讀蛋白包括YTH蛋白、真核起始因子3(Eukaryotic initiation factor 3,eIF3)、核不均一核糖核蛋白(Heterogeneous nuclear ribonucleoprotein,hnRNP)和胰島素樣生長因子2 mRNA結合蛋白(Insulin like growth factor 2 mRNA binding protein,IGF2BP)等,可特異性識別經m6A修飾后的RNA,參與調控RNA降解、穩定、轉運和翻譯[3],與多種腫瘤的發生發展有關。m6A閱讀蛋白YTH蛋白與結直腸癌關系的研究較少,本文系統綜述YTH蛋白的組成及結構特點、在轉錄后基因調控中的作用及其在結直腸癌發生進展中的作用及機制。
1 YTH蛋白的組成及結構
YTH蛋白中有一段約100~150個氨基酸組成的區域,在其同源蛋白中高度保守[4],被命名為YTH結構域,由YTH結構域家族蛋白1-3(YTH N6-methyladenosine RNA binding protein 1-3,YTHDF1-3)和含有蛋白1-2(YTH-domain containing 1-2,YTHDC1-2)組成。YTH結構域通常位于蛋白質的C末端,其中保守的芳香族氨基酸殘基和堿性氨基酸殘基分別負責m6A的識別和結合,YTH結構域表面具有帶正電荷的凹形結構,富含賴氨酸和精氨酸等堿性氨基酸殘基,采用特定的混合α-螺旋-β-折疊方式排列,β-折疊在中央排列成桶型,α-螺旋緊貼β-折疊將其包圍,共同構成一個疏水核心,包含2~3個高度保守的芳香族氨基酸殘基,負責特異性識別RNA[4]。這個疏水核心像一個精巧的籠子—“芳香籠”。m6A上的甲基基團可以被“芳香籠”捕獲識別,通過嘌呤堿基和芳香族苯環之間的π-π相互作用,以及與疏水芳香族氨基酸側鏈的陽離子-π相互作用保持穩定,介導與YTH蛋白的特異性識別[4-7]。除YTH結構域外,YTH蛋白還具有固有無序區域(Intrinsically disordered region,IDR),這些區域自身無法折疊成穩定且唯一的空間結構,但與其他分子相互作用中起著關鍵作用,參與信號傳導、轉錄和翻譯等重要的細胞功能[6-7];另外,YTHDC2還有多個結構域:R3H結構域、死亡樣解旋酶結構域(DExDc)、解旋酶超家族C末端結構域(HELIC)、解旋酶相關結構域(HA2)、錨蛋白重復序列(ANK)和寡核苷酸/寡糖結合折疊結構域(OB折疊)[4](圖1)。
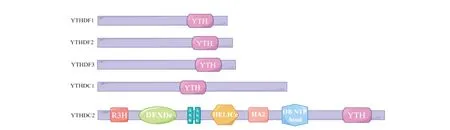
圖1 YTH結構域示意圖
YTHDF蛋白包括YTHDF1、YTHDF2和YTHDF3,三者都由C末端的保守YTH結構域及N端的IDR構成,其YTH結構域中的“芳香籠”結構在芳香氨基酸組成上稍有不同:YTHDF1的“芳香籠”結構由三個色氨酸殘基W411、W465和W470構成;YTHDF2由三個色氨酸殘基W432、W486和W491構成,YTHDF3由三個色氨酸殘基W438、W492和W497構成[4]。而N端的IDR由一段富含谷氨酰胺、脯氨酸和甘氨酸的約350個氨基酸組成[6]。
YTHDC1的YTH結構域包括兩個色氨酸殘基W377和W428所組成的“芳香籠”,而兩側由兩個精氨酸、脯氨酸、天冬氨酸和富含谷氨酸的約300個氨基酸組成的IDR構成[6]。YTHDC2是由包含三個芳香殘基(W1310、W1360和L1365)的YTH結構域[4]、IDR及多個結構域組成。
2 YTH蛋白識別m6A的功能機制
YTHDF1、YTHDF2和YTHDF3三者具有高度相似的序列、功能域、相互作用蛋白和細胞內定位,對于m6A修飾的mRNA顯示出相似的結合親和力,三者同時敲低才能充分發揮YTHDF蛋白調節mRNA穩定性的能力[6,9-10]。YTHDF1與起始因子作用,招募其他翻譯起始復合體成員及核糖體,促進翻譯啟動,引導m6A修飾的轉錄本與YTHDF2結合,促進RNA降解,從而影響mRNA的穩定性[11]。YTHDF2通過與m6A結合并招募CCR4/CAF/NOT腺嘌呤酶復合物,使m6A修飾的mRNA發生脫腺苷化,促進靶mRNA降解[6,9]。YTHDF3不能直接促進翻譯,與YTHDF1互作以增強YTHDF1介導的翻譯,引導m6A修飾的轉錄本與YTHDF2結合,進入RNA降解途徑[12](圖2)。
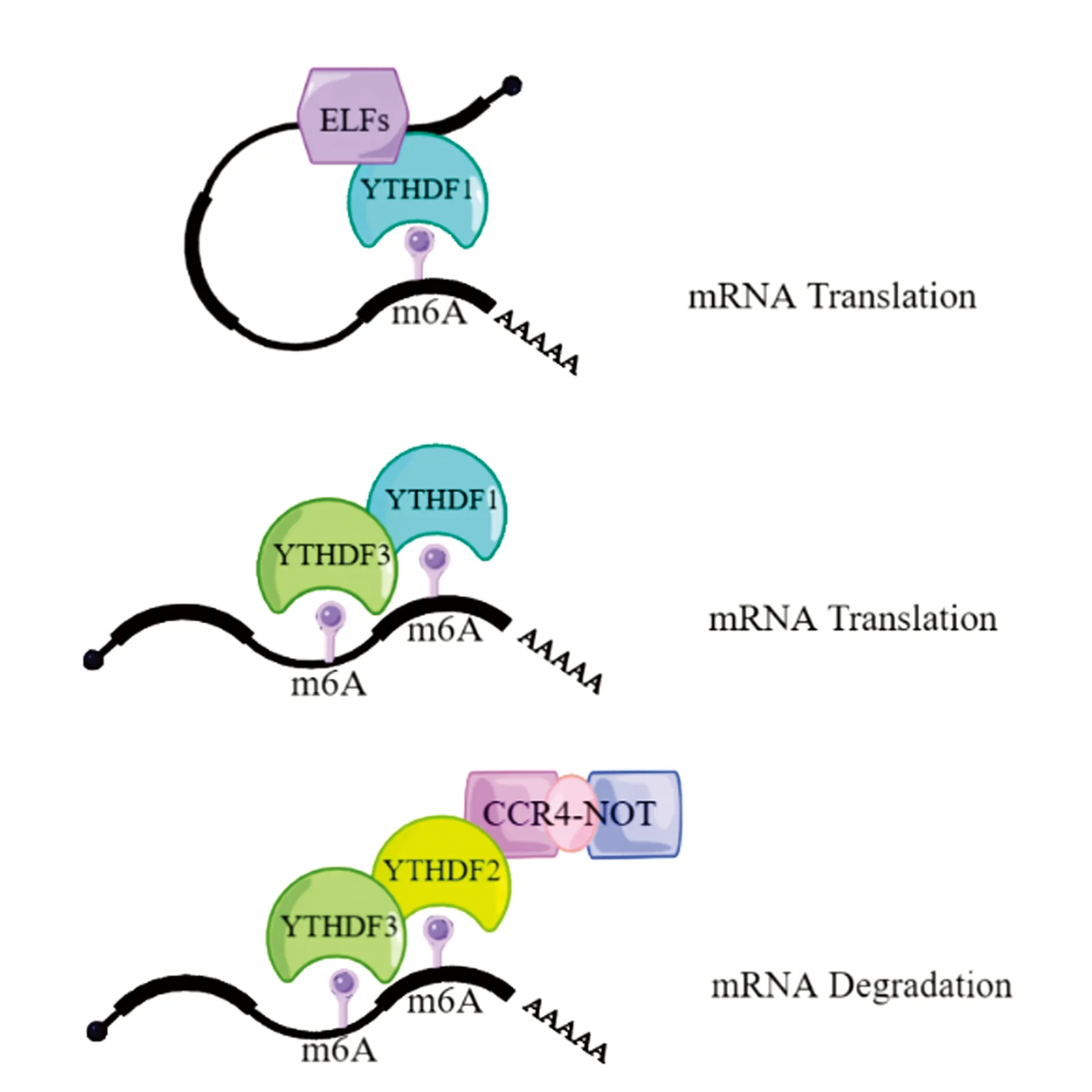
圖2 YTHDF1-3功能示意圖
YTHDC1通過招募絲氨酸/精氨酸富集剪接因子3(Serine/arginine-rich splicing factor 3,SRSF3)促進其與靶基因位點結合,調節mRNA的選擇性剪接[4];YTHDC1可通過m6A依賴方式調控轉錄,調節染色體相關RNA的穩定性[13]。YTHDC1還參與核mRNA向細胞質的運輸過程[14]。YTHDC2的R3H結構域可參與YTHDC2可與核糖體結合,作用于核糖體小亞基,提高翻譯效率;ANK結構域可介導與5′-3′核糖核酸外切酶XRN1的相互作用,在mRNA的穩定性方面發揮作用[15]。
3 YTH蛋白在結直腸癌中的作用機制
3.1 YTHDF1通過調節經典Wnt通路并影響細胞周期促進腫瘤的浸潤生長
通過TCGA數據庫分析發現YTHDF1在結腸腺癌組織中表達顯著上調,相對于癌旁組織YTHDF1在結直腸癌組織中呈高表達,并與預后不良有關[16]。
Wnt/β-連環蛋白經典信號通路與結直腸癌的發生發展密切相關,通路中相關分子的變化導致該經典Wnt通路的異常活化,可影響結直腸癌的發生發展以及轉移。β-連環蛋白是經典Wnt信號通路中的核心蛋白分子,介導信號從細胞質傳遞到細胞核,并在核內參與組成轉錄復合體,激活下游靶基因轉錄。YTHDF1表達上調可以增加Wnt/β-連環蛋白表達和β-連環蛋白細胞核信號活性,從而啟動Wnt/β-連環蛋白下游靶基因轉錄及相關蛋白表達,引起結直腸癌腫瘤增殖及浸潤生長[17],YTHDF1與Wnt信號分子FZD9、WNT6、TCF7L2和TCF4基因呈正相關,YTHDF1能夠識別并促進這些Wnt信號分子的mRNA翻譯,導致Wnt/β-連環蛋白信號的異常激活,從而促進結直腸癌腫瘤生長(圖3)[4,17];另外,敲除YTHDF1會使細胞停滯在G1期(DNA合成前期),不進入S期(DNA合成期),使大腸癌細胞DNA合成和復制相對減少,促進結直腸癌的細胞周期進程,進而促進腫瘤的浸潤生長[17-18]。
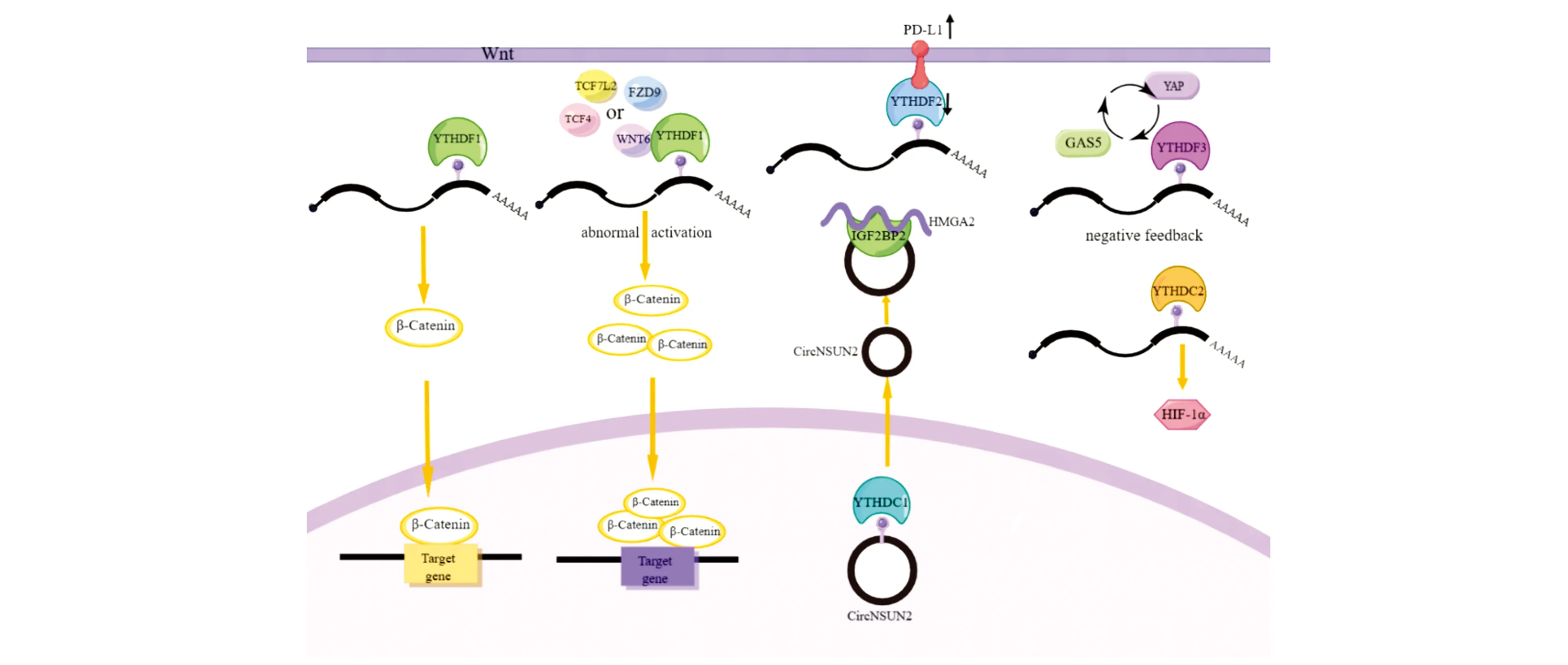
圖3 YTH蛋白在結直腸癌中的作用機制
3.2 YTHDF2通過抑制程序性死亡配體1影響結直腸癌的發生發展
程序性死亡配體1(Programmed death-ligand 1,PD-L1)是PD-1的配體,是結直腸癌免疫治療的靶點,在結直腸癌組織中高表達,PD-1高表達與患者預后不良有關[19-20]。在腫瘤微環境中,腫瘤細胞和腫瘤相關抗原遞呈細胞高表達PD-L1,PD-L1可通過與其受體PD-1的結合抑制抗腫瘤免疫反應,增加腫瘤微環境的炎癥反應,促進結直腸癌細胞免疫逃逸[21]。YTHDF2與PD-L1在結直腸癌細胞及組織中的表達呈負相關(圖3),YTHDF2可使m6A特異性抗體募集到的PD-L1 mRNA豐度明顯減少,抑制PD-L1 mRNA的m6A水平,上調YTHDF2表達導致PD-L1啟動子活性減弱,YTHDF2通過PD-L1潛在的5個m6A位點識別并與PD-L1結合[22],但其識別PD-L1的m6A修飾位點進而影響下游翻譯、降解的具體機制還有待研究。
3.3 YTHDF3通過GAS5-YAP-YTHDF3負反饋軸參與調控結直腸癌發生發展
YTHDF3在TCGA及GEO數據庫中的結直腸癌組織中表達顯著下調,YTHDF3的表達與結腸腺癌患者的預后呈負相關,是結直腸癌的獨立預后因素[23]。
研究發現YTHDF3可與Yes相關蛋白(Yes-associated protein,YAP)以及生長抑制特異因子5(Growth arrest specific 5,GAS5)形成GAS5-YAP-YTHDF3負反饋軸,YAP介導YTHDF3的表達,而YAP受到GAS5調控,GAS5使YAP磷酸化以促進其降解,從而使YTHDF3表達下降,即GAS5通過抑制YAP介導的YTHDF3的表達來抑制結直腸癌細胞的增殖和侵襲;而YTHDF3選擇性地結合m6A甲基化修飾的GAS5又可以觸發GAS5的降解,繼而減弱對YAP介導YTHDF3的表達的抑制[24],從而形成負反饋環(圖4),這個負反饋環維持YTHDF3的表達,而在結直腸癌患者中負反饋環失調導致YTHDF3表達失調,最終影響結直腸癌發生發展。
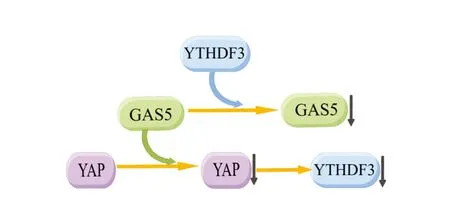
圖4 GAS5-YAP-YTHDF3負反饋調節
3.4 YTHDC1通過穩定HMGA2的表達促進結直腸癌侵襲與轉移
CircNSUN2是一種m6A修飾的在結直腸癌中高表達的環狀RNA(Circular RNA,circRNA),circNSUN2過表達能顯著增加結腸癌細胞的侵襲和轉移,而YTHDC1促進circNSUN2從細胞核輸出到細胞質,使其進一步結合m6A閱讀蛋白IGF2BP2,通過在細胞質中形成circNSUN2/IGF2BP2/HMGA2蛋白復合物來穩定高遷移率族AT HOOK蛋白2(High mobility group ATHook 2,HMGA2)的mRNA表達(圖3)[25],而HMGA2是包括Wnt/β-連環蛋白信號通路在內的多種通路的關鍵分子,在結直腸癌中異常過表達,HMGA2參與腫瘤細胞的細胞轉化、增殖、凋亡、衰老、轉移及上皮細胞-間充質轉化(Epithelial-mesenchymal transition,EMT),在體內外促進結直腸癌的侵襲與轉移[26]。
3.5 YTHDC2通過促進HIF-1α翻譯而促進結直腸癌增殖轉移
YTHDC2作為RNA解旋酶,可促進缺氧誘導因子-1α(Hypoxia-inducible factor-1alpha,HIF-1α)mRNA的5′非翻譯區(5′untranslated regions,5′UTRs)二級結構的解開,促進HIF-1α起始翻譯,提高HIF-1α的翻譯效率(圖3)[27]。HIF-1α是細胞應答缺氧應激的主要調節因子,研究表明HIF-1α在結直腸癌早期出現高表達,且與腫瘤分期和轉移成正相關,HIF-1α可以與多種蛋白組成不同的信號通路,調控細胞產生一系列對缺氧的代償反應,參與調節細胞存活、血管生成和細胞運動相關靶基因的表達,腫瘤的迅速增長易導致微環境缺氧,誘導HIF-1α誘導環氧合酶(Cyclooxygenase,COX2)、血管內皮生長因子(Vascular endothelial growth factor,VEGF)、β-連環蛋白、基質金屬蛋白酶(Matrix metalloproteinase,MMP)等蛋白表達,增加腫瘤血管生成,促進EMT,促進腫瘤細胞增殖和轉移[28]。
4 小結與展望
本文闡述了YTH蛋白的結構、功能以及與結腸癌發生發展的相關機制。YTH蛋白可能通過參與Wnt通路,調節PD-L1、HIF-1α、HMGA2等相關因子的表達,形成GAS5-YAP-YTHDF3負反饋軸等調控結直腸癌的發生發展。隨著高通量測序和生物芯片技術的日益發展,YTH蛋白作為重要的m6A閱讀蛋白,其多種亞型在結直腸癌發生發展中發揮了重要的作用,YTH蛋白或可成為預測結直腸癌進展及預后的新分子標志物,然而YTH不同蛋白亞型對于結直腸癌的作用機制仍有待進一步研究。

