甘油三酯葡萄糖指數及相關內臟肥胖指標對老年人群高尿酸血癥發生風險的預測價值*
宦麗君,王鵬云
華中科技大學同濟醫學院附屬梨園醫院檢驗科,湖北武漢 430077
高尿酸血癥(HUA)是由嘌呤代謝紊亂、能量代謝異常及腎臟對尿酸的排泄障礙引起的一種代謝性疾病,其發病率在全球范圍內逐年增長,其中老年人群是HUA的高發人群[1-2]。HUA不僅會導致痛風和慢性腎臟疾病,還與高血壓、糖尿病、心血管疾病及代謝綜合征等疾病密切相關[3-5]。研究顯示,胰島素抵抗(IR)和肥胖都是HUA發生與發展的獨立危險因素[6]。當IR出現時,IR導致的代償性高胰島素血癥可能通過影響尿酸轉運蛋白的表達而減少尿酸的排泄,促進HUA的發生和進展。因此,及時識別和干預IR有助于HUA及相關疾病的預防[7-8]。甘油三酯葡萄糖指數(TyG)是評估IR的可靠標志物[9],可以對IR進行早期、簡單有效的評估,提高IR評估的穩定性。 此外, 一些內臟肥胖指標,如中國內臟肥胖指數(CVAI)和脂質蓄積指數(LAP)也被提議作為評估肥胖和預測相關代謝疾病發病的補充指標[10]。本研究旨在評估TyG及相關內臟肥胖指標與HUA發生風險的相關性,確定更適合中國老年人群的HUA風險預測因子,為HUA早期預防提供依據。
1 資料與方法
1.1一般資料 將2021年1月至2022年1月在本院體檢中心參加體檢的1 454例體檢者作為研究對象,年齡60~97歲,平均(74.76±9.36)歲。排除患有腎功能不全、尿路感染或其他嚴重疾病,以及服用高血壓或降血脂藥物的患者。
1.2檢測方法 采用貝克曼AU5800全自動生化分析儀及其配套試劑對血清高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、總膽固醇(TC)、甘油三酯(TG)、血尿酸(SUA)、血尿素氮(BUN)、肌酐(Cre)和空腹血糖(FPG)等指標進行檢測。使用電子血壓計測量血壓,使用標準方法測量身高、體質量和腰圍(WC)。
1.3分組及各項指標計算 根據《中國高尿酸血癥與痛風診療指南(2019)》[11]標準,將SUA>420 μmol/L的研究對象作為HUA組,SUA≤ 420 μmol/L的研究對象作為對照組。計算TyG、CVAI、LAP等指標,計算公式:TyG=ln[TG(mg/dL)×FPG(mg/dL)/2],其中 TG 1 mg/dL=0.011 mmol/L,FPG 1 mg/dL=0.056 mmol/L;CVAI(女)=-187.32+1.71×年齡+4.23×BMI(kg/m2)+1.12×WC(cm)+39.76×log[TG(mmol/L)]-11.66×HDL-C (mmol/L),其中BMI=體質量(kg)/身高2(m2),CVAI(男)=-267.93+0.68×年齡+0.03×BMI(kg/m2)+4.00×WC(cm)+22.00×log[TG(mmol/L)]-16.32×HDL-C (mmol/L); LAP(女)= TG (mmol/L) ×[WC(cm)-58],LAP(男)=TG(mmol/L)×[WC(cm)-65]。
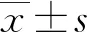
2 結 果
2.1兩組基線資料比較 根據SUA水平分組,644例SUA>420 μmol/L的研究對象納入HUA組,810例SUA≤420 μmol/L的研究對象納入對照組。與對照組比較,HUA組SUA、Cre、BUN、FPG、TG、HDL-C、BMI、WC、TyG、CAVI、LAP水平明顯升高,年齡、LDL-C水平明顯降低,差異有統計學意義(P<0.05)。兩組間性別構成比、收縮壓、舒張壓、TC水平比較,差異無統計學意義(P>0.05),見表1。

表1 兩組基線資料比較[M(P25,P75)或n(%)]

續表1 兩組基線資料比較[M(P25,P75)或n(%)]

組別nLDL-C(mmol/L)HDL-C(mmol/L)BMI( kg/m2)WC(cm)對照組8102.48(1.82,3.12)0.95(0.77,1.17)24.51(22.89,26.40)88.20(80.20,95.20)HUA組6442.37(1.75,2.99)1.10(0.87,1.35)25.21(23.51,26.57)88.70(79.80,99.30)Z/χ2-2.172-7.721-4.646-2.462P0.030<0.001<0.0010.014

組別nTyG CVAILAP對照組8108.57(8.23,8.90)126.97(103.29,149.30)27.66(18.20,42.01)HUA組6448.99(8.59,9.42)132.12(102.21,163.04)36.42(23.44,58.26)Z/χ2-12.847-3.005-7.648P<0.0010.003<0.001
2.2性別分層分析TyG、CVAI及LAP與HUA的關系 將研究對象按照性別進行分層分析,不同性別中,對照組與HUA組TyG、CVAI及LAP水平比較,差異有統計學意義(P<0.05),見表2。無論在總樣本,還是男性和女性中,TyG、CVAI及LAP水平升高均是HUA的獨立危險因素(P<0.05),見表3。

表2 3項指標在不同性別間的分層比較[M(P25,P75)]

表3 TyG、CVAI及LAP對HUA的影響
2.3TyG、CVAI及LAP四分位數亞組分層分析3項指標與HUA的關系 將TyG、CVAI及LAP以四分位數劃分為4個亞組(Q1、Q2、Q3和Q4組),再納入性別、年齡、血壓、Cre、TC、LDL-C等潛在協變量進行矯正分析,結果顯示, TyG中Q2、Q3、Q4組的HUA患病風險分別是Q1組的1.449、2.669、3.001倍(P=0.044、P<0.001、P<0.001),95%CI分別為1.010~2.079、1.849~3.048、2.601~3.540;CVAI中,僅Q4組的HUA患病風險是Q1組的1.892倍(P<0.001), 95%CI為1.325~2.701;LAP中,Q3、Q4組的HUA患病風險分別是Q1組的1.829、2.431倍,95%CI分別為1.264~2.646、1.548~3.017。
2.4TyG、CVAI及LAP對HUA的預測價值 TyG、CVAI和LAP 預測HUA的AUC依次為0.696、0.546和0.617,AUC均>0.500,且與AUC=0.500相比,差異有統計學意義(P<0.05)。其中,TyG 為最有價值的預測因子,最佳截斷值為8.86,靈敏度為59.47%,特異度為71.48%,見表4、圖1。

表4 TyG、CVAI和LAP 對HUA的預測性能

圖1 TyG、CVAI和LAP 預測HUA的ROC曲線
3 討 論
研究表明HUA與IR密切相關[12],IR后并發的代償性高胰島素血癥可通過影響腎小管鈉重吸收,減少尿酸排泄,進而導致HUA。相反,較高的尿酸水平會降低一氧化氮的生物利用率和線粒體氧化應激水平,導致IR。因此,在普通體檢人群中評估IR狀態不僅有助于尿酸控制,還有助于預防其他代謝疾病。傳統的IR評估工具,如高胰島素葡萄糖鉗夾試驗(HEC)和穩態模式(HOMA-IR)評估方法,由于操作復雜、有侵入性和價格昂貴,無法普遍使用。一些研究報道,TyG 與HEC、HOMA-IR評估結果保持良好的一致性,具有更好的靈敏度和特異度[13]。本研究Logistic回歸分析結果顯示,即使經過多變量矯正,TyG水平升高仍是HUA的獨立危險因素。此外,對TyG按四分位數分層分析,Q2、Q3和Q4組HUA患病風險分別是Q1組的1.449、2.669、3.001倍(P<0.05)。ROC曲線分析結果也顯示,TyG預測HUA具有一定價值(AUC=0.696,P<0.001)。這一發現與KAHAER等[14]及GU等[15]研究結果一致,進一步表明TyG與HUA之間存在穩定的正相關性(P<0.05)。可能的機制是IR通過降低脂蛋白脂肪酶活性和減少脂質沉積蛋白的產生來影響脂質代謝。同時,大量的TG被降解為游離脂肪酸,游離脂肪酸被轉運到其他組織并加速三磷酸腺苷的分解。脂質代謝異常還會損傷腎臟,降低腎血流量,減少尿酸排泄,并增加SUA水平[16]。
肥胖,特別是內臟肥胖與HUA關系密切。近年來有學者提出了CVAI和LAP兩項新的內臟肥胖指標,LAP和CVAI整合了傳統肥胖指數BMI、評估腹部肥胖的指標WC,以及與內臟脂肪分布相關的TG等指標,可以更準確地體現人體脂肪分布及脂質蓄積程度[15]。已有多項研究肯定了二者評估心血管疾病、代謝綜合征等方面的有效性,均能很更好地反映體脂水平[17-19]。本研究中,HUA組CVAI、LAP水平均明顯高于對照組,進一步將CVAI及LAP以四分位數分組,Logistic回歸分析結果顯示,CVAI中Q4組的HUA患病風險是Q1組的1.892倍;LAP中Q3、Q4組患HUA的風險分別是Q1組1.829和2.431倍。這表明CVAI和LAP 可能影響尿酸水平并增加HUA的風險,對HUA具有一定的預測能力,也進一步證實了內臟脂肪與HUA之間的相關性。其機制可能是LAP 升高表明內臟脂肪積聚增多,而后者對尿酸代謝的影響較大,內臟脂肪可促進極低密度脂蛋白和5-磷酸核糖合成磷酸核糖焦磷酸,從而導致尿酸的過度產生。同時,在中國人群中,CVAI 獨立預測HUA的效能優于BMI、WC和腰臂比[20],內臟脂肪堆積使內臟脂肪細胞分解率增加,產生大量游離脂肪酸通過門靜脈系統進入肝臟,增加TG的合成,且脂肪過度沉積可改變脂蛋白脂肪酸的活性,加速膽固醇的合成。此外,游離脂肪酸可以通過磷酸戊糖途徑增加嘌呤的合成,嘌呤加速了SUA的產生。
綜上所述,TyG、CVAI和LAP水平升高均為老年人群HUA的獨立危險因素,3項指標有潛力成為老年人群HUA風險預測因子,為盡早干預、控制SUA水平,預防HUA提供依據。

