miR-141-3p靶向調控Keap1對缺氧/復氧誘導的心肌細胞凋亡、氧化應激和Nrf2/HO-1通路的影響
秦富吉,李妮妮,鄒延新,李鳳林
急性心肌梗死是導致心血管疾病死亡的主要原因,隨著冠狀動脈介入等再灌注策略在臨床的廣泛運用,可最大限度地挽救缺血心肌,但恢復冠狀動脈血流往往對心肌造成二次損傷,即心肌缺血再灌注損傷,其中氧化應激在缺血再灌注損傷的發病機制中起著非常重要的作用[1-2]。近年來研究發現,miR-141-3p可通過調節心肌細胞存活及凋亡等相關基因改善心肌缺血再灌注損傷,劉大朋等[3]研究發現,脂多糖誘導的心肌細胞中miR-141-3p表達水平明顯降低,miR-141-3p可調控Krupec-6(KLF6)的表達影響心肌細胞炎癥反應和凋亡。Kelch樣環氧氯丙烷相關蛋白1(Keap1)是Kelch家族中的一員,生理狀態下與Nrf2形成“門閂-鉸鏈”結構。活性氧(ROS)介導的氧化應激可使Keap1構象發生變化而與Nrf2解離,Nrf2不能繼續被泛素化降解,繼而轉位至細胞核發揮轉錄活性,激活下游通路發揮抗氧化作用,因此,Keap1在Nrf2/血紅素氧合酶1(HO-1)抗氧化應激通路中發揮重要的負性調控作用[4]。本研究通過生物信息學分析顯示,Keap1是miR-141-3p的潛在靶基因,但miR-141-3p能否靶向Keap1參與對缺血再灌注心肌細胞凋亡和氧化應激的調控有待闡明。本研究通過建立缺氧/復氧(H/R)H9c2心肌細胞模型,探討miR-141-3p靶向Keap1對H/R誘導心肌細胞凋亡、氧化應激的分子機制及對制及對Nrf2/HO-1通路的影響。
1 材料與方法
1.1 實驗材料 大鼠心肌細胞H9c2購自美國細胞培養物收藏中心(American Type Culture Collection,ATCC)細胞庫,V-異硫氰酸熒光素(Annexin V-FITC)細胞凋亡檢測試劑盒、細胞毒性試驗(CCK-8)試劑盒、ROS染液、4′,6-二脒基-2-苯基吲哚(DAPI)購自碧云天生物技術有限公司,丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)檢測試劑盒購自南京建成生物科技有限公司,SYBR Green PCR試劑盒購自Thermo公司,逆轉錄試劑盒購自Fermentas,Lipofectamine 2000試劑購自美國Thermofisher公司,miR-141-3p mimics、miR-NC、Keap1-野生型(WT)質粒和Keap1-突變型(MUT)質粒均購自廣州銳博生物科技有限公司,Keap1、Nrf2和HO-1抗體由Proteintech提供,蛋白印跡電泳儀購自美國BIO-RAD公司,實時熒光定量聚合酶鏈式反應(PCR)儀(ABI 7500)。
1.2 實驗方法
1.2.1 細胞H/R模型建立 H9c2細胞采用含10%胎牛血清(FBS)的高糖DMEM培養基,置于37 ℃、5%二氧化碳(CO2)的恒溫培養箱中培養,當細胞融合度達到70%時,加入胰蛋白酶消化后進行傳代培養。取對數生長期細胞置于無血清DMEM培養基培養,并置于37 ℃、95% N2、5%CO2的培養箱中缺氧培養6 h;然后換為正常培養液,置于37 ℃、5%CO2的培養箱中復氧培養6 h,其中經過H/R處理的心肌細胞作為H/R組。
1.2.2 細胞轉染與分組 6孔板接種H9c2細胞,待細胞密度達到70%~80%,按照Lipofectamine 2000操作說明分別轉染miR-141-3p mimics、NC質粒,轉染6 h后更換培養液。實驗分為control組(正常培養的H9c2細胞)、H/R組(H9c2細胞經H/R處理)、H/R+miR-NC組(H9c2細胞NC轉染經H/R處理)和H/R+miR-141-3p組(H9c2細胞轉染miR-141-3p經H/R處理),每組設3個復孔。
1.2.3 實時熒光定量PCR法檢測H9c2細胞中miR-141-3p、Keap1 mRNA表達 取生長狀況良好的H9c2細胞,采用Trizol法提取各細胞株總RNA,所得RNA D260/D280>1.7,符合純度要求。逆轉錄和PCR反應嚴格按照試劑盒操作說明進行。PCR反應條件:95 ℃ 10 s,95 ℃ 5 s,60 ℃ 45 s,共40個循環,反應結束后通過分析Ct值,結果采用2-ΔΔCt表示miR-141-3p和Keap1 mRNA相對表達量。
1.2.4 CCK-8法檢測各組H9c2細胞存活率 取各組對數生長期的H9c2細胞,培養24 h后,每孔加入CCK-8溶液10 μL,繼續培養2 h后,使用全自動酶標儀于波長450 nm處檢測各孔吸光度值(OD),計算細胞存活率,細胞存活率(%)=(OD處理組/OD對照組)×100%。
1.2.5 流式細胞儀檢測H9c2細胞凋亡 取各組對數生長期的H9c2細胞,按照操作說明分別加入195 μL Annexin V-FITC結合液輕輕重懸細胞、10 μL Annexin V-FITC和5 μL碘化丙啶(propidium iodide,PI)染色液,室溫避光孵育15 min,隨后進行冰浴。同時以不加Annexin V-FITC及PI的一管作為陰性對照,通過流式細胞儀檢測H9c2細胞凋亡情況。
1.2.6 雙熒光素酶報告基因實驗 先用TargetScan7.1軟件預測miR-141-3p與Keap1的3′UTR之間存在堿基互補關系,然后構建野生型及突變型Keap1-3′UTR的報告基因質粒,并將所構建的質粒和miR-141-3p及其陰性對照轉染到H9c2細胞中,分為WT+miR-NC組、WT+miR-141-3p mimics組、MUT+miR-NC組、MUT+miR-141-3p mimics組,培養48 h后,嚴格按照雙熒光素酶檢測說明書操作,檢測各組熒光素酶活性。
1.2.7 蛋白免疫印跡法(Western Blotting)檢測H9c2細胞蛋白表達 分別取各組H9c2細胞置于EP試管中,應用細胞裂解液裂解細胞,提取細胞總蛋白,經過聚丙烯酰胺凝膠(SDS-PAGE)電泳、轉膜、封閉后,加入稀釋后的一抗,室溫孵育2 h,TBST洗滌后加入二抗,與膜37 ℃孵育1 h,加入化學發光試劑進行化學發光顯影,Image J軟件計算條帶灰度值,分析蛋白表達量。
1.2.8 酶聯免疫吸附測定法(ELISA)檢測SOD、MDA、GSH水平 按ELISA試劑盒說明步驟進行檢測,用酶聯儀在450 nm波長處測定各孔的光密度(OD值),根據OD值所繪制的標準曲線得出SOD、MDA、GSH表達水平。
1.2.9 二氫乙錠(DHE)染色檢測ROS含量 用稀釋后的DHE染液(稀釋濃度為1∶500)染片后,孵育洗滌;用DAPI染液室溫避光染核20 min,在熒光顯微鏡下觀察并采集圖像,用Image Pro Plus 7.0進行熒光強度分析,計算細胞ROS的含量。
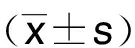
2 結 果
2.1 轉染后心肌細胞H9c2中miR-141-3p、Keap1 mRNA表達情況 通過實時定量PCR檢測miR-141-3p和Keap1 mRNA在心肌細胞H9c2的表達差異,結果顯示,與control組比較,H/R組心肌細胞中miR-141-3p表達量明顯下降(P<0.05),Keap1 mRNA表達量明顯上升(P<0.05);與H/R+miR-NC組比較,H/R+miR-141-3p組心肌細胞中miR-141-3p水平升高,Keap1 mRNA表達量明顯下降,差異均有統計學意義(P<0.05)。詳見表1。
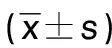
表1 各組H9c2細胞miR-141-3p和Keap1 mRNA表達比較
2.2 miR-141-3p對H/R模型H9c2細胞增殖的影響 CCK-8法檢測結果顯示,與control組比較,H/R組心肌細胞存活率明顯降低(P<0.05);與H/R+miR-NC組比較,H/R+miR-141-3p心肌細胞存活率明顯升高(P<0.05)。詳見圖1。

H/R組與control組比較,*P<0.05;H/R+miR-141-3p組與H/R+miR-NC組比較,#P<0.05。
2.3 miR-141-3p對H/R模型H9c2細胞凋亡的作用 與control組比較,H/R組心肌細胞凋亡率明顯增加(P<0.05);與H/R+miR-NC組比較,H/R+miR-141-3p組細胞凋亡率明顯降低(P<0.05)。詳見圖2。

H/R組與control組比較,*P<0.05;H/R+miR-141-3p組與H/R+miR-NC組比較,#P<0.05。
2.4 miR-141-3p對H/R模型H9c2細胞氧化應激的影響 采用DHE熒光探針檢測ROS含量,綠色熒光為ROS陽性表達,結果顯示,與control組比較,H/R組心肌細胞ROS含量明顯升高(P<0.05),與H/R+miR-NC組比較,H/R+miR-141-3p組ROS含量明顯降低(P<0.05)。ELISA結果顯示,與control組比較,H/R組心肌細胞MDA表達水平明顯升高(P<0.05),SOD和GSH表達水平明顯降低(P<0.05),與H/R+miR-NC組比較,H/R+miR-141-3p組MDA表達水平明顯降低(P<0.05),SOD和GSH表達水平明顯升高(P<0.05)。詳見圖3、表2。

圖3 各組H9c2細胞ROS的熒光染色圖(DHE染色法,×200)
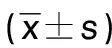
表2 各組H9c2細胞SOD、MDA、GSH含量的比較
2.5 雙熒光素酶實驗證實miR-141-3p靶向調控Keap1表達 TargetScan等生物學信息軟件預測結果顯示,Keap1是miR-141-3p的潛在靶基因。雙熒光素酶報告結果顯示,質粒與miR-NC或miR-141-3p mimics共轉染入H/R模型H9c2細胞后,與miR-NC組比較,miR-141-3p mimics組WT Keap1熒光素酶的活力值明顯降低,差異有統計學意義(P<0.05),miR-141-3p mimics組MUT Keap1熒光素酶的活力值無明顯變化,證明miR-141-3p靶向結合Keap1的3′UTR。Western Blotting進一步驗證miR-141-3p與Keap1的靶向調控關系,結果顯示,miR-141-3p mimics組H9c2心肌細胞中Keap1蛋白表達明顯低于miR-NC組(P<0.05)。詳見圖4、圖5。

圖4 miR-NC組與miR-141-3p mimics組Keap1表達雙熒光素酶報告

與miR-NC組比較,*P<0.05
2.6 miR-141-3p過表達對H/R模型H9c2細胞Nrf2/HO-1通路的影響 Western Blotting結果顯示,與control組比較,H/R組Nrf2、HO-1蛋白水平明顯降低(P<0.05);與H/R+miR-NC組比較,H/R+miR-141-3p組Nrf2、HO-1蛋白水平明顯升高(P<0.05)。詳見圖6、表3。

圖6 各組H9c2細胞Nrf2、HO-1蛋白表達的條帶圖
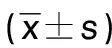
表3 各組Nrf2、HO-1蛋白相對表達量比較
3 討 論
急性心肌梗死是導致慢性心力衰竭的首要原因,也是死亡率較高的不良心血管事件之一[5]。經皮冠狀動脈介入、冠狀動脈旁路移植術等治療方法的廣泛開展,明顯降低了急性心肌梗死的死亡率,但由于缺血再灌注治療引發的心肌損傷和心臟重塑嚴重影響病人預后,Maeda等[6]研究顯示,缺血再灌注造成的心肌損傷程度甚至可能遠高于缺血造成的損傷。近期研究證實,氧化應激、能量代謝障礙、線粒體功能障礙、炎癥反應、細胞凋亡可能是心肌缺血再灌注損傷的主要機制,其中ROS介導的氧化應激導致心肌線粒體功能障礙,并與其他機制相互作用,是導致心肌缺血再灌注損傷的重要環節[7]。本研究結果顯示,H9c2細胞發生H/R后,心肌細胞ROS和MDA水平明顯升高,GSH和SOD水平明顯降低,細胞存活率明顯下降,凋亡率明顯增加,提示心肌細胞氧化應激損傷和凋亡是缺血再灌注損傷進展的關鍵,減輕心肌細胞氧化應激損傷和凋亡對防治心肌缺血再灌注損傷具有重要的意義。
miRNA是一種內源性非編碼RNA,可通過靶向結合靶基因mRNA,從而調控目的基因的表達,參與心肌缺血再灌注的信號通路,進而調控心肌細胞的存活和凋亡。秦少強等[8]通過構建心肌細胞H/R損傷模型,證實miR-202-5p靶向下調SOX6減輕H/R誘導的心肌細胞氧化應激,促進細胞存活,抑制細胞凋亡。作為miRNA家族成員之一,miR-141-3p是一種內皮細胞中豐富表達的miRNA,與心肌細胞凋亡、內皮細胞增殖和間充質干細胞衰老等有關[9-10],尹嵐軒[11]研究發現,miR-141-3p在內毒素血癥大鼠心肌組織中下調表達,其可能與心肌損傷發生有關,Zhang等[12]研究發現miR-141-3p模擬物可通過靶向Wnt5a減輕動脈粥樣硬化模型細胞的增殖和遷移,從而抑制動脈粥樣硬化進展。但miR-141-3p在心肌H/R病理過程的作用機制尚未完全闡明,本研究運用實時熒光定量PCR檢測H/R模型H9c2細胞中miR-141-3p的表達發現,miR-141-3p表達減低,進一步通過細胞凋亡、CCK-8等實驗證實,外源性上調miR-141-3p可提高H/R模型H9c2細胞的存活率,抑制心肌細胞凋亡。
Nrf2/HO-1是機體調節氧化應激的重要通路,Keap1是Nrf2 的負調控因子[13]。正常生理狀態下,Nrf2與Keap1結合并游離在細胞質中,當細胞受到氧化物攻擊時,Nrf2與Keap1解偶聯并轉移入核,造成Nrf2/HO-1通路的激活,增強機體的抗氧化能力。Wang等[14]研究證實過表達miR-200a或si-Keap1可降低脊髓損傷大鼠MDA水平,增加SOD活性和Nrf2表達及其下游HO-1等蛋白表達,發揮抗氧化作用,Chen等[15]研究證實,si-Keap1可抑制高糖介導的ROS積累,活化Nrf2/ARE信號通路,減輕氧化應激損傷。Holmstr?m等[16]研究發現,Nrf2敲除小鼠的胚胎成纖維細胞和神經膠質細胞中的線粒體膜電位和三磷酸腺苷(ATP)合成水平與野生型小鼠細胞比較均出現降低,通過藥理途徑增強Nrf2的活化,可以保護大鼠免受氧化應激損傷。本研究通過數據庫篩查和雙熒光素酶報告實驗證實,Keap1是miR-141-3p的下游靶基因,并且通過Western Blotting證實miR-141-3p可負性調控Keap1的表達。本研究結果顯示,外源性上調miR-141-3p可抑制Keap1的表達,降低心肌細胞ROS和MDA水平,增加GSH和SOD水平,激活Nrf2/HO-1信號轉導通路,從而通過減輕H/R模型H9C2細胞氧化應激和凋亡發揮保護作用。
綜上所述,miR-141-3p可通過負向調控Keap1減輕心肌細胞氧化應激水平,抑制心肌細胞凋亡,miR-141-3p和Keap1有望成為干預心肌細胞H/R的臨床治療新靶點。

