氟康唑調控NLRP3炎性小體通路對隱球菌性腦膜炎小鼠腦小膠質細胞激活的影響
付 群,李長新,王 佳,宋 昕
隱球菌性腦膜炎(cryptococcal meningitis)是由嚴重的真菌感染而引發的疾病,通過血源性擴散從原發性肺病灶擴散至大腦,該疾病常見于細胞介導的免疫功能低下人群,具有極高的發病率和死亡率,因此,α詳細了解其治療藥物對該疾病的治療機制十分必要[1-3]。NOD樣受體蛋白3(NOD-like receptor protein 3,NLRP3)炎性小體可通過響應微生物感染和細胞損傷,激活含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase-1),并介導促炎細胞因子白介素-1β(interleukin-1β,IL-1β)的分泌,是先天免疫系統的重要組成部分,其異常激活與炎癥性疾病密切有關[4]。有研究表明,新生隱球菌可依賴于鉀離子外流和吞噬溶酶體膜的滲漏激活炎性小體,而抑制NLRP3炎性小體的激活可有效改善隱球菌性腦膜炎造成的腦損傷[5]。氟康唑(fluconazole)是一種唑類藥物,具有有效的抗真菌活性,能夠高效率穿過血腦屏障,已被用于治療隱球菌性腦膜炎[6]。目前,關于氟康唑的研究多與臨床相關,而關于其對隱球性菌腦膜炎的治療機制是否與NLRP3炎性小體有關尚未明確。因此,本研究通過構建隱球菌性腦膜炎小鼠模型,探究氟康唑是否可通過調控NLRP3炎性小體通路影響隱球菌性腦膜炎小鼠腦小膠質細胞的激活。
1 材料與方法
1.1 實驗動物 健康的雄性C57BL/6小鼠100只,體質量15~22 g,購自華中科技大學動物實驗中心,許可證號:SCXK(鄂)2016—0009,于12 h/12 h正常明暗交替、相對濕度40%~70%的環境中適應性飼養7 d,期間自由采食、飲水。動物實驗符合國家倫理準則及實驗室動物護理及使用方針,且實驗過程中嚴格進行質量控制。
1.2 細菌培養 于沙保斜面培養基中接種隱球菌菌株后,在35 ℃、5% CO2培養箱培養3 d,生理鹽水沖洗后將懸浮液調整為4.8×105cfu/mL。
1.3 主要試劑及儀器 隱球菌菌株購自上海醫學真菌實驗室;腫瘤壞死因子(tumor necrosis factor,TNF)-α、白細胞介素-6(IL-6)、白細胞介素-10(IL-10)酶聯免疫吸附試驗(ELISA)檢測試劑盒(貨號:CSB-EQ023955MO-1、CSB-E04639m-1、E-EL-M0046km)購自上海恒斐生物科技有限公司;氟康唑標準品(純度:99%,規格:5 g,貨號:K0040)購自上海寶曼生物科技有限公司;注射用兩性霉素B(規格:每支25 mg,國藥準字H13020284)購自華北制藥股份有限公司;蘇木精-伊紅(HE)染色試劑盒(貨號:G1120-100)購自北京索萊寶科技有限公司;四甲基偶氮唑藍(MTT)檢測試劑盒、免疫組化試劑盒購自上海嶸崴達實業有限公司(貨號:4890-025-K、11719386001);二喹啉甲酸(BCA)蛋白檢測試劑盒、免疫熒光試劑盒、DMEM/F12培養基、兔抗鼠離子鈣結合銜接分子1(ionized calcium binding adapter molecule 1,Iba1)購自北京百奧萊博科技有限公司(貨號:ALH371-QIP、KFS019、SNM544-UEO、K18238-XID);兔抗鼠甘油醛-3-磷酸脫氫酶(GAPDH)、辣根過氧化物酶(HRP)標記的山羊抗兔免疫球蛋白G(IgG)二抗抗體均購自亞科因(武漢)生物技術有限公司(貨號:A01021、A21020);兔抗鼠Rab5購自上海恒斐生物科技有限公司(貨號:Rab5 Antibody);兔抗鼠Caspase-1購自武漢博歐特生物科技有限公司(貨號:orb621674);NLRP3購自上海碧云天生物技術有限公司(貨號:AF2155);蛋白提取試劑盒購自武漢純度生物科技有限公司(貨號:CD-13559-ML);新型隱球菌購自北京北納創聯生物技術研究院(編號:BNCC225501);蛋白凝膠成像儀購自美國Bio-Rad公司;熒光顯微鏡購自奧林巴斯。
1.4 方法
1.4.1 動物模型制備及分組給藥 將50 g氟康唑溶于500 mL生理鹽水中配制成100 mL含0.4 g氟康唑的注射液。將實驗小鼠隨機分為假手術組(sham組)、隱球菌性腦膜炎模型組(CM組)、兩性霉素B組(AmB組)、氟康唑低劑量組(FCZ-L組)、氟康唑高劑量組(FCZ-H組),每組20只[7]。除對照組外其余小鼠用10 mL/kg戊巴比妥鈉麻醉、消毒后切開顱頂皮膚暴露顱骨,沿中線后3 mm、側面1 mm部位注射2 μL隱球菌懸液后縫合(針頭插入3 mm,持續10 min)[8];sham組僅穿刺不注射。造模成功后AmB組鞘內注射0.7 mg/kg 兩性霉素B,FCZ-L組與FCZ-H組分別注射20 mg/kg、40 mg/kg氟康唑,sham組及CM組注射等量生理鹽水,為期2周,記錄小鼠死亡情況。
1.4.2 ELISA法檢測腦脊液中炎性因子的表達水平 實驗結束后隨機取5只小鼠暴露寰枕膜,1 mL注射器針尖刺入蛛網膜下隙抽取腦脊液(0.5 mL),根據ELISA檢測試劑盒說明書檢測TNF-α、IL-6、IL-10表達水平。
1.4.3 HE染色觀察腦組織病理學變化 小鼠頸椎脫臼處死后取出腦組織,在4%多聚甲醛固定后用石蠟包埋后切片(4 μm),二甲苯(10 min)脫蠟,依次使用100%、95%、85%、70%的乙醇處理5 min后進行HE染色(蘇木精染色5 min,0.5%伊紅染色2 min),脫水,封片,顯微鏡觀察。
1.4.4 免疫組化法檢測Iba1表達 將石蠟切片脫水后緩沖液沖洗,3% H2O2除去內源性過氧化物酶后(10 min)加100 μL 90%的牛血清清蛋白(孵育20 min),再加入一抗過夜,加二抗30 min、磷酸緩沖鹽溶液(PBS)沖洗后加入ABC復合物、二氨基聯苯胺(DBA)顯色觀察5 min(棕色即為陽性),軟件Image-Pro Plus對陽性染色光密度均值進行計算。
1.4.5 小膠質細胞分離純化 另取5只小鼠頸椎脫臼處死后將剝離腦膜的腦組織在胰酶中懸浮消化后吹打均勻移入離心管中,經網篩過濾后分裝離心(4 000 r/min離心10 min),去上清,經DMEM/F12培養基重懸后接種于細胞培養瓶中(1×106個/mL),恒溫搖床37 ℃、250 r/min連續搖動,所得新細胞懸浮液移入新培養瓶37 ℃、5% CO2培養箱培養1 h,除去未貼壁細胞即為純化小膠質細胞。
1.4.6 MTT法檢測腦小膠質細胞的細胞活力 將純化后細胞稀釋為1×105個/mL接種100 μL于96孔板中培養24 h后,根據試劑盒說明書使用MTT法檢測細胞活力,在490 nm處測定吸光度OD值,計算小膠質細胞的細胞存活率:細胞存活率(%)=(OD處理組/OD對照組)×100%。
1.4.7 免疫熒光檢測Rab5表達 所得小膠質細胞用PBS(0.01 mol/L)沖洗3次(每次5 min),胰酶消化,DMEM/F12培養基重懸調整至細胞密度4×105個/mL。細胞爬片、4%多聚甲醛固定(15 min)后置于Triton X-100(0.5%)10 min,再放入牛血清清蛋白(2%)1 h,添加一抗(1∶500),過夜,PBS(0.01 mol/L)沖洗,加入二抗(1∶100)2 h,PBS沖洗,熒光顯微鏡觀察并用軟件Image-Pro Plus對平均熒光強度進行分析。
1.4.8 蛋白免疫印跡法(Western Blot)檢測蛋白表達 用苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)裂解細胞,冰浴30 min后12 000 r/min離心10 min獲取上清液,用BCA試劑盒檢測總蛋白含量。加入蛋白進行10%聚丙烯酰胺凝膠(SDS-PAGE)電泳后低溫轉膜,脫脂奶粉(5%)進行1 h封閉,洗膜3次,加入GAPDH、Caspase-1、NLRP3(1∶1 000)一抗后4 ℃孵育過夜,再加入二抗(1∶5 000)孵育2 h,蛋白凝膠成像儀進行Caspase-1、NLRP3定量分析。
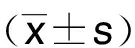
2 結 果
2.1 各組小鼠死亡率比較 2周后,sham組、CM組、AmB組、FCZ-L組、FCZ-H組小鼠死亡率分別為5%、35%、5%、10%、5%。與sham組比較,CM組小鼠死亡率升高(P<0.05);與CM組比較,AmB組、FCZ-L組、FCZ-H組小鼠死亡率明顯降低(P<0.05)。詳見圖1。
CM組與sham組比較,*P<0.05;與CM組比較,#P<0.05。
2.2 各組小鼠腦脊液中TNF-α、IL-6和IL-10水平比較 與sham組比較,CM組TNF-α、IL-6水平明顯增加(P<0.05),而IL-10水平明顯降低(P<0.05);與CM組比較,AmB組、FCZ-L組、FCZ-H組TNF-α、IL-6水平明顯降低(P<0.05),而IL-10水平明顯增加(P<0.05)。詳見表1。
表1 各組小鼠腦脊液中TNF-α、IL-6和IL-10水平比較 單位:pg/mL
2.3 各組小鼠腦組織病理學檢測結果 sham組腦組織正常,未見炎癥癥狀及壞死現象;CM組腦組織中炎癥細胞大量滲出,出現血管充血、壞死灶及隱球菌生物;與CM組比較,AmB組、FCZ-L組、FCZ-H組小鼠腦組織中炎癥細胞、壞死灶及隱球菌生物明顯減少。詳見圖2。
2.4 各組小鼠腦小膠質細胞活化標志物Iba1表達比較 在細胞核與細胞質中均存在Iba1陽性表達,與sham組比較,CM組小膠質細胞活化標志物Iba1陽性表達明顯增加(P<0.05);與CM組比較,AmB組、FCZ-L組、FCZ-H組Iba1陽性表達明顯降低(P<0.05)。詳見圖3及表2。
表2 各組腦小膠質細胞活化標志物Iba1表達比較 單位:%

圖3 免疫組化檢測各組小鼠腦小膠質細胞活化標志物Iba1表達(×400)
2.5 各組小鼠腦小膠質細胞存活率比較 與sham組比較,CM組小膠質細胞存活率明顯增加(P<0.05);與CM組比較,AmB組、FCZ-L組、FCZ-H組細胞存活率明顯降低(P<0.05)。詳見表3。
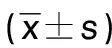
表3 各組小鼠腦小膠質細胞存活率比較 單位:%
2.6 各組小鼠腦小膠質細胞吞噬標志物Rab5表達比較 免疫熒光檢測結果發現,與sham組比較,CM組Rab5陽性表達明顯降低(P<0.05);與CM組比較,AmB組、FCZ-L組、FCZ-H組Rab5陽性表達明顯增加(P<0.05)。詳見圖4及表4。
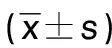
表4 各組Rab5陽性表達率比較 單位:%
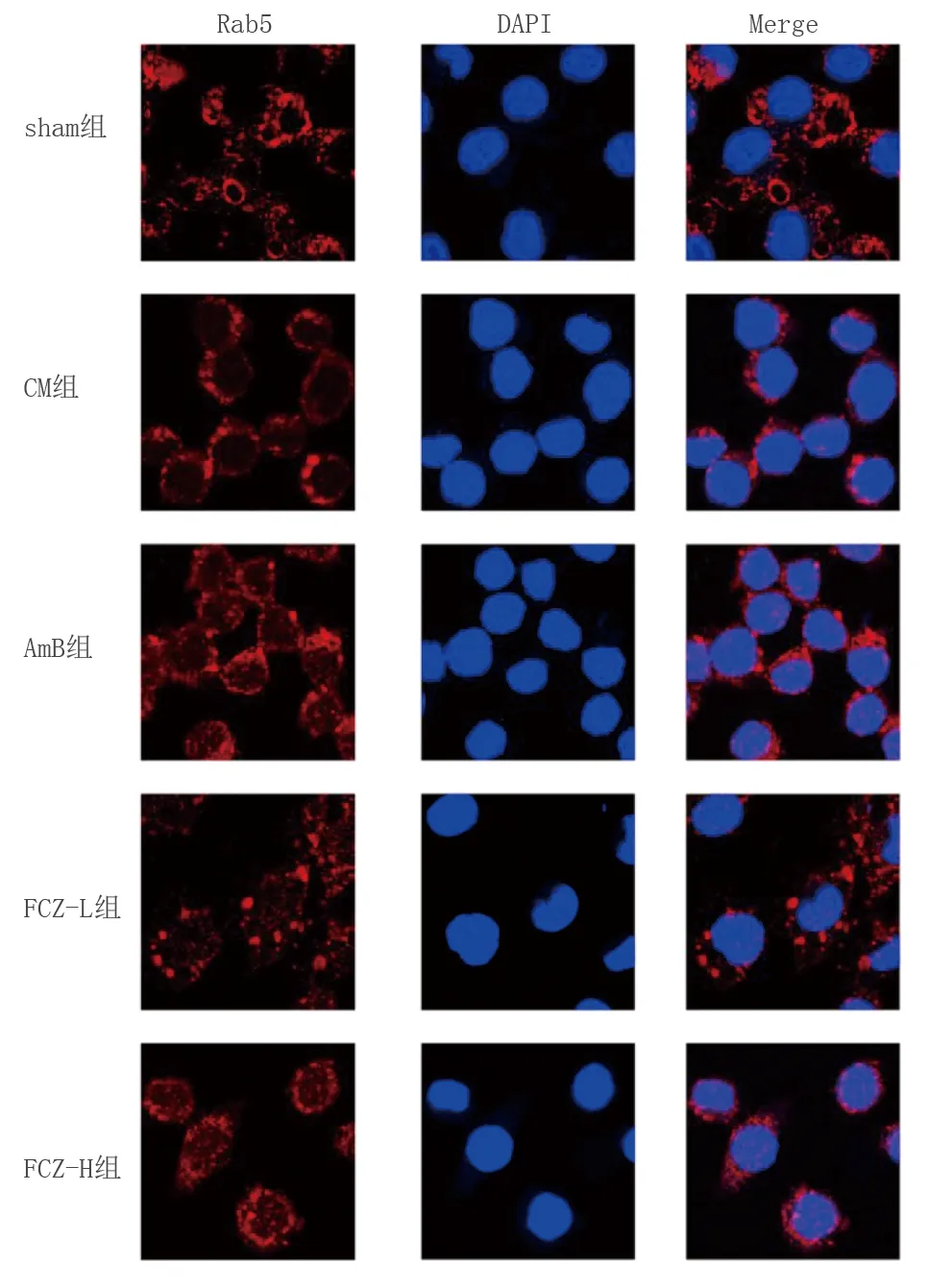
圖4 免疫熒光檢測各組腦小膠質細胞吞噬標志物Rab5表達(×400)
2.7 各組NLRP3炎性小體通路相關蛋白表達比較 與sham組比較,CM組小膠質細胞內NLRP3炎性小體通路相關蛋白Caspase-1、NLRP3表達明顯增加(P<0.05);與CM組比較,AmB組、FCZ-L組、FCZ-H組Caspase-1、NLRP3表達明顯降低(P<0.05)。詳見表5及圖5。
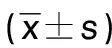
表5 各組NLRP3炎性小體通路相關蛋白表達比較
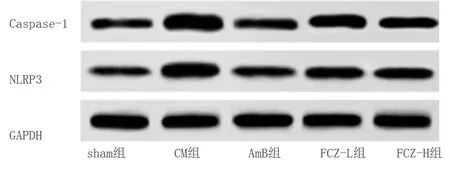
圖5 各組NLRP3炎性小體通路相關蛋白表達條帶圖
3 討 論
隱球菌性腦膜炎是慢性中樞神經系統感染的常見原因之一,具有極高的致死性,1年內的死亡率為70%,而在全球范圍內占艾滋病相關死亡的15%[9-10]。臨床上隱球菌性腦膜炎的治療方法是使用藥物抑制隱球菌從而達到治療目的。
氟康唑由于能夠高效率穿過血腦屏障起到抗真菌作用,在體內和體外均能夠有效抑制隱球菌,因此已被用于治療隱球菌性腦膜炎[11-12]。兩性霉素B同樣在隱球菌性腦膜炎治療中具有抗菌作用,研究表明兩性霉素B與氟康唑聯合使用能有效減少病人腦脊液中隱球菌數量以及炎癥反應的發生,改善病人預后情況[13]。中樞神經系統中最為重要的免疫細胞是小膠質細胞,其在機體損傷時會由靜止狀態轉變為激活狀態,聚集到損傷部位引起炎癥反應,因此,可作為大腦的監測器[8]。Iba1作為小膠質細胞的標志物,在小膠質細胞活化后其表達明顯增加[14-15]。Rab5作為小膠質細胞/巨噬細胞吞噬的標志物,是Ras家族成員之一,位于早期內體并在早期內體和胞吞泡融合過程中起重要調控作用[8]。隱球菌可導致早期吞噬體標志物Rab5的過早清除,從而降低Rab5表達水平[16]。隱球菌性腦膜炎小鼠模型中小膠質細胞處于激活狀態,Iba1表達水平明顯增加,而Rab5表達水平則明顯降低[17]。兩性霉素B能通過抑制核因子κB(nuclear factor kappa-B,NF-κB)通路的激活來抑制腦組織損傷,從而對隱球菌性腦膜炎起到治療作用[8]。本研究結果發現,氟康唑能夠明顯降低隱球菌性腦膜炎小鼠死亡率、細胞存活率、腦組織損傷程度、Iba1表達,增加Rab5陽性表達,表明氟康唑能夠有效抑制隱球菌性腦膜炎小鼠小膠質細胞活化,以此緩解腦組織損傷,從而在隱球菌性腦膜炎中具有有效治療作用。
炎性小體的激活是一個重要的炎癥途徑,炎性小體可表達于中樞神經系統中的小膠質細胞,參與中樞神經系統的炎癥反應,而NLRP3炎性小體在中樞神經系統中分布最廣,可經由微生物感染及細胞損傷活化,并通過剪切激活Caspase-1,從而介導促炎細胞因子的分泌,是宿主針對真菌、病毒、細菌感染的免疫防御的關鍵所在,NLRP3炎性小體的異常激活可導致炎癥性疾病的發生[4,18-19]。TNF-α、IL-6是免疫系統中典型的促炎因子,而IL-10是抗炎細胞因子,三者對炎癥反應的發生起重要調節作用。有研究表明,在腦膜炎大鼠小膠質細胞中NLRP3、Caspase-1表達水平明顯增加[20]。而本研究發現,氟康唑可明顯降低隱球菌性腦膜炎小鼠腦脊液中TNF-α、IL-6水平及小膠質細胞中Caspase-1、NLRP3表達,增加腦脊液中IL-10水平。表明氟康唑可有效抑制隱球菌性腦膜炎小鼠腦小膠質細胞中NLRP3炎性小體通路的激活,從而抑制炎癥反應的過度激活,提示氟康唑抑制隱球菌性腦膜炎小鼠腦小膠質細胞的活化可能與該通路有關。
綜上所述,氟康唑對隱球菌性腦膜炎的治療可能與其抑制NLRP3炎性小體通路的激活來抑制小膠質細胞活化有關,本研究對氟康唑在隱球菌性腦膜炎中的治療機制的研究具有重要參考價值,但關于氟康唑在隱球菌性腦膜炎治療過程中的最佳劑量還需進一步研究。

