血管內超聲特征對不穩定型心絞痛病人PCI術后支架內再狹窄風險的預測價值
王 磊,杜長春,黃丙森
不穩定型心絞痛是由動脈粥樣硬化斑塊破裂或血栓形成引起的急性冠脈綜合征,經皮冠狀動脈介入治療(percutaneous coronary intervention,PCI)是治療不穩定型心絞痛的重要手段[1]。但PCI術后病人易發生支架內再狹窄(in-stent restenosis,IRS),盡管病人接受可吸收聚合物和新型抗增殖劑的新型藥物洗脫支架治療,術后仍有約10%的病人發生IRS,影響病人預后[2]。既往研究指出,除植入支架的類型外,合并糖尿病、既往搭橋手術也是IRS的預測因素[3]。也有研究指出,相比糖尿病、既往搭橋手術等對IRS的影響,病人自身血管功能及損傷情況對IRS的影響更大[4]。冠狀動脈造影是診斷PCI術后IRS的金標準,但其也存在僅能顯示被造影劑填充的管腔輪廓,無法診斷早期血管病變的局限性[5]。血管內超聲(intravenous ultrasound,IVUS)技術可觀察血管壁及其早期冠狀動脈斑塊結構及組成,在早期穩定型心絞痛診治及預后預測中具有重要指導作用[6]。這為不穩定型心絞痛病人PCI術后IRS的預測提供了新思路,鑒于此,本研究采集病人IVUS特征,旨在探討IVUS特征對不穩定型心絞痛病人PCI術后IRS風險的預測價值。
1 資料與方法
1.1 一般資料 回顧性納入2018年3月—2021年5月我院收治的60例PCI術后IRS的不穩定型心絞痛病人(IRS組)和60例PCI術后支架內未出現再狹窄的不穩定型心絞痛病人(非IRS組)為研究對象。納入標準:①符合不穩定型心絞痛的診斷標準,年齡50~70歲;②接受PCI治療,植入支架為Firebird雷帕霉素藥物洗脫支架;③接受西藥常規治療,包括阿司匹林、硫酸氫氯吡格雷、他汀類、β受體阻滯劑和血管緊張素轉化酶抑制劑;④臨床資料完整。排除標準:①既往PCI術史,心肌梗死史,合并心肌病、瓣膜病等心臟疾病病人;②合并凝血功能障礙者或合并嚴重肝腎功能不全者;③病人在觀察時間內發生其他心血管事件,如急性心肌梗死,需調整診療方案者。本研究經醫院倫理委員會審核批準。
1.2 方法
1.2.1 臨床資料收集 收集病人入院時一般資料、臨床檢查資料、實驗室檢查資料、影像學資料等。一般資料包括病人年齡、性別、體質指數、吸煙情況,是否合并糖尿病、高血壓等基礎疾病。臨床檢查資料包括病變血管、植入支架數量、支架總長度、不穩定型心絞痛分級等。實驗室檢查資料包括低密度脂蛋白、總膽固醇、血小板計數等。影像學資料包括IVUS特征,如冠狀動脈橫截面積、外彈性膜截面積、斑塊負荷等。
1.2.2 質量控制 所有資料收集、整理均由2名專職人員完成,數據收集、整理過程中剔除不合理數據,數據錄入采用雙平行錄入法錄入。
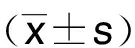
2 結 果
2.1 兩組臨床資料比較 IRS組低密度脂蛋白及總膽固醇高于非IRS組(P<0.05)。詳見表1。

表1 兩組臨床資料比較
2.2 兩組病人IVUS特征比較 IRS組冠狀動脈橫截面積低于非IRS組,外彈性膜截面積、斑塊負荷高于非IRS組,差異均有統計學意義(P<0.05)。詳見表2。
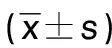
表2 兩組病人IVUS特征比較
2.3 不穩定型心絞痛病人PCI術后IRS發生風險的多因素Logistic回歸分析 以不穩定型心絞痛病人PCI術后是否發生IRS為因變量,病人低密度脂蛋白、總膽固醇、外彈性膜截面積、斑塊負荷、冠狀動脈橫截面積為自變量,進行多因素Logistic回歸分析。結果顯示,高低密度脂蛋白(OR=1.512)、高外彈性膜截面積(OR=1.183)、高斑塊負荷(OR=1.175)是不穩定型心絞痛病人PCI術后IRS發生的危險因素(P<0.05),高冠狀動脈橫截面積(OR=0.588)是不穩定型心絞痛病人PCI術后IRS發生的保護因素(P<0.05)。詳見表3。

表3 不穩定型心絞痛病人PCI術后IRS發生風險的多因素Logistic回歸分析
2.4 不穩定型心絞痛病人PCI術后IRS發生風險影響因素預測效能分析 繪制ROC曲線及Delong分析顯示,冠狀動脈橫截面積預測不穩定型心絞痛病人PCI術后IRS發生風險的AUC為0.768,高于低密度脂蛋白、外彈性膜截面積、斑塊負荷(P<0.05)。詳見表4、圖1。

圖1 不穩定型心絞痛病人PCI術后IRS發生風險影響因素的ROC曲線

表4 不穩定型心絞痛病人PCI術后IRS發生風險影響因素的預測效能分析
3 討 論
不穩定型心絞痛病人PCI術后IRS的發生率為2%~10%,約增加病人2.8%的死亡風險[7]。因此,有效識別不穩定型心絞痛病人PCI術后IRS發生的高危病人,并予以針對性措施預防IRS的發生是診療IRS的首要任務。既往研究證實,血管功能損傷是不穩定型心絞痛病人PCI術后IRS發生的重要預測因素,更嚴重的血管損傷會增加新內膜增生的程度,支架植入時的機械損傷可激活凝血系統,導致纖維蛋白凝塊的形成,促進巨噬細胞遷移到受傷的血管壁中,利于IRS的發生[8]。既往研究中多采用冠狀動脈造影檢測病人血管功能情況,但冠狀動脈造影技術無法準確診斷冠狀動脈早期病變,且易低估病變范圍,影響預測效能[9]。IVUS可診斷早期冠狀動脈病變,并可觀察冠狀動脈斑塊結構和斑塊組成。既往有研究將其應用于冠心病病人PCI術后預后的預測中,并顯示出顯著臨床效果[10]。為此,本研究將IVUS應用于不穩定型心絞痛病人PCI術后IRS的發生預測中,探討其是否也具有顯著臨床價值。
本研究回顧性評估了IVUS特征在不穩定型心絞痛病人PCI術后IRS發生中的預測價值,結果顯示,IVUS特征中冠狀動脈橫截面積、外彈性膜截面積及斑塊負荷可用于預測不穩定型心絞痛病人PCI術后IRS的發生,且冠狀動脈橫截面積顯示出最佳臨床效果。PCI術后IRS發生的機制為血管損傷后新內膜增生的程度增加,導致血流量減少,植入的支架支柱觸發血液凝固激活,使纖維蛋白凝塊形成,促進了巨噬細胞遷移到受傷的血管壁,利于斑塊形成,加大斑塊負荷,進而導致IRS的發生[11]。冠狀動脈橫截面積減小,表明血管損傷嚴重以及存在內皮覆蓋受損、持續纖維蛋白沉積和持續嚴重的血管壁炎癥,新內膜增生加大,利于IRS的發生。Shlofmitz等[12]指出PCI術后最小管腔直徑較小的病人發生ISR的風險明顯增高,進一步研究發現PCI術后最小管腔直徑≤2.4 mm是PCI病人術后發生ISR的臨界值,發生風險比值為1.233[95%CI(1.174,1.980)][13],從側面證實本研究結論。
低密度脂蛋白是動脈粥樣硬化和心血管疾病的重要危險因素。本研究發現,低密度脂蛋白也是不穩定型心絞痛病人PCI術后IRS發生的危險因素。ISR的發生機制之一是新內膜內發生新動脈粥樣硬化。PCI術后支架內新內膜形成,ISR是由于新內膜形成后新動脈硬化的進展引起的。低密度脂蛋白在該過程中發生重要作用。低密度脂蛋白增加誘導的動脈壁中脂質積聚引起動脈粥樣硬化,損傷血管功能,誘導內皮細胞凋亡及內皮細胞中單核/巨噬細胞遷移,促進內皮細胞中單核細胞趨化蛋白-1(MCP-1)的表達以及血管平滑肌細胞中早期生長反應因子-1 mRNA和蛋白的表達[14],從而誘導炎癥的發生,進而促進新內膜形成,利于IRS發生。Qin等[15]研究表明,病人低密度脂蛋白每升高1 mmol/L,IRS發生風險增高2.8倍。
綜上所述,IVUS特征中冠狀動脈橫截面積、外彈性膜截面積、斑塊負荷及低密度脂蛋白可用于不穩定型心絞痛病人PCI術后IRS風險的預測。但本研究也存在諸多不足,首先,為回顧性研究,存在回顧性研究的固有偏倚;其次,本研究為單中心研究,研究結果僅可解釋本研究中心結果;最后,僅納入了年齡50~70歲的病人,研究結果可能存偏倚。后期需開展多中心、前瞻性研究以進一步驗證。

