LncRNA CYTOR對大鼠背脊髓神經元細胞損傷及炎性因子的影響
殷德振 陳聰 王鵬 王元浩 李宏達
脊髓損傷是一種具有高致殘率與致死率的疾病類型之一,并可促使肢體癱瘓或勞動力喪失,已嚴重降低患者生活質量,目前脊髓損傷尚無有效的治療方法[1]。脊髓神經元細胞凋亡及其突出結構及功能喪失是脊髓損傷的病理學基礎,缺氧或相關應激條件下,脊髓神經元細胞可產生大量氧自由基從而促使細胞發(fā)生氧化應激反應,進而促進細胞凋亡[2]。長鏈非編碼RNA(LncRNA)差異性表達與脊髓損傷密切相關,并可能作為脊髓損傷診斷及治療的潛在靶點[3,4]。LncRNA CYTOR低表達于損傷的軟骨細胞中,上調其表達可抑制軟骨細胞凋亡并促進細胞增殖[5]。但LncRNA CYTOR與脊髓損傷相關性研究尚未見報道。Starbase預測顯示LncRNA CYTOR與miR-136-5p存在互補序列。研究表明,miR-136-5p在脊髓損傷中表達上調,并可促進炎性因子表達[6]。但筆者發(fā)現(xiàn),LncRNA CYTOR/miR-136-5p分子軸在脊髓損傷的發(fā)生發(fā)展過程中具體作用機制尚不明確。因此,本研究通過構建大鼠背脊髓神經元細胞細胞損傷模型,探討LncRNA CYTOR對過氧化氫(H2O2)誘導的大鼠背脊髓神經元細胞損傷過程的影響及與miR-136-5p的關系。報告如下。
1 材料與方法
1.1 材料與試劑 大鼠背脊髓神經元細胞(上海瑄科生物科技有限公司);H2O2(美國Sigma);Trizol試劑(美國Thermo Fisher);miRNA提取試劑盒、反轉錄試劑盒及PCR試劑盒(北京天根生化科技有限公司);Lipofectamine2000轉染試劑(美國Invitrogen);pcDNA、pcDNA-LncRNA CYTOR、miR-NC、miR-136-5p mimics(上海吉瑪制藥技術有限公司);MTT試劑盒、細胞凋亡檢測試劑盒(北京索萊寶科技有限公司);IL-6、IL-21 ELISA檢測試劑盒(武漢華美生物工程有限公司);雙熒光素酶報告基因檢測試劑盒(美國Promega);兔抗鼠Bax、Bcl-2、GAPDH單克隆抗體及辣根過氧化物酶標記的山羊抗兔IgG多克隆抗體(美國Santa Cruz)。9602A酶標儀(北京普朗醫(yī)療器械公司);StepOnePlus實時熒光定量PCR儀(美國ABI);FACS Calibur流式細胞儀(美國Beckman Coulter)。
1.2 方法
1.2.1 實驗處理及分組:大鼠背脊髓神經元細胞放入含有濃度為100 μmol/L H2O2的培養(yǎng)基培養(yǎng)24 h[7],記為H2O2組。同時將正常培養(yǎng)的大鼠背脊髓神經元細胞記為con組。培養(yǎng)的大鼠背脊髓神經元細胞生長融合至70%時進行轉染,轉染方法:以不含血清的培養(yǎng)基稀釋Lipofectamine2000轉染試劑,另外以不含血清的培養(yǎng)基稀釋pcDNA、pcDNA-LncRNA CYTOR、pcDNA-LncRNA CYTOR和miR-NC、pcDNA-LncRNA CYTOR和miR-136-5p mimics,將二者充分混勻后于37℃條件下靜置20 min。加入大鼠背脊髓神經元細胞,6 h后更換為正常培養(yǎng)基培養(yǎng)48 h。實驗分組:轉染完成后將上述細胞培養(yǎng)基更換為含有100 μmol/L H2O2的培養(yǎng)基培養(yǎng)24 h,分別記為H2O2+pcDNA組、H2O2+pcDNA-LncRNA CYTOR組、H2O2+pcDNA-LncRNA CYTOR+miR-NC組和H2O2+pcDNA-LncRNA CYTOR+miR-136-5p組。
1.2.2 LncRNA CYTOR、miR-136-5p表達水平檢測:取大鼠背脊髓神經元細胞加入Trizol試劑,通過miRNA提取試劑盒提取總RNA保存于-80℃冰箱內。參照反轉錄試劑盒說明書將RNA反轉錄合成cDNA后置于-20℃冰箱內保存。cDNA稀釋后進行qRT-PCR反應,通過制備qRT-PCR反應體系后設置反應程序(預變性95℃ 2 min,變性95℃ 30 s,退火60℃ 30 s,延伸72℃ 30 s,共40個循環(huán))。GAPDH作為LncRNA CYTOR的內參照物,U6作為miR-136-5p的內參照物,用2-ΔΔCt法統(tǒng)計結果。
1.2.3 細胞增殖檢測:取4組大鼠背脊髓神經元細胞,加入0.25%胰蛋白酶消化后接種至96孔板(1×103個/孔),然后置于培養(yǎng)箱內培養(yǎng)并加入20 μl的MTT溶液,孵育4 h后棄上清,每孔加入150 μl DMSO,室溫下振蕩反應5 min,置于多功能酶標儀檢測490 nm波長處吸光度值(A),并計算細胞增殖抑制率。
1.2.4 細胞凋亡率檢測:首先用0.25%胰蛋白酶消化并收集4組大鼠背脊髓神經元細胞,后將細胞放入離心機內離心,棄上清液,重懸于500 μl的結合緩沖液中,分別加入Annexin V-FITC和PI各5 μl,室溫條件下避光振蕩孵育5 min,然后用流式細胞儀檢測并計算細胞凋亡率。
1.2.5 IL-6、IL-21的水平檢測:分別取4組大鼠背脊髓神經元細胞培養(yǎng)上清液,根據(jù)ELISA試劑盒說明書操作步驟檢測IL-6、IL-21的水平。
1.2.6 LncRNA CYTOR與miR-136-5p的靶向關系檢測:LncRNA CYTOR與miR-136-5p的結合位點及其突變位點分別克隆至pGL3質粒中構建野生型載體wt-LncRNA CYTOR、突變型載體mut-LncRNA CYTOR,參照“1.2.1”轉染方法將含有結合位點的wt-LncRNA CYTOR及其突變位點的mut-LncRNA CYTOR分別與miR-NC、miR-136-5p mimics共轉染大鼠背脊髓神經元細胞,常規(guī)培養(yǎng)24 h后,分別檢測各細胞的熒光素酶活性。參照“1.2.1”轉染方法將pcDNA、pcDNA-LncRNA CYTOR分別轉染至大鼠背脊髓神經元細胞,培養(yǎng)48 h后收集細胞并采用qRT-PCR法檢測miR-136-5p相對表達量。
1.2.7 Bax、Bcl-2蛋白表達量檢測:分別收集4組大鼠背脊髓神經元細胞,加入細胞裂解液提取總蛋白。BCA法檢測蛋白濃度后將蛋白沸水浴變性。按40 μg/孔蛋白加入凝膠中進行SDS-PAGE、轉膜后并進行室溫封閉2 h,分別加入Bax(1∶1 000)、Bcl-2(1∶1 000)、GAPDH(1∶3 000)抗體稀釋液4℃孵育過夜,次日加入IgG(1∶5 000)二抗稀釋液,室溫下孵育2 h后用TBST充分洗滌,通過Quantity One軟件分析Bax、Bcl-2蛋白相對表達量。
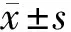
2 結果
2.1 大鼠背脊髓神經元細胞中LncRNA CYTOR和miR-136-5p的表達 與con組比較,H2O2組LncRNA CYTOR的表達量降低(P<0.05),miR-136-5p的表達量升高(P<0.05)。見表1。
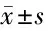
表1 LncRNA CYTOR和miR-136-5p表達的檢測 n=9,
2.2 LncRNA CYTOR和miR-136-5p轉染效率的檢測 與pcDNA組比較,pcDNA-LncRNA CYTOR組LncRNA CYTOR的表達量升高(P<0.05);與miR-NC組比較,miR-136-5p組miR-136-5p的表達量升高(P<0.05)。見表2。
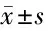
表2 轉染效率檢測 n=9,
2.3 LncRNA CYTOR對大鼠背脊髓神經元細胞的影響 與con組比較,H2O2組細胞增殖抑制率、凋亡率和、Bax蛋白表達及IL-6、IL-21水平升高,Bcl-2蛋白表達降低(P<0.05);與H2O2+pcDNA組比較,H2O2+pcDNA-LncRNA CYTOR組細胞增殖抑制率、凋亡率、Bax蛋白表達及IL-6、IL-21水平降低(P<0.05),Bcl-2蛋白表達升高(P<0.05)。見圖1、表3。

圖1 LncRNA CYTOR對大鼠背脊髓神經元細胞凋亡及凋亡相關蛋白表達的影響
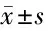
表3 LncRNA CYTOR對大鼠背脊髓神經元細胞抑制率、凋亡率、炎性因子的檢測 n=9,
2.4 LncRNA CYTOR靶向、調控miR-136-5p LncRNA CYTOR和miR-136-5p的互補序列。與miR-NC相比,miR-136-5p過表達可抑制wt-LncRNA CYTOR的熒光素酶活性(P<0.05),而未能影響mut-LncRNA CYTOR的熒光素酶活性。與pcDNA組比較,pcDNA-LncRNA CYTOR組miR-136-5p的表達量升高(P<0.05)。見圖2,表4、5。

圖2 LncRNA CYTOR和miR-136-5p的互補序列
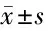
表4 雙熒光素酶報告實驗 n=9,
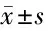
表5 LncRNA CYTOR調控miR-136-5p的表達 n=9,
2.5 miR-136-5p對LncRNA CYTOR處理的大鼠背脊髓神經元細胞的影響 與H2O2+pcDNA-LncRNA CYTOR+miR-NC組比較,H2O2+pcDNA-LncRNA CYTOR+miR-136-5p組細胞增殖抑制率、凋亡率、Bax蛋白表達及IL-6、IL-21水平升高(P<0.05),Bcl-2蛋白表達降低(P<0.05)。見圖3、表6。

圖3 miR-136-5p對LncRNA CYTOR處理的大鼠背脊髓神經元細胞凋亡及凋亡相關蛋白表達的影響
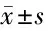
表6 miR-136-5p對LncRNA CYTOR處理的大鼠背脊髓神經元細胞抑制率、凋亡率、炎性因子的檢測 n=9,
3 討論
脊髓損傷是指多種原因引起的脊髓結構缺損及其功能喪失導致運動、感覺等異常,尋找新的脊髓損傷干預靶點成為研究重點,LncRNA可參與基因轉錄激活等調控過程,LncRNA可通過充當miRNA的競爭性內源RNA(ceRNA)而參與脊髓損傷過程[8-10]。
LncRNA CYTOR表達下調可促進病理性心臟肥大[11]。LncRNA CYTOR過表達可通過調節(jié)miR-24/XIAP分子軸而減輕膿毒癥誘導的心肌損傷[12]。但筆者發(fā)現(xiàn)LncRNA CYTOR在大鼠背脊髓神經元細胞損傷中的影響及機制尚不可知。本研究結果顯示,H2O2誘導的大鼠背脊髓神經元細胞中LncRNA CYTOR的表達量降低,提示LncRNA CYTOR可能參與脊髓損傷的發(fā)生過程。研究表明Bcl-2基因家族是在caspase家族蛋白上游,并可通過抑制caspase-3蛋白合成而抑制細胞凋亡,而Bax對細胞凋亡的作用與之相反[13]。本研究結果顯示,H2O2誘導的大鼠背脊髓神經元細胞增殖抑制率、凋亡率、Bax蛋白表達升高,Bcl-2蛋白表達降低,而LncRNA CYTOR過表達可促進H2O2誘導的大鼠背脊髓神經元細胞增殖及抑制細胞凋亡,提示LncRNA CYTOR過表達可促進細胞增殖及抑制細胞凋亡從而減輕H2O2誘導的大鼠背脊髓神經元細胞損傷。另有研究表明,IL-6、IL-21屬于促炎性細胞因子,其水平的升高提示細胞炎性反應程度加重[14]。本研究結果顯示,在H2O2誘導的大鼠背脊髓神經元細胞中,IL-6、IL-21水平升高,而LncRNA CYTOR過表達可降低IL-6、IL-21水平,提示LncRNA CYTOR過表達可抑制H2O2誘導的大鼠背脊髓神經元細胞炎性反應。
本研究證實LncRNA CYTOR與miR-136-5p存在靶向調控作用,LncRNA CYTOR可充當miR-136-5p的ceRNA。研究表明,miR-136-5p可通過引起炎性反應從而促進脊髓損傷[15]。miR-136-5p在人視網膜色素上皮細胞損傷中表達水平升高,并可促進炎性反應的發(fā)生[16]。本研究結果顯示,H2O2誘導的大鼠背脊髓神經元細胞中miR-136-5p的表達量升高,miR-136-5p過表達可減弱LncRNA CYTOR過表達對H2O2誘導的大鼠背脊髓神經元細胞增殖、凋亡及炎性反應的作用。提示LncRNA CYTOR可通過靶向結合miR-136-5p而參與脊髓損傷過程。
綜上所述,H2O2誘導的大鼠背脊髓神經元細胞中LncRNA CYTOR表達下調,miR-136-5p表達上調,LncRNA CYTOR過表達可通過抑制miR-136-5p表達而促進H2O2誘導的大鼠背脊髓神經元細胞增殖及抑制細胞凋亡、炎性反應,LncRNA CYTOR可能作為脊髓損傷的潛在治療靶點。但仍需體內實驗驗證LncRNA CYTOR/miR-136-5p分子軸在脊髓損傷中的作用機制。

