西藏巨柏種子萌發過程中生理指標的響應
常馨月, 萬路生, 楊小林, 蔣 騰, 楊雯靜, 劉 峰, 趙墾田
(1.西藏大學理學院, 拉薩 850000; 2.重慶三峽學院生物與食品工程學院, 重慶 萬州 404000;3.西藏農牧學院資源與環境學院, 西藏 林芝 860000;4.華能西藏雅魯藏布江水電開發投資有限公司, 西藏 林芝 860000;5.中國電建集團成都勘測設計研究院有限公司, 成都 610000;6.華能西藏水電安全工程技術研究中心, 西藏 林芝 860000)
巨柏(Cupressusgigantea)系柏科(Cupressaceae)柏木屬(Cupressus)高大喬木[1],為我國西藏特有物種,主要散生分布在雅魯藏布江及其支流沿岸的林芝市巴宜區、米林縣和朗縣等地,或在海拔3 000~3 400 m的陽坡形成疏林。因種群數量稀少和天然更新困難等原因,巨柏被確定為國家一級保護物種,并在2004年列入中國物種紅色名錄[2]。
目前,巨柏的研究主要集中在苗木培育、群落生態學和種子繁育等方面[3-9],且研究發現巨柏群落存在天然更新困難等問題。通過對巨柏種子萌發過程中的生理指標進行研究分析,明確巨柏種子萌發的生理變化規律,以期更深層次地了解巨柏種子繁育機制,促進巨柏種質資源保護,進而為巨柏的天然更新和種群擴大提供參考。
1 材料與方法
1.1 材 料
巨柏采種林分位于西藏自治區林芝市朗縣洞嘎鎮扎西塘村,地理坐標為28°59′49″N,93°18′0″E,海拔3 060 m。研究地為高山峽谷地帶,具有干熱河谷氣候特征,年降水量在400 mm左右,降水主要集中在4—9月,且以6、7月最高,是溫帶半濕潤至半干旱的過渡區。
于2020年8月在雅魯藏布江右岸的階地巨柏林進行采種,分別采集3棵巨柏母樹樹冠下部不同方位的球果混合備用,自然風干取種,5 ℃貯藏。種子千粒重為4.137 g,含水量為7.59%。
1.2 方 法
2020年11月,將供試種子用0.5%的高錳酸鉀溶液進行消毒后用20 ℃蒸餾水浸種2 d[8],采用沙培法[9]進行發芽試驗。在巨柏種子萌發過程中,自浸種開始每2 d進行一次取樣,觀察種子形態特征,并測定各時期的主要生理生化指標,包括含水量、可溶性蛋白含量、可溶性糖含量、過氧化氫酶(CAT)活性和過氧化物酶(POD)活性。
采用考馬斯亮藍G-250染色法和蒽酮-H2SO4比色法分別測定種子的可溶性蛋白含量和可溶性糖含量。采用紫外吸收(Tris-HCl)法和愈創木酚法分別測定CAT活性和POD活性[10]。
1.3 數據統計分析
用Excel 2003軟件和Origin 9.0軟件進行數據統計、數據處理和圖表制作,用R軟件和SPSS 25.0軟件進行數據分析。
2 結果與分析
2.1 巨柏種子萌發過程中形態特征的變化
通過觀察發現,巨柏種子萌發過程的第1~2天為巨柏種子吸脹時期;第4天巨柏種子種殼破裂露白;第6天胚根長度達到2 mm,約為巨柏種子長度的一半,開始記錄種子萌發;第8天胚根長度達到1 cm,巨柏種子萌發達到高峰時期,可測定其種子發芽勢;第12天胚根長度為2~2.5 cm,可觀察到子葉生長,并有極少數種子的種皮脫落、子葉開始展開;第16天胚根長度為2.5~3.0 cm,子葉完全展開,萌發基本結束。
根據巨柏種子的萌發特征將巨柏種子的萌發過程劃分為7個階段:第一階段為未處理時期;第二階段為吸水膨脹的時期;第三階段為種殼破裂,出現露白的時期;第四階段為胚根長度達到2 mm的時期;第五階段為胚根長度達到1 cm的時期;第六階段為出現子葉的時期;第七階段為子葉展開的時期。
2.2 巨柏種子萌發過程中含水量的變化
巨柏種子萌發過程中含水量呈增長趨勢,不同時期的含水量存在顯著差異。由表1、圖2可知,巨柏種子的含水量在浸種前最低,吸脹期間含水量顯著升高,日增長速率達到12.97%,種子含水量由7.59%變為33.53%;而后日增長速率降低,為2.045%,含水量緩慢增長,巨柏種子的含水量在種殼破裂和種子開始萌動時分別為36.82%和45.80%;胚根開始生長后,含水量再一次顯著升高,日增長速率約為4.12%,當子葉完全展開時,巨柏種子的含水量可達78.77%。
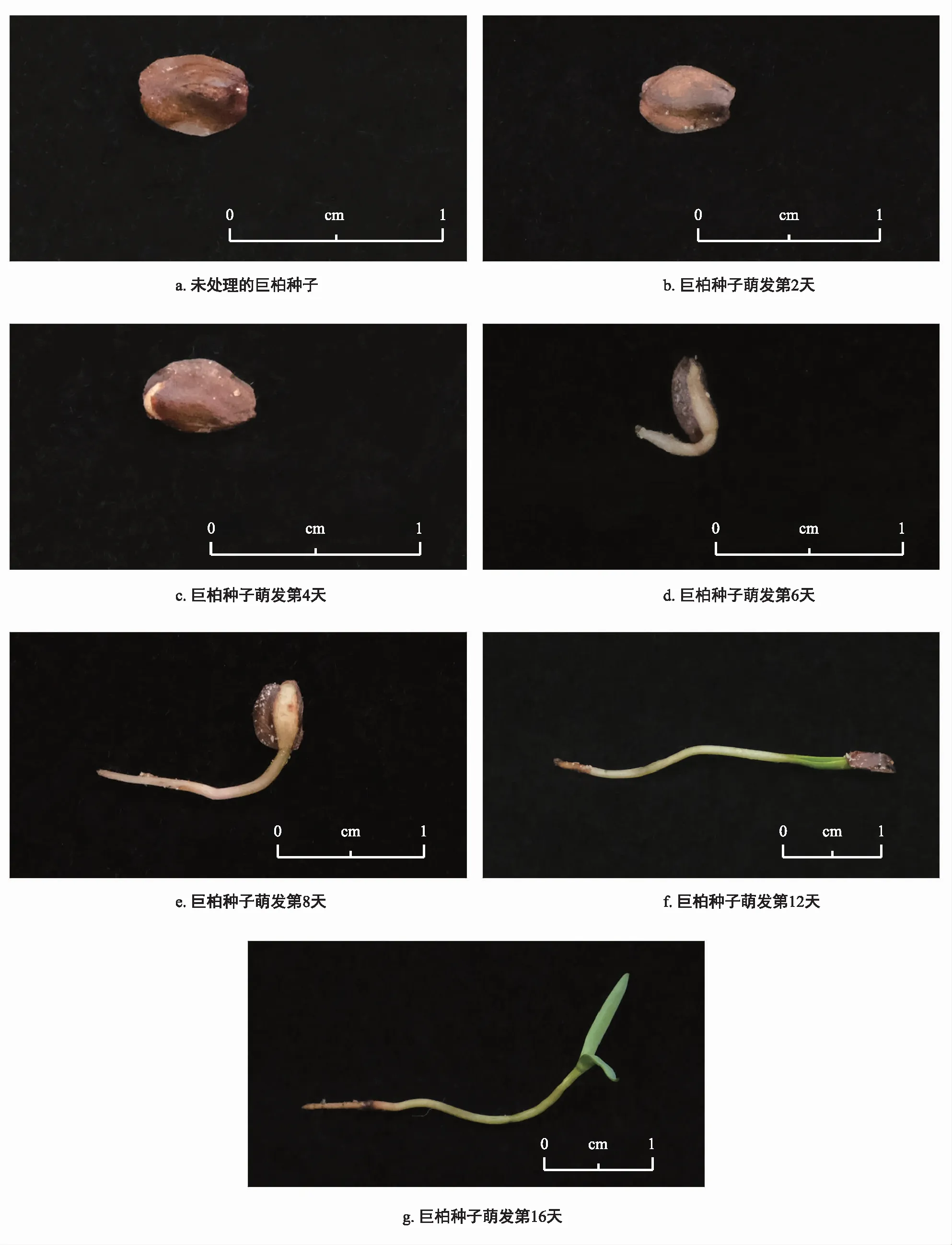
圖1 巨柏種子萌發過程的形態特征
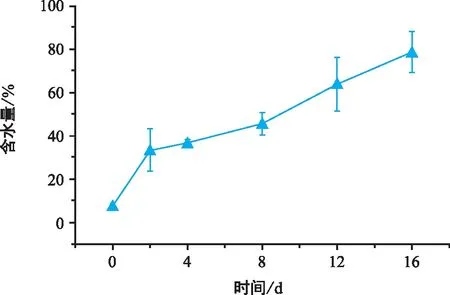
圖2 巨柏種子萌發過程中含水量的變化
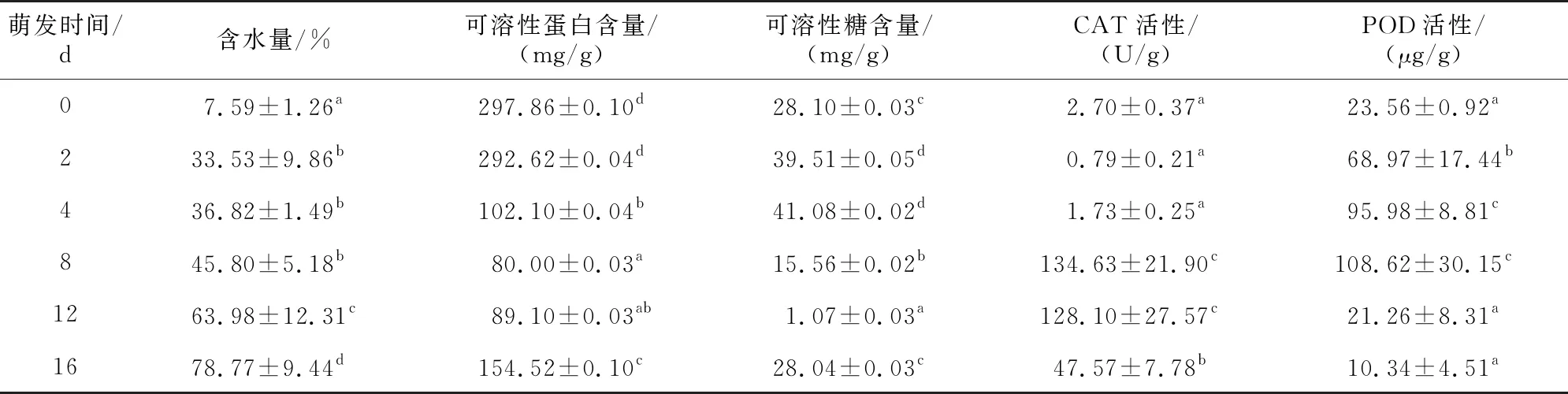
表1 巨柏種子萌發過程中生理指標的差異性分析
2.3 巨柏種子萌發過程中可溶性蛋白和可溶性糖含量的變化
巨柏種子萌發過程中可溶性蛋白的含量呈先降后升的變化趨勢,可溶性糖的含量呈先升后降再升的變化趨勢,見圖3。不同時期的可溶性蛋白和可溶性糖含量均存在顯著性差異,見表1。
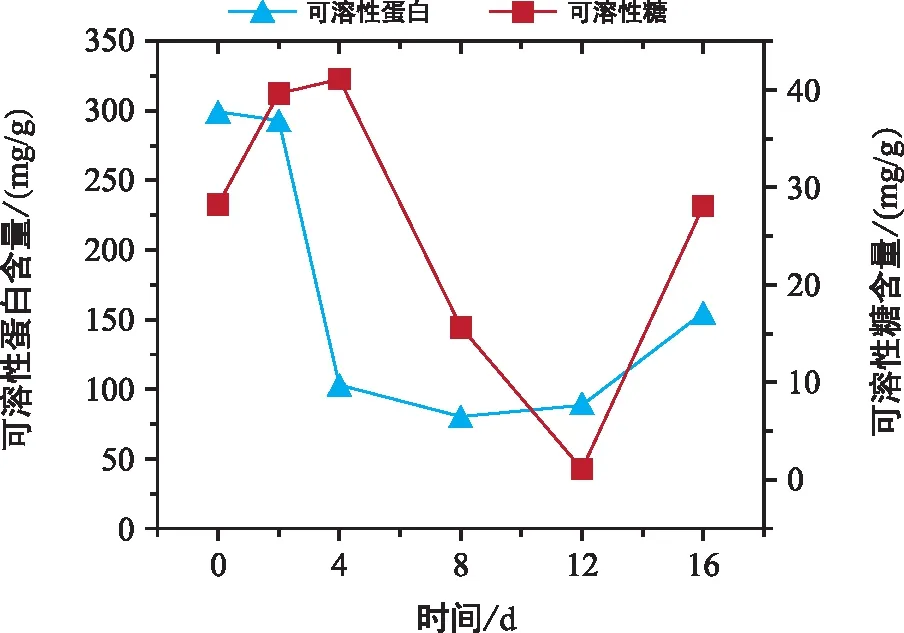
圖3 巨柏種子萌發過程中可溶性蛋白和可溶性糖含量的變化
巨柏種子中可溶性蛋白的含量在種子吸脹時期幾乎沒有變化;隨著種子種殼破裂、出現露白,巨柏種子中可溶性蛋白的含量發生顯著變化,由292.62 mg/g降低為102.10 mg/g;在胚根生長時期,巨柏種子中可溶性蛋白含量的降低速率減慢,但仍出現顯著性變化,并在第8天達到整個萌發時期的最低含量(80.00 mg/g);而后隨著子葉的出現和生長,可溶性蛋白含量顯著升高。
巨柏種子中可溶性糖含量在種子吸脹時期顯著升高;成熟的巨柏種子中可溶性糖含量較高,為28.10 mg/g。第4天種殼破裂、出現露白時,巨柏種子可溶性糖含量達到最高,為41.08 mg/g;而后胚根開始生長,可溶性糖含量逐漸降低,在第12天能觀察到子葉生長時達到最低值,為1.07 mg/g;之后隨著子葉的生長,可溶性糖含量迅速顯著升高。
2.4 巨柏種子萌發過程中CAT和POD活性的變化
巨柏種子萌發過程中CAT和POD活性均呈先升后降的變化趨勢,且均存在顯著性差異。
由表1、圖4可知,巨柏種子的CAT活性在種殼破裂、出現露白之前沒有明顯變化,CAT活性顯著較低,約為0.79~2.70 U/g;隨著種殼破裂,種子開始萌發,CAT活性顯著升高,第8天達到巨柏種子萌發過程的最高值(134.63 U/g);子葉出現后,CAT活性略有降低但不存在顯著性變化,而后隨著子葉的生長,CAT活性開始顯著下降。
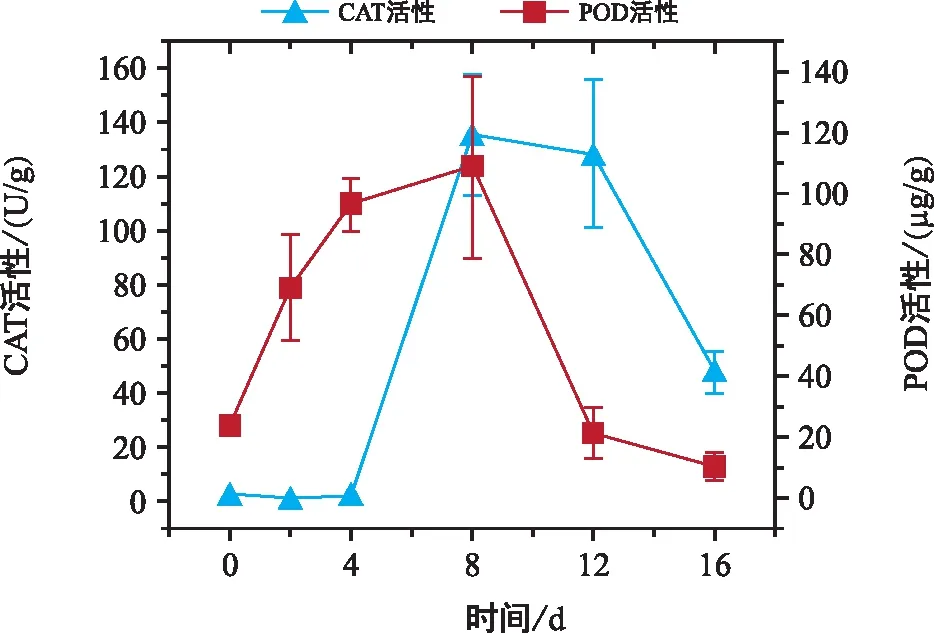
圖4 巨柏種子萌發過程中CAT和POD活性的變化
巨柏種子的POD活性在子葉出現之前隨著種子的萌發逐漸升高,吸脹期間升高速率最快,可達22.71 μg/(g·d),POD活性升高為68.97 μg/g;之后速率降低,在第8天種子萌發達到高峰時,巨柏種子的POD活性達到整個萌發過程的最高值(108.62 μg/g);而后隨著胚根和子葉的生長,POD活性顯著下降。
2.5 巨柏種子萌發過程中生理指標的相關性分析
由表2可知,在巨柏種子萌發過程中,萌發時間與含水量、可溶性蛋白含量、可溶性糖含量和CAT活性均存在顯著相關性,其中萌發時間與含水量和CAT活性存在極顯著正相關,相關系數為0.943和0.608;與可溶性蛋白含量存在極顯著負相關,相關系數為-0.713;與可溶性糖含量存在顯著負相關,相關系數為-0.470。含水量與可溶性蛋白含量和CAT活性存在顯著相關性,其中含水量與CAT活性存在顯著正相關,相關系數為0.543;與可溶性蛋白含量存在極顯著負相關,相關系數為-0.595。可溶性蛋白含量與可溶性糖含量和CAT活性存在顯著相關性,其中可溶性蛋白含量與可溶性糖含量存在顯著正相關,相關系數為0.477;與CAT活性存在極顯著負相關,相關系數為-0.694。可溶性糖含量與CAT活性存在極顯著負相關,相關系數為-0.854。
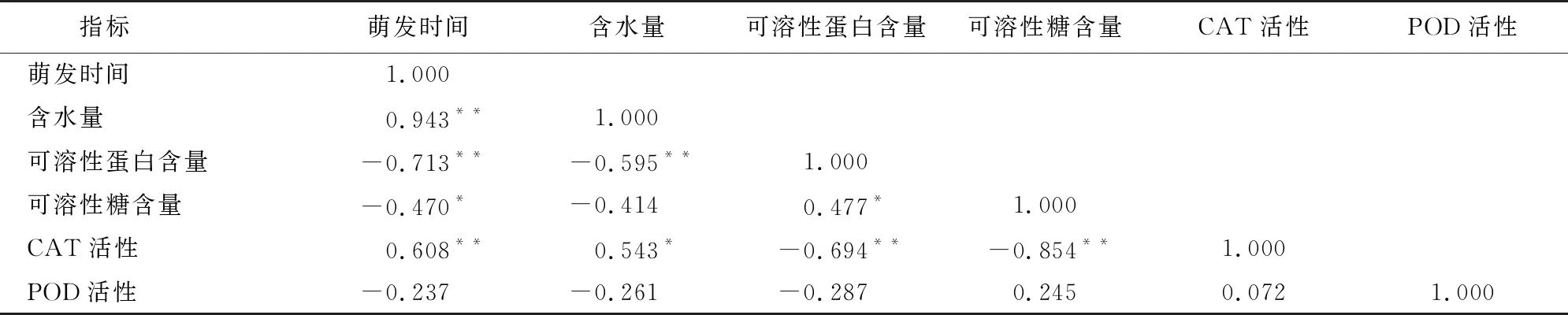
表2 巨柏種子萌發過程中生理指標的相關性分析
3 討 論
本研究中可溶性蛋白含量呈先降后升的變化趨勢,與露水草和川續斷種子萌發過程中蛋白質含量的變化規律相同[11-12]。蛋白質是種子中重要的營養物質。成熟的巨柏種子中可溶性蛋白的含量較高,當其開始萌發后,種子內貯藏的蛋白質在酶的作用下被不斷分解成氨基酸并輸送至胚根,為種子萌發提供營養,可溶性蛋白含量迅速下降[13]。而后隨著子葉的生長,巨柏種子的可溶性蛋白含量升高,這可能是萌發的巨柏種子進入新的代謝模式,合成大量新的蛋白質。
可溶性糖含量的變化代表植物體內碳水化合物的代謝過程,反映了種子內部復雜的生理生化反應規律。本研究中,可溶性糖含量呈先升高后降低再升高的變化趨勢,與青蒿和掌葉木種子萌發過程中可溶性糖含量的變化規律相同[14-15]。種子萌發過程中的代謝活動自種子吸脹開始,巨柏種子萌發初期,種子吸脹并于內部進行物質代謝,可溶性糖含量逐漸升高,為種子進一步萌發積蓄能量;胚根突破種皮的階段是種子萌發過程中物質代謝最活躍的時期,隨著種殼破裂、出現露白,可溶性糖含量急劇下降,這可能是種子萌發過程需要大量的營養物質和能量,使得種子內貯藏的可溶性糖被大量分解、消耗[16];之后隨著子葉的生長,萌發后的巨柏種子生理機能逐漸完善,葉片開始進行光合作用并合成大量可溶性糖,巨柏種子的可溶性糖含量升高。
CAT和POD是植物組織內廣泛存在的兩種酶,兩者可以協同反映種子萌發的活力大小和細胞的生長分化狀況[17],進而反映植物的抗衰老能力。多數研究認為,種子內POD的活性隨著種胚的生長逐漸升高,且提高種子內POD活性,可有效促進種子萌發[18]。成熟的巨柏種子中CAT和POD活性較低,種子抗衰老能力較強,極耐儲存。巨柏種子萌發過程中CAT和POD活性呈先升后降的變化趨勢,與浦梅[19]對滇重樓種子的研究結果一致。在巨柏種子萌發初期,種子萌發活力較大,細胞快速分化,CAT活性和POD活性升高,這與巨柏種子萌發過程中表現出的特征一致;而后隨著胚根和子葉的生長,種子萌發活力減弱,細胞分化速率減慢,CAT活性和POD活性降低。巨柏種子萌發過程中POD活性的變化規律可能與以種子為主的代謝方式轉變為以葉片為主的代謝方式有關。
4 結 論
巨柏種子萌發過程劃分為7個階段。巨柏種子萌發過程中含水量呈增長趨勢,可溶性蛋白含量呈先降后升的變化趨勢,可溶性糖的含量呈先升后降再升的變化趨勢,CAT活性和POD活性均呈先升后降的變化趨勢。
萌發時間與含水量和CAT活性存在極顯著正相關,與可溶性蛋白含量存在極顯著負相關,與可溶性糖含量存在顯著負相關;含水量與CAT活性存在顯著正相關,與可溶性蛋白含量存在極顯著負相關;可溶性蛋白含量與可溶性糖含量存在顯著正相關,與CAT活性存在極顯著負相關;可溶性糖含量與CAT活性存在極顯著負相關。

