LncRNA在急性痛風性關節炎發病中的表達研究*
張麗萍,何志艷,蘇東文,鮑艷媛,謝招虎,向 前,李兆福,4△
(1.云南省滇南中心醫院紅河哈尼族彝族自治州第一人民醫院,云南 個舊 661000;2.云南中醫藥大學,云南 昆明 650500;3.彌勒市人民醫院,云南 彌勒 652300;4.云南中醫藥大學第一附屬醫院,云南 昆明 650021)
痛風性關節炎(gouty arthritis,GA)是因尿酸排泄功能異常和(或)嘌呤代謝異常引起血尿酸升高,單鈉尿酸鹽晶體在關節、滑膜或其它組織、器官等部位沉積,沉積部位出現紅、腫、熱、痛的急性炎癥反應,屬于晶體性關節炎范疇[1]。隨著經濟的發展,人民生活水平的提高,近年來痛風的發病率逐年上升。流行病學顯示,痛風患者男女性別之比為15 ∶1,發病的平均年齡為48.28歲[2],不同種族痛風的發病率約為0.03%~15.3%[3],在中國,痛風患病率約為1%~3%,并且發病呈逐漸上升和年輕化趨勢[4]。GA 具有致殘性,且高尿酸血癥和心腦血管、痛風性腎病等疾病的發病關系密切,已成為世界范圍內醫療領域關注的焦點之一。
既往研究提示GA 的發病和炎癥反應、高尿酸血癥息息相關,但GA 的發病機制尚未完全被人們所知曉。研究發現長鏈非編碼RNA(long noncoding RNA,LncRNA)與多種炎癥信號通路有關,并且參與了多種代謝性疾病和風濕免疫病的發生發展[5-6]。有學者研究發現GA 的急性發作可能和LncRNA 的表達譜有關[7],LncRNA 的異常表達可能是GA 急性發作的關鍵因素之一,其可能參與了GA 發作的炎癥反應過程。因此,從LncRNA 的表型差異角度探討痛風的發病及防治可能是以后中西醫研究的關鍵點。基于此,本研究擬探討LncRNA 的表型在AGA 發病中的作用,為臨床提供依據。
1 材料與方法
1.1 試驗標本 符合納入標準的AGA(濕熱蘊結型)患者及非痛風性關節炎健康人(healthy control,HC)的血液標本。
1.2 試驗儀器和試劑 50 mL、15 mL、1.5 mL 普通離心管;50 mL 高效離心管;高原真空采血管(10 mL枸櫞酸鈉);各量程移液器;吸頭(1 000 μL、200 μL等);PCR 管(0.2 mL、1.5 mL);Sep Mate TM tube(15 mL、50 mL);-81℃冰箱;普通冰箱(4℃、-20℃);制冰機;漩渦振蕩儀;超凈工作臺;高速冷凍離心機;淋巴細胞分離液;FBS;DPBS;Trizol 總RNA 提取試劑盒;PCR 相關引物;乙醇;氯仿。
2 試驗方法
2.1 病例來源 選擇來自門診的符合病例納入標準的AGA 患者5 例和來自門診體檢的HC 5 例。
2.2 方法 AGA 患者5 例,予清熱通絡方配方顆粒(江陰天江藥業有限公司)治療5 d,藥物由淡竹葉10 g,石膏30 g,南沙參20 g,黃柏15 g,薏苡仁30 g,法半夏15 g 等10 余味藥物組成(每劑320 g);HC 組5例不予任何處理;AGA 服藥后轉為NAGA(Non-acute gouty arthritis)組。采集AGA 組、HC 組、NAGA 組的外周空腹靜脈血7 mL(EDTA-K2 抗凝)。
2.3 標本采集和處理
2.3.1 PBMC 的分離 將7 mL 的新鮮血液用移液器轉入50 mL 離心管中,加入同等量的DPBS 后輕輕搖晃使2 者混勻;將50 mL 高效離心管置于離心管架上,用移液器將淋巴細胞分離液緩慢加入高效離心管中間的小孔中,連續緩慢加入淋巴細胞分離液,直至液面沒過離心管的隔板;將和DPBS 混勻后的血漿沿著高效離心管的管壁緩慢加入高效離心管中后靜置5 min;稱取上一步高效離心管的重量,配平后放入高效離心機進行離心(3 500 r/min,離心20 min);離心結束后將離心管緩慢取出置于離心架上,可見高效離心管分為4 個層面(最底層為沉積的紅細胞,倒數第2 層為分離液,倒數第3 層為PBMCs,倒數第4層為血清),此時用移液槍吸去最頂層的淡黃色液體,將倒數第3 層的PBMCs 移入15 mL 離心管中;15 mL 離心管的重量,配平后離心機離心(3 500 r/min,離心5 min);離心結束后倒去上清液,留下離心管最底層的白色沉積物;用1 mL 的DBPS 將離心管底層的白色沉積物吹散,配平后,重復上述過程再離心一次;倒去離心后的上清液,留下白色沉積物,用1 mL DPBS 吹散后,轉入1.5 mL 的離心管中;配平后放入小型離心機繼續離心(3 500 r/min,離心5 min);離心結束棄其上清液,用槍頭吸干白色沉積物周圍的液體,之后用振蕩器振開沉積物,并加入1 mL RNA 裂解液,吹打均勻至細胞完全裂解,室溫靜置5 min,標記好信息后放入-81℃冰箱凍存。
2.3.2 總RNA 的提取 取出保存在-81℃中的PBMCs,室溫靜置5 min;加200 μL 氯仿至解凍的PBMCs中,并震蕩15 s 以便核酸、核蛋白能完全分離,室溫靜置10 min;配平后離心(12 000 r/min,離心15 min),離心后可見液體分為3 層,吸取最上層(含有RNA)至新的1.5 mL 的EP 管;往裝有RNA 的1.5 mL EP 中加入等量的異丙醇,混勻后室溫靜置10 min;配平后離心機離心(12 000 r/min,離心10 min);離心結束后吸去上清液,加75%的乙醇1 mL 至1.5 mL 的EP 管中,震蕩混合均勻后,低溫離心(12 000 r/min,離心5 min);離心后吸去上清液后將離心管倒置風干;加入30 μL 左右的無酶水,混勻后室溫靜置10 min 使RNA 充分溶解后保存到-81℃冰箱中。
2.3.3 基因檢測 由上海康成生物工程有限公司完成。(1)檢測RNA 質量:降解RNA 并用Agilent ND-1000 檢測降解是否完全及測定濃度。(2)RNA 的標記、雜交:用Arraystar RNA Flash Labeling Kit 對RNA 樣本進行標記,用Agilent SureHyb 對樣本進行雜交實驗。(3)采集數據和對數據進行標準化處理:洗滌芯片后,用Agilent DNA Microarry Scanner 掃描芯片,讀取數值后獲得原始數據。用軟件Agilent Feature Extraction(v11.0.0.1)采集芯片的探針信號。用Agilent GeneSpring GX v12.1 軟件對芯片的數據進行標準化處理。(4)挑選差異表達LncRNAs:用v12.1 軟件選取差異表達的LncRNA(2 組樣本間差異表達的篩選條件為:P<0.05 和Fold Change>2)。
2.4 統計分析 采用SPSS 23.0 統計軟件,符合正態分布或近似正態分布,兩組之間進行比較采用獨立樣本t 檢驗,計量資料用(±s)表示;不符合正態分布用秩和檢驗,以中位數(P25,P75)即[M(P25,P75)]表示,P<0.05 具有統計學意義。
3 結果
3.1 病例一般情況分析 本部分研究共納入5 例AGA 患者及5 例HC,所有入組對象均為男性,納入對象的年齡無統計學差異(P>0.05),詳見表1。
表1 入組對象基本情況比較(±s)
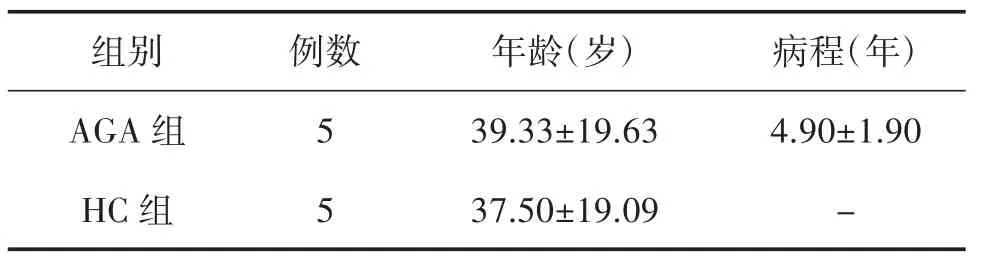
表1 入組對象基本情況比較(±s)
注:AGA 組和HC 組比較,P>0.05。
?
3.2 AGA 組和HC 組的LncRNA 表型差異情況 分別提取AGA 組和HC 組PBMC 中總RNA 并進行基因芯片測序,按照設定的篩選條件(P<0.05 和Fold Change>2),和HC 組比較,AGA 組具有表型差異的LncRNA 共有2 364 條,其中1 174 條表達上調,1 190 條表達下調。AGA 組表達上調的前10 位見表2,表達下調的前10 位見表3,具有表型差異的火山圖見圖1、聚類分析圖見圖2。
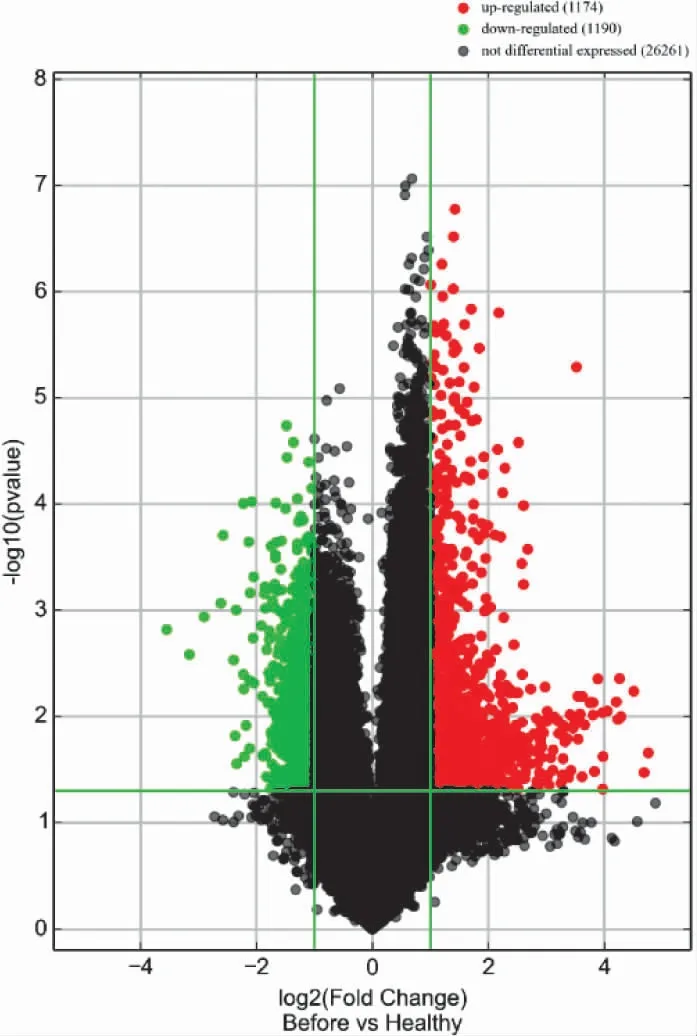
圖1 和HC 組比較,AGA 組有表型差異的火山圖
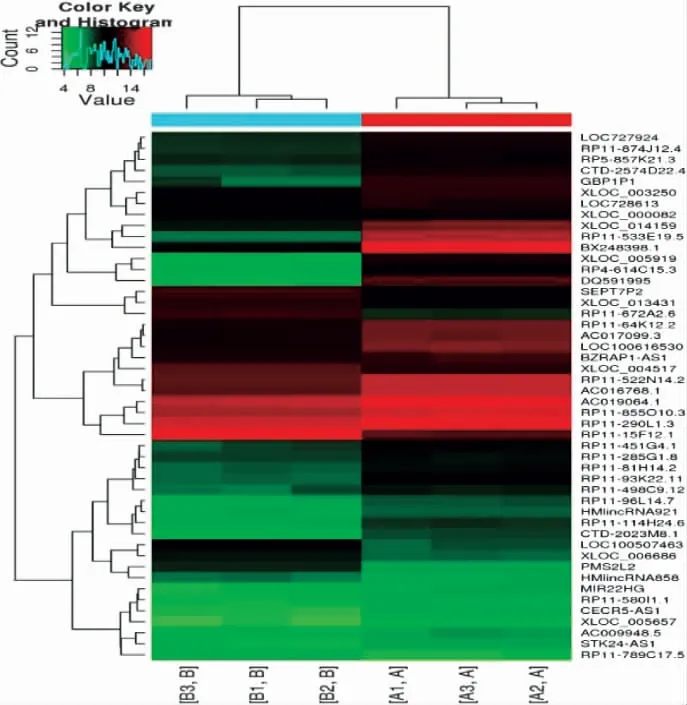
圖2 和HC 組比較,AGA 組有表型差異的聚類分析圖
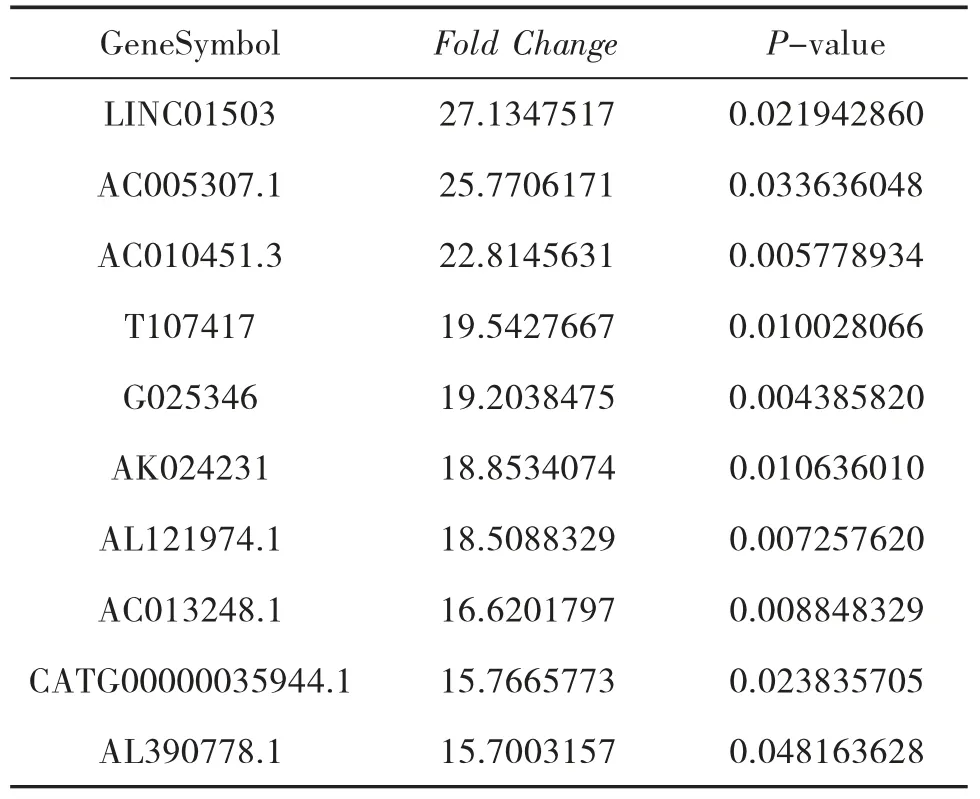
表2 和HC 組比較,AGA 組表達上調的LncRNA
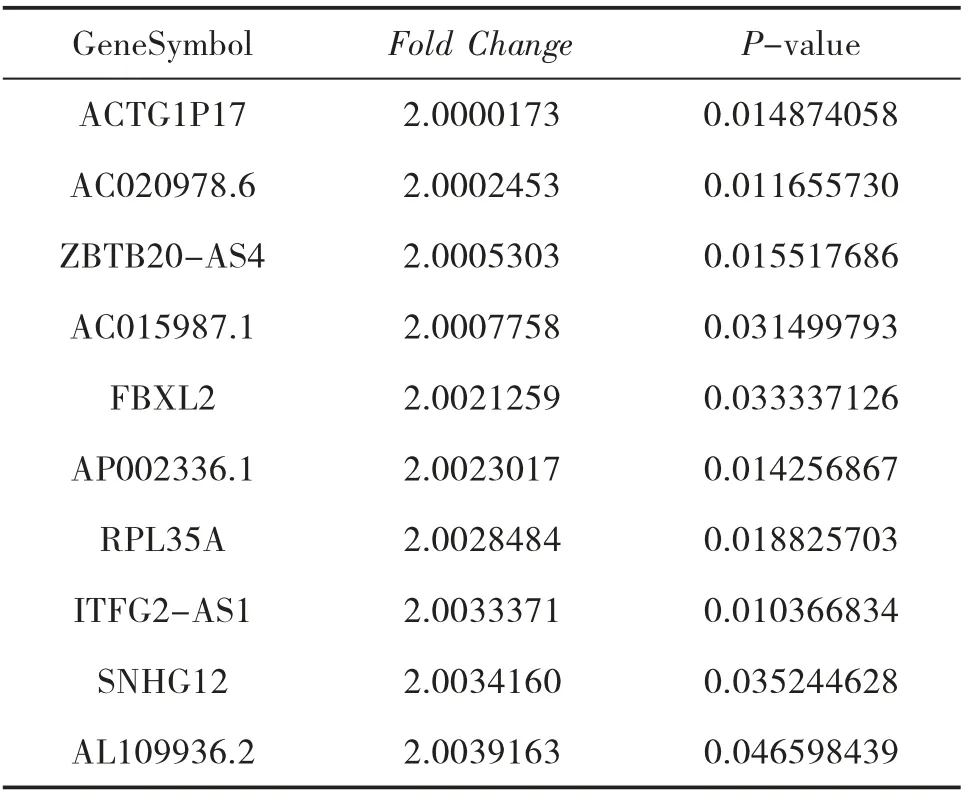
表3 和HC 組比較,AGA 組表達下調的LncRNA
3.3 NAGA 組和HC 組的LncRNA 表型差異情況 提取NAGA 組PBMC 中總RNA 并進行基因芯片測序,按照設定的篩選條件(P<0.05 和Fold Change>2),與HC 組比較,NAGA 組具有表型差異的LncRNA 共有802 條,其中147 條表達上調,655 條表達下調。NAGA 組表達上調的前10 位見表4,表達下調的前10位見表5,具有表型差異的火山圖見圖3、聚類分析圖見圖4。
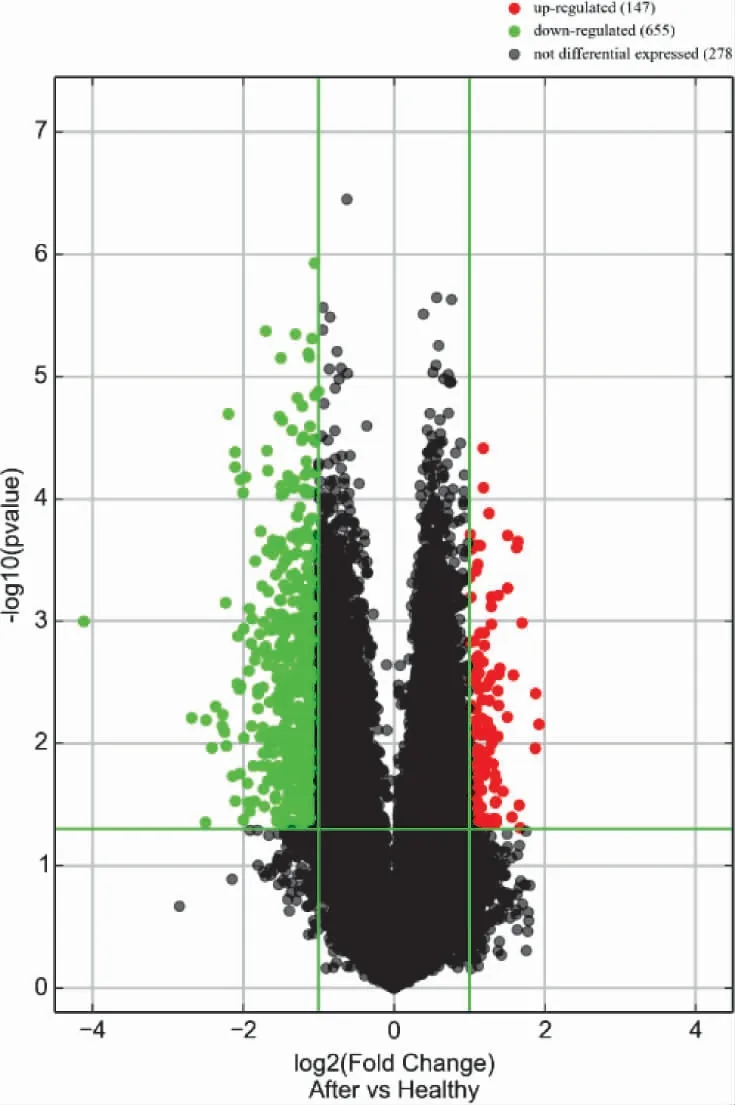
圖3 和HC 組比較,NAGA 組有表型差異的火山圖

圖4 和HC 組比較,NAGA 組有表型差異的聚類分析圖

表4 和HC 組比較,NAGA 組表達上調的LncRNA
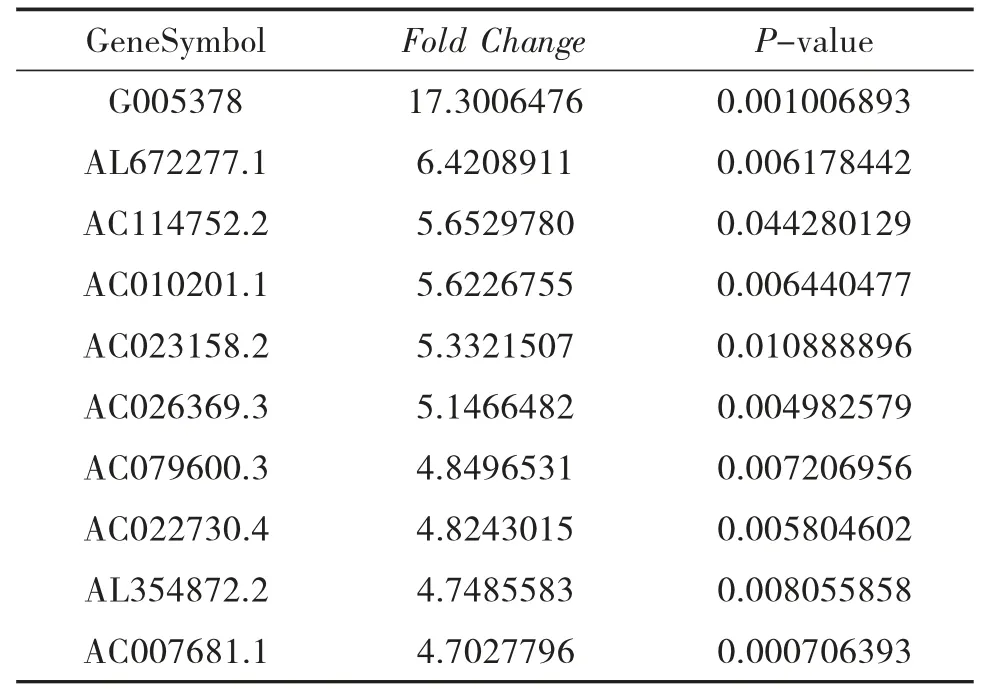
表5 和HC 組比較,NAGA 組表達下調的LncRNA
3.4 NAGA 組和AGA 組的LncRNA 表型差異情況 通過和AGA 組比較,按照設定的篩選條件(P<0.05 和Fold Change>2),NAGA 組具有表型差異的LncRNA 共有171 條,其中30 條表達上調,141 條表達下調。表達上調的前10 位見表6,表達下調的前10位見表7,具有表型差異的火山圖見圖5、聚類分析圖見圖6。
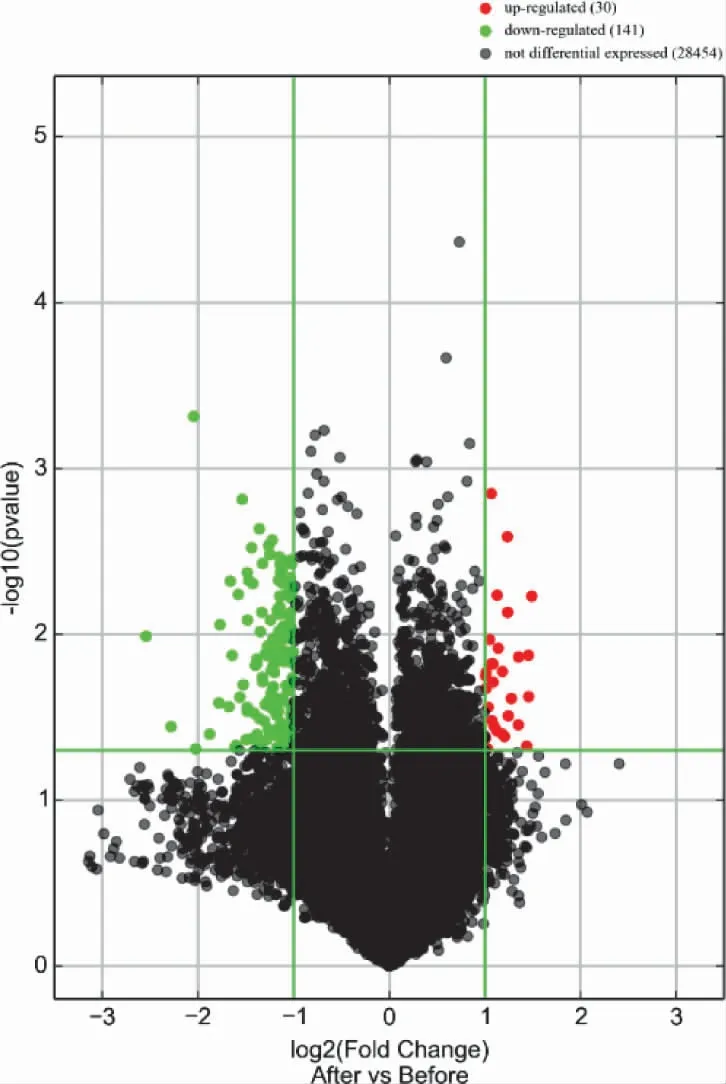
圖5 和AGA 組比較,NAGA 組有表型差異的火山圖
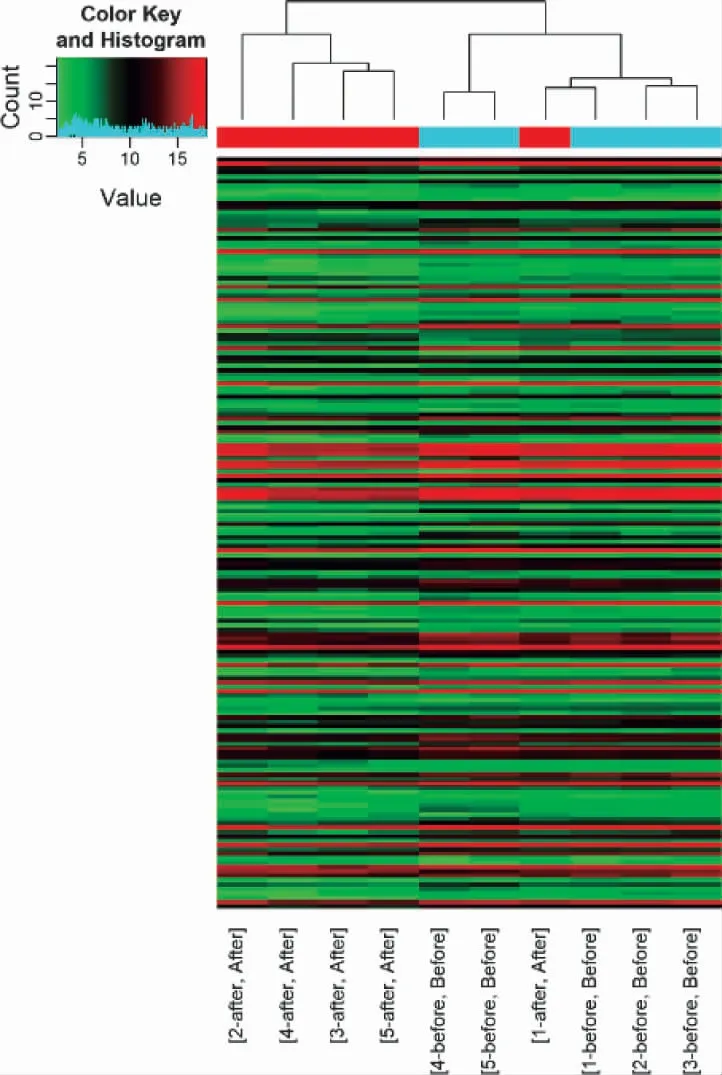
圖6 和AGA 組比較,NAGA 組有表型差異的聚類分析圖
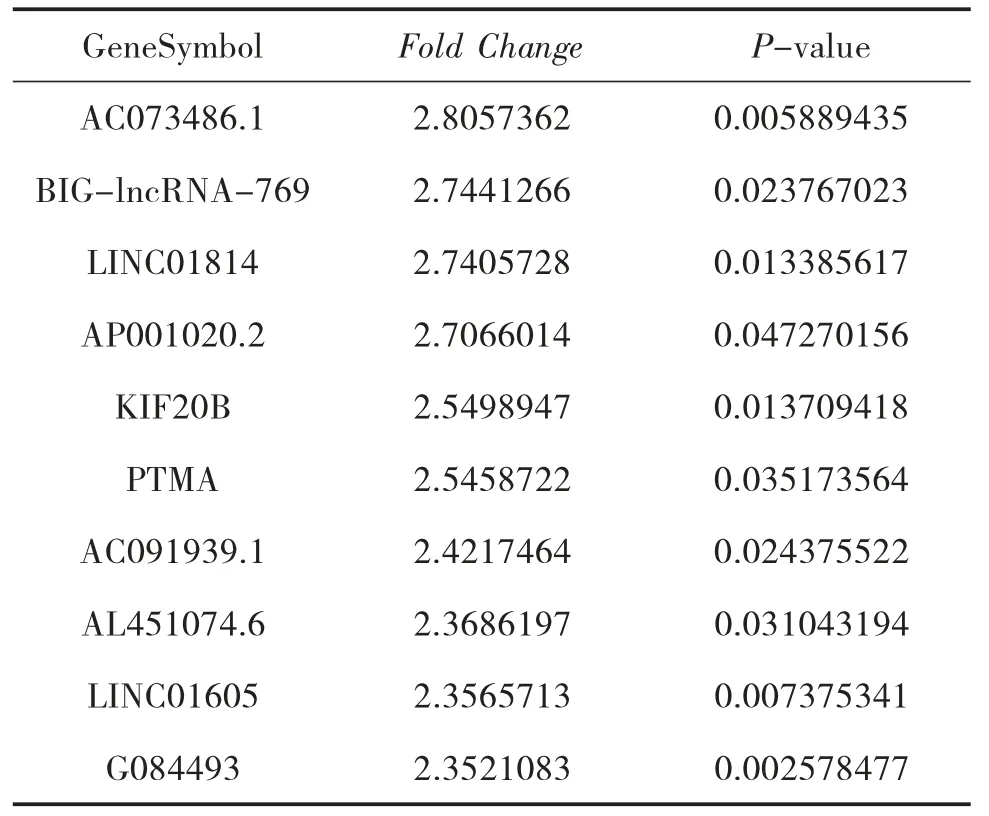
表6 和AGA 組比較,NAGA 組表達上調的LncRNA
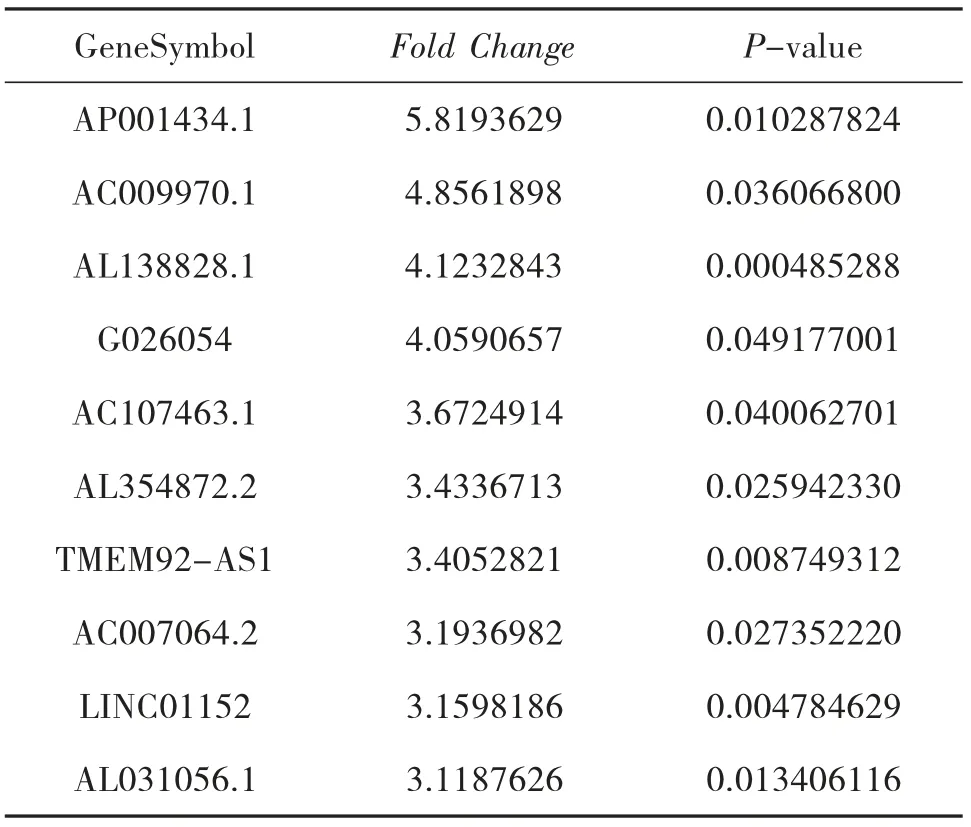
表7 和AGA 組比較,NAGA 組表達下調的LncRNA
3.5 AGA 組和NAGA 組具有關聯的LncRNA 用維恩圖(VENNY2.1)構建AGA 組、NAGA 組、HC 組三組之間的聯系,通過對比我們發現AGA 組、NAGA 組共有79 條LncRNA 存在關聯。在AGA 組表達下調,而在NAGA 組表達上調的LncRNA 共有11 條;在AGA組表達上調,而在NAGA 組表達下調的LncRNA 共有68 條;排名前10 位的LncRNA 情況見表8、表9;三組之間的思維導圖見圖7。

圖7 AGA 和NAGA 具有關聯的LncRNA 思維導圖

表8 AGA 組和NAGA 組具有關聯的LncRNA 情況1
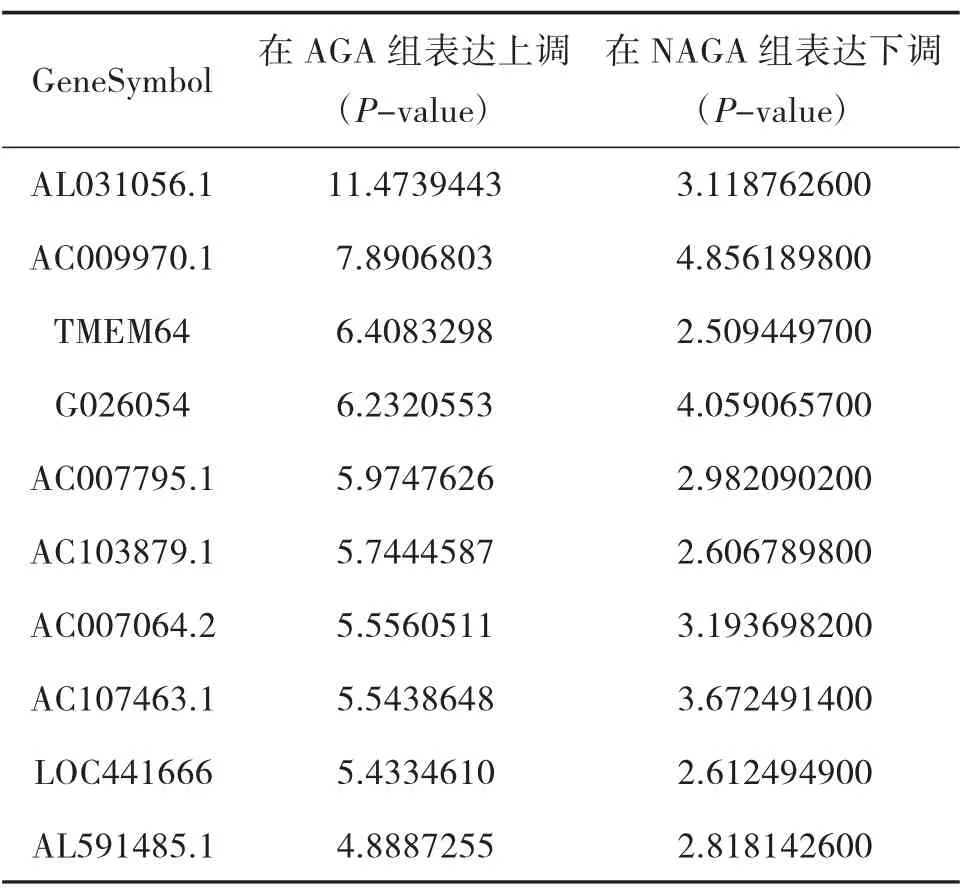
表9 AGA 組和NAGA 組具有關聯的LncRNA 情況2
4 討論
本研究結果顯示:(1)AGA 患者和HC 的LncRNA 表達譜具有明顯差異,AGA 患者有表達差異的LncRNA 共有2 364 條,1 174 條表達上調,1 190 條表達下調,其中LINC01503 較HC 表達上調了27 倍,T024665 較HC 表達下調了11 倍。(2)NAGA 患者和HC 的LncRNA 表達譜有明顯差異,NAGA 患者有表達差異的LncRNA 共有802 條,147 條表達上調,655條表達下調,其中AL031056.1 較HC 表達上調了3.7倍,G005378 較HC 表達下調了17 倍。(3)AGA 患者和NAGA 患者的LncRNA 表達譜具有明顯差異,具有表達差異的LncRNA 共171 條,AGA 患者表達上調的有30 條,NAGA 患者表達下降的有141 條,AGA患者表達上調倍數最高的LncRNA 為AC073486.1,其上調了2.8 倍,AP001434.1 是NAGA 患者下調倍數最高的,下調了5.8 倍。(4)通過構建AGA 組、NAGA 組、HC 組3 組之間的聯系,我們發現存在關聯的LncRNA 共有79 條。11 條LncRNA 在AGA 組表達下調,而在NAGA 組表達上調,其中AC100814.1在AGA 組下調3 倍,在NAGA 組表達上調了2.7 倍;68 條LncRNA 在AGA 組表達上調,在NAGA 組表達下調,其中AL031056.1 在AGA 組上調11 倍,在NAGA 組表達下調了3 倍。研究提示LncRNA 的表型差異可能和痛風的急性發作有關。
傳統中醫并沒有GA 的病名,根據本病的發病特點和臨床表現,大多歸屬于中醫“腳氣”“白虎病”“痹證”“歷節”等范疇[8]。諸多中醫學者雖對GA 有不同的認識,但不難發現,GA 的急性發作主要和脾虛、濕熱、痰瘀等因素密切相關[9-14]。
LncRNA 是長度不低于200 個核苷酸,沒有蛋白編碼功能的非編碼RNA 分子序列,是基因轉錄組的重要組成部分[15]。LncRNA 種類繁多、數量龐大,可以通過多種形式參與調控基因的表達模式,在表觀遺傳、轉錄、轉錄后及蛋白編碼水平發揮著重要作用[16]。有研究提示LncRNA 與多種炎癥信號通絡有關,隨著基因組學的發展,越來越多研究發現LncRNA 參與了炎癥反應、免疫類疾病、腫瘤疾病的發生、發展[17]。
GA 是具有遺傳傾向的和多種外界因素有關的復雜性疾病[18],在LncRNA 和GA 的研究中發現,LncRNA 的表達譜和GA 的發病有關[19],但目前國內關于LncRNA 表達譜和GA 發病機制的報道不多,目前人們對它在GA 發病過程中的所扮演的角色及作用機制尚未明確,期待后續有更多的學者加入該研究,以期從新的途徑了解GA,找到有效診治及預防該病的方法。

