嘌呤信號在肝臟免疫調節中的作用
馬發祥, 涂正坤
吉林大學第一醫院腫瘤免疫實驗室, 長春 130021
嘌呤在體內主要以嘌呤核苷酸的形式存在,除了具有關鍵的細胞內功能外, NAD+和ATP及其水解產物包括ADP、AMP和腺苷,是參與生理過程和病理狀況的重要細胞外信號。這些嘌呤分子激活1型(P1)和2型(P2)兩個嘌呤受體家族,從而激活不同的細胞內信號通路[1]。
肝臟由不同類型的細胞組成,包括肝細胞、肝星狀細胞(HSC)、肝竇內皮細胞(LESC)、Kupffer細胞(KC)、肝竇內淋巴細胞等[1]。肝臟是體內代謝的主要器官,還具有重要的免疫功能,負責從體循環中清除病原體和外源性抗原。肝臟的關鍵部位及其獨特的脈管系統使其能夠從外周血中募集免疫細胞發揮固有免疫和適應性免疫的功能[2]。本文總結了肝臟環境中的嘌呤信號并討論了其在慢性肝臟疾病中的作用。
1 嘌呤信號
嘌呤信號包括細胞內嘌呤釋放到細胞外,以自分泌和旁分泌作用方式激活P1和P2嘌呤受體家族,以及通過胞外酶(CD38、CD39、CD73等)調節細胞外ATP/腺苷水平,以終止ATP核苷酸信號[1]。組織損傷引起釋放的ATP對中性粒細胞、巨噬細胞、樹突細胞和記憶T淋巴細胞具有趨化性并激活它們,NAD+也可以通過殺死某些T淋巴細胞來影響炎癥。細胞外ATP和各種其他核苷酸激活P2X或P2Y受體以刺激炎癥。隨著時間的推移, ATP引起的炎癥減弱甚至轉為抗炎,這是由于調節細胞的募集和胞外酶(如CD39和CD73)的誘導,這些酶可將細胞外ATP快速轉化為腺苷[3],腺苷通過免疫細胞上抗炎A2A和A2B腺苷受體發揮作用。
1.1 ATP和P2受體 ATP 被廣泛認為是連接合成代謝和分解代謝的能量交換因子,并且還參與主動運輸、運動收縮、磷酸化等。此外,細胞外ATP還被認為是一種重要的胞外信號,可通過細胞表面的P2受體發揮炎性作用。P2受體包括離子型P2X(P2X1~7)受體和代謝型P2Y(P2Y1、2、4、6、11~14)受體兩個亞家族。P2X7受體已被廣泛報道被ATP激活活化NLRP3炎性小體,活化的炎性小體通過capase1剪切IL-1β前體產生成熟的IL-1β并釋放引起炎癥[4]。已有研究[5-6]表明,ATP可以和P2Y2受體結合調節粒細胞和巨噬細胞的趨化性。
1.2 腺苷和P1受體 腺苷可通過經典途徑和非經典途徑分別由ATP和NAD+代謝產生,細胞外腺苷可通過P1受體發揮抗炎性作用。P1受體目前已被發現四種,即A1、A2A、A2B和A3腺苷受體。四種受體均為G蛋白偶聯受體,A1和A3受體優先與Gi/o蛋白偶聯,抑制腺苷酸環化酶和cAMP的產生,而A2A和A2B受體通常是觸發細胞內cAMP積累的Gs偶聯受體,引起抗炎反應的信號通路因細胞類型而異[7]。
1.3 腺苷產生經典途徑的胞外酶 腺苷產生的經典途徑由ATP代謝產生,首先由CD39水解ATP為AMP。CD39是一種跨膜蛋白,有兩個跨膜結構域錨定在細胞膜上,并包含五個高度保守的序列結構域,被稱為“腺苷三磷酸雙磷酸酶保守區”,這些序列結構域參與活性位點形成和磷酸水解的細胞外核苷酸催化[8]。接著,CD73進一步水解AMP為腺苷。CD73是一種GPI錨定酶,包含一個N端結構域和一個C端結構域,它們由一個短α螺旋連接起來,N端結構域可以結合金屬陽離子,而C端結構域結合AMP發揮催化作用,CD73也可以以可溶形式存在,具有與膜結合形式相似的活性[9]。
CD39和CD73的表達受到微環境中缺氧、氧化應激和炎性細胞因子的影響[10]。在轉錄水平上,CD39和CD73的表達被多個轉錄因子調控,如Sp1、HIF-1α、Stat3和Gfi-1[10-12]。CD39的啟動子上存在轉錄因子Sp1的結合位點,Sp1在缺氧誘導的CD39表達中起關鍵作用[13]。缺氧還可通過HIF-1α結合CD73啟動子增強CD73的表達[11]。在輔助性T淋巴細胞17(Th17)中,IL-6介導的Stat3轉錄因子激活和TGF-β驅動的Gfi-1轉錄抑制因子下調則可增加CD39和CD73的表達[12]。
1.4 腺苷產生非經典途徑的胞外酶 腺苷也可由CD38、CD203a、CD73代謝NAD+產生。該途徑繞過了CD39介導的經典途徑,由CD38將NAD+轉化為ADPR,ADPR隨后被CD203a水解為AMP,AMP再被CD73水解為腺苷。在結構上,CD38 是一種具有單個跨膜片段的單鏈糖蛋白,由300個氨基酸組成[14]。CD203a是一種Ⅱ類跨膜糖蛋白,位于質膜和內質網中,以230~260 kD的同型二聚體形式存在,蛋白質的還原形式具有115~135 kD的分子大小,具體取決于細胞類型[15]。當微環境中不存在CD39的表達時,非經典途徑可能作為一種主要的腺苷產生來源。
2 嘌呤信號在肝臟微環境中的作用
肝臟是人體最大的實質器官,在蛋白質、碳水化合物和脂類的代謝發揮關鍵功能,并通過膽汁清除有毒廢物。同時,肝臟也被認為是以天然免疫為主的一個免疫特惠器官[16]。肝組織由實質性細胞(肝細胞)和非實質性細胞(NPC)組成。NPC主要包括LESC、KC、HSC和肝內免疫細胞。肝內免疫細胞包括樹突細胞、自然殺傷(NK)細胞、NKT淋巴細胞、T淋巴細胞等。在正常生理情況下,從胃腸道經門靜脈流向肝臟的血液中富含營養物質、細菌產物、毒素以及大量食物性抗原,而不引起肝臟炎癥和損傷。在病理情況下,大多數病原體在肝臟成功清除,甚至一些已建立感染的病原體最終也會被肝臟免疫反應所清除。這一過程中,肝臟組織獨特的微環境和肝竇內免疫細胞包括肝細胞、NPC、 KC、NK細胞和T淋巴細胞調節肝臟區域免疫反應,從而決定肝臟免疫和耐受[16]。肝臟微環境中復雜的免疫調節機制目前尚不完全清楚。
嘌呤信號包括ATP信號和腺苷信號,受到胞外酶和嘌呤受體在肝臟駐留細胞及肝臟募集的免疫細胞表面表達調控。生理狀態下,ATP的濃度和腺苷濃度被胞外酶控制在穩定的平衡狀態以維持肝臟的正常代謝功能。肝臟疾病會導致嘌呤信號的失衡,影響肝臟內各種細胞的功能(圖1)。
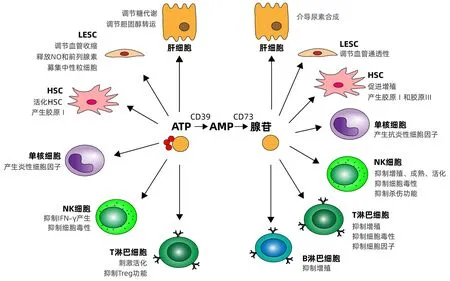
注:Treg,調節性T淋巴細胞。圖1 嘌呤信號對肝臟中細胞的調節Figure 1 Regulation of cells in the liver by purine signaling
2.1 肝細胞 肝細胞是肝臟中主要的實質細胞,約占肝臟質量的80%。肝細胞執行肝臟的主要代謝活動。肝細胞上CD73表達與Mallory-Denk 小體的形成相關進而導致對肝病的易感性[17]。肝細胞表面P2X4受體激活調節細胞體積[18],P2X7受體激活介導肝細胞Ca2+依賴性的殺傷作用[19]。P2Y受體和P1受體的激活多與肝細胞的代謝功能相關, P2Y1和P2Y2受體激活調節糖原代謝[20-21],P2Y13受體激活調節膽固醇轉運[22],P1受體激活主要與尿素合成相關[23]。
2.2 LESC LSEC形成可滲透屏障,充當血細胞、HSC和肝細胞之間的界面,具有非常高的內吞能力。LESC上有CD39和CD73的表達,部分肝切除術后,CD39 的表達在LESC上增加并且與肝再生相關[24]。此外,由LESC上CD39和CD73產生的腺苷可通過減少中性粒細胞積累限制炎癥[25]。P2Y受體與血管收縮相關,介導LESC釋放NO和分泌前列腺素,P2X7激活會募集中性粒細胞引發炎性反應[26]。缺氧狀態下,A2B受體上調,它的激活可調節血管的通透性變化。
2.3 HSC HSC具有兩種表型:靜止的維生素 A 儲存細胞和活化的肌成纖維細胞樣細胞,在肝損傷的情況下負責膠原沉積。HSC在靜止和激活條件下均表達 CD39 mRNA[27]。在肌成纖維細胞上CD73高表達而CD39并未觀察到表達[28]。靜止的HSC表達P2Y 亞型 P2Y2 和 P2Y4,激活的HSC表達 P2Y 亞型 P2Y6,P2Y 受體將細胞外 ATP 與肌醇三磷酸介導的細胞溶質鈣信號聯系起來,從而導致局部鈣信號傳導和細胞收縮[28]。HSC上A2A受體的激活抑制HSC收縮功能[29],增強增殖功能[30],還可以增加Ⅰ型膠原蛋白和Ⅲ型膠原蛋白的生成[31-32]。
2.4 單核/巨噬細胞 肝臟中的單核/巨噬細胞包括從外周血募集的單核巨噬細胞和肝臟駐留的KC。KC是人體最大的單核/巨噬細胞群,占肝臟中的NPC約35%和所有組織巨噬細胞的90%。單核細胞表達CD39但很少表達CD73,巨噬細胞CD73和CD39都有表達。巨噬細胞表達的CD39通過將ATP水解最終產生腺苷減弱P2X7引起的炎癥并減弱膿毒癥引起的肝損傷[33]。在感染和腫瘤中也發現了單核/巨噬細胞胞外酶的上調導致ATP被水解產生腺苷,促進感染和腫瘤進展[34-35]。單核/巨噬細胞表達P2X7受體,其激活會活化NLRP3炎性小體導致IL-1β的大量釋放引起炎癥[36]。巨噬細胞表面表達A2A和A2B受體,腺苷可激活A2A和A2B受體產生抗炎性細胞因子IL-10抑制炎癥[34]。
2.5 NK細胞 肝臟含有體內數量最多的NK細胞。肝臟內所有淋巴細胞的三分之一到二分之一可以定義為NK細胞。通常這些先天性淋巴細胞在大多數其他組織中很少見,但在篩查感染和組織病理學方面發揮著關鍵作用。健康個體的NK 細胞中很少有CD73 的表達,但是在受到環境影響時,CD73可以在NK細胞上表達。已經有報道在腫瘤微環境和暴露于間充質干細胞時,NK細胞CD73的表達被顯著上調[37-38]。CD39也已經被報道在NK細胞上表達并且CD39缺失調節IFN-γ的分泌減輕小鼠的肝缺血/再灌注損傷[39]。在腫瘤微環境中,CD73和CD39表達導致的腺苷產生抑制NK細胞反應進而導致免疫抑制,CD39的抑制劑可作為一種藥物恢復NK細胞的細胞毒性[40]。P2X和P2Y受體在NK細胞上表達,它們的激活會抑制 NK 細胞分泌 IFN-γ,抑制 NK 細胞毒性,促進肝再生[41]。A2AR是NK細胞上主要表達的腺苷受體,激活抑制 NK 細胞成熟、增殖、活化、細胞毒性細胞因子(如IFN-γ和TNF-α)的產生,以及對靶細胞的殺傷功能[42-45]。
2.6 T淋巴細胞 T淋巴細胞是淋巴細胞的主要組分,是細胞免疫的主要效應細胞。在肝臟內,常規T淋巴細胞包括 CD8+和 CD4+T淋巴細胞,這些受體分別在 MHC Ⅰ類和Ⅱ類分子的背景下識別抗原。肝臟中的CD8+T淋巴細胞的數量通常超過 CD4+T淋巴細胞并且效應細胞/記憶細胞的頻率高于血液中的頻率。CD39在Treg上表達,CD73在小鼠的Treg上與CD39共表達,但是在人類的Treg中僅有很少一部分表達CD73[9]。除Treg外, CD8+T淋巴細胞和Th17也表達CD73和CD39,并抑制免疫反應[46-47]。P2X7受體在各種T淋巴細胞表面均有表達,被激活后抑制Treg的功能并阻斷產生IL-10的CD8+T淋巴細胞發育[46]。腺苷受體A2AR 在效應T淋巴細胞的炎癥過程中上調[48]。其激活抑制效應T淋巴細胞增殖[49]、細胞毒活性和細胞因子產生(如TNF-α、IFN-γ、IL-2),導致外周免疫抑制。
2.7 B淋巴細胞 B淋巴細胞是體液免疫應答的主要細胞,通過產生抗體、抗原遞呈和產生細胞因子的方式發揮免疫功能。通常,B淋巴細胞活化、分化和增殖發生在次級淋巴器官的淋巴濾泡中,肝內生發中心IgM、IgD、IgG陽性B淋巴細胞分布及 Ki-67、CD23 或 bcl-2、bcl-6 基因產物的表達模式與淋巴結相似,提示肝內生發中心作為功能性濾泡結構發揮作用。人類B淋巴細胞對于CD39和CD73往往是共表達[50]。B淋巴細胞上CD39和CD73通過產生腺苷發揮免疫抑制的功能。B淋巴細胞表達CD39和CD73產生腺苷可通過抑制巨噬細胞的殺菌功能和抑制T淋巴細胞增殖等方式抑制免疫應答[50-51]。除直接表達胞外酶外,B淋巴細胞還可以釋放表達CD39和CD73的囊泡抑制其他細胞的免疫功能[52]。B淋巴細胞上P2受體的表達和功能目前并沒有明確報道。Saze等[50]發現B淋巴細胞表達A1、A2A和A3受體,但不表達A2B受體,并且A3受體的激活抑制B淋巴細胞增殖。
3 嘌呤信號在肝臟疾病中的作用
3.1 肝炎
3.1.1 ATP通過P2受體引發炎癥 有氧條件下線粒體氧化磷酸化是肝細胞ATP產生的主要來源[53]。生理狀態下的胞外ATP水平受到嚴格的控制,通常維持在微摩水平,控制ATP釋放的機制包括分泌性胞吐作用、連接蛋白或 pannexin半通道、ATP 結合盒 (ABC) 轉運蛋白等[10]。然而在肝臟炎癥發生時,往往會導致肝細胞的損傷,ATP會從損傷的細胞中釋放出來,細胞外的ATP濃度顯著增加。ATP是P2受體的配體,P2 受體家族由 P2Y G蛋白偶聯受體和 P2X (P2X1~7) 配體門控離子通道組成。P2X7 受體已被廣泛研究,細胞外的ATP激活特異性P2X7受體活化NLRP3炎性小體,活化的炎性小體剪切IL-1β前體,進而導致IL-1β的大量釋放[54]。在伴刀豆球蛋白 A (Con A) 誘導的急性肝炎中,大量 ATP 從肝臟釋放并誘導 P2Y2受體表達,增強細胞炎性反應并促進肝細胞死亡[55]。此外還有研究[56]表明,ATP除了可以直接增強免疫細胞炎性反應外,還可以通過P2Y受體激活使炎癥細胞向組織損傷部位募集,發揮炎癥效應。
3.1.2 腺苷通過P1受體限制炎癥 ATP可通過胞外酶代謝為腺苷。為了限制炎癥,肝臟募集表達高水平 CD39 和 CD73 的免疫細胞,這些免疫細胞一方面可以清除ATP減弱炎癥反應,另一方面可以產生免疫抑制性的腺苷發揮抗炎功能。Savio等[33]的研究證明了巨噬細胞中的 CD39清除 eATP 并最終產生腺苷來減輕敗血癥相關的肝損傷。腺苷對免疫細胞P1受體的激活可直接發揮抗炎作用。巨噬細胞是產生炎性細胞因子和抗炎性細胞因子的主要細胞,腺苷可抑制巨噬細胞TNF-α、IL-12的產生,增加IL-10的產生[34,57],但對于影響細胞因子產生的機制根據研究所選擇的細胞不同其發揮作用的受體也不同,主要是A2A和A2B受體發揮作用。對于NK細胞,腺苷抑制 NK 細胞的細胞毒活性和細胞因子產生[44]。關于T淋巴細胞的研究中發現,A2A是腺苷發揮作用的主要受體,A2A受體激活可抑制幼稚 CD4+T淋巴細胞分泌 IL-2[58],從而減少其在T淋巴細胞受體刺激后的增殖,A2A受體激活還抑制初始 CD4+T淋巴細胞和極化 Th1、Th2 細胞產生的 IFN-γ及IL-4[59]。除免疫細胞外,腺苷也可以通過A2B作用于內皮細胞調節血管的屏障功能防止免疫細胞在組織中聚集而減弱炎癥反應[60]。病毒性肝炎是常見的慢性肝病之一,其特點是免疫抑制導致病毒持續感染。研究[61]發現HBV感染者中有更高比例的CD39+Treg并與疾病進展相關,此外在戊型肝炎患者的外周血中檢測到 Treg 上 CD73 的表達顯著升高[62],說明腺苷導致的免疫抑制可能是病毒性肝炎中病毒持續存在的原因。
3.2 肝纖維化
3.2.1 嘌呤信號作用于HSC導致肝纖維化 多種原因引起的肝損傷使肝形成瘢痕組織導致肝纖維化。如果瘢痕形成過程持續一段時間,纖維化就會變成永久性的發展為肝硬化。引起肝纖維化的主要細胞成分是HSC,它分化為肌成纖維細胞而導致胞外基質的積累。靜止的HSC表達P2Y2R和P2Y4R,而活化的HSC表達P2Y6R,這些受體均可被ATP和UTP激活,HSC中 P2Y受體的激活使前膠原Ⅰ轉錄增強三倍,說明P2Y受體可能在纖維化中有關鍵作用[27]。有研究[63]表明,P2X7 受體可以通過 PKC 依賴性 GSK3β 通路介導乙醛誘導的HSC活化升高膠原的蛋白質和 mRNA水平,抑制P2X7R可減輕小鼠模型中的肝損傷和纖維化。Le Guilcher等[64]研究表明,當敲除P2X4R基因或對P2X4R給予藥理學抑制可保護小鼠免于肝纖維化和肝肌成纖維細胞積累。在小鼠的肝纖維化標本中發現肝細胞間的纖維化隔膜和肝竇間隙中CD73表達增加[28],敲除CD73后小鼠肝臟釋放的腺苷水平降低,肝臟中的膠原蛋白含量也明顯降低從而防止肝纖維化[65]。關于P1受體在纖維化中作用的報道主要集中在A2AR上,TAA誘導的肝纖維化小鼠肝臟A2AR表達增加[32],腺苷激活A2AR可促進HSC的增殖和Ⅲ型膠原的表達[30,32]。A2AR缺陷小鼠可防止小鼠發生纖維化[32],A2AR 拮抗劑治療既可以預防也可以逆轉乙醇誘導的肝纖維化[66]。以上這些研究表明無論是ATP信號還是腺苷信號都在肝纖維化中發揮著促纖維化作用,P1和P2受體可作為纖維化治療的潛在靶點。
3.2.2 嘌呤信號通過調節炎性反應調節肝纖維化 炎癥在纖維化過程的任何階段,甚至在纖維化消退過程中都起著關鍵作用。在肝臟炎癥期間,免疫細胞釋放大量炎性和抗炎性細胞因子,這些細胞因子對于HSC的激活具有調節作用。ATP和腺苷分別作用于免疫細胞調節炎性和抗炎性細胞因子的產生。TNF-α和IL-1是ATP炎性信號中產生的兩種主要細胞因子。在肝纖維化過程中,TNF-α在HSC的活化和細胞外基質的合成中起重要作用[67],IL-1可直接激活HSC,刺激其產生MMP-9、MMP-13和TIMP-1,導致肝纖維化[68]。腺苷可誘導免疫細胞產生TGF-β和IL-10。TGF-β 是已知最強的肝纖維化誘導劑,TGF-β1已被證明在肝纖維化的啟動和維持中發揮關鍵作用,TGF-β1可通過多方面作用促纖維化,包括刺激HCS活化,誘導基質產生基因表達,抑制細胞外基質降解等[69-70]。IL-10可下調促炎反應并對肝纖維化具有調節作用,IL-10 已被證明通過抑制 HSC 活性發揮抗纖維化作用[70],IL-10對于肝纖維化患者可能具有治療潛力。因此腺苷通過免疫細胞對纖維化的作用可能是雙向的。
3.3 肝細胞癌(HCC) 慢性肝炎和肝硬化最終可發展為HCC。從壞死細胞中釋放的ATP 作為免疫系統的早期危險信號在腫瘤進展過程中起著重要作用。與健康肝組織相比,肝腫瘤組織中P2受體的表達增加[71-72]。P2X3 嘌呤能受體高表達與無復發生存率差相關,而 P2Y13 高表達與無復發生存率改善相關,細胞外ATP 可激活P2X3 受體,促進 HCC細胞的增殖[71]。P2Y11R在人類 HCC 中特異性表達促進ATP 誘導的 Ca2+信號傳導和細胞遷移。P2Y2信號也可以通過ATP介導的Ca2+信號傳導促進HCC細胞遷移。在肝臟腫瘤環境中有大量胞外酶表達,通過產生腺苷促進腫瘤進展。最近的研究[35]發現HCC上表達的CD73和巨噬細胞上表達的CD39協同作用產生腺苷抑制T淋巴細胞功能。P2受體在HCC上和各類免疫細胞上都有表達,腺苷可通過HCC表面A2AR激活PI3K/AKT 信號促進腫瘤增殖和轉移[73],免疫細胞上A2AR的激活則會抑制免疫應答促進腫瘤逃逸。
4 小結
ATP和腺苷在胞外可作為不同的兩種信號發揮炎性和抗炎性的作用,胞外酶可以將ATP水解為腺苷(圖2)。肝臟微環境中的肝臟駐留細胞和肝臟募集的免疫細胞表面有P1受體、P2受體和胞外酶的表達。
肝臟炎癥發生時,肝臟通過調節胞外酶的表達減少ATP引發的炎性反應,增加腺苷的抗炎性反應來限制炎癥。嘌呤信號可通過直接作用的方式和調節炎性及抗炎性反應影響肝臟疾病進展。
利益沖突聲明:本文不存在任何利益沖突。
作者貢獻聲明:馬發祥負責查閱文獻,撰寫文章;涂正坤負責擬定文章思路,指導撰寫文章并最后定稿。

