組學技術在赭曲霉毒素A研究中的應用進展
閆 靜 閻賀靜 王薇薇 李 軍 朱鳳妹
(河北科技師范學院食品科技學院,河北 秦皇島 066600)
赭曲霉毒素(Ochratoxin)是由多種曲霉屬和青霉屬產生的一類次級代謝產物,該物質含有多種結構類似化合物,如赭曲霉毒素A(Ochratoxin A,OTA)、赭曲霉毒素B(Ochratoxin B,OTB)、赭曲霉毒素C(Ochratoxin C,OTC)、赭曲霉毒素α(Ochratoxin α,OTα)、赭曲霉毒素β(Ochratoxin β,OTβ)等。其中OTA 的毒性最大,分布最廣,含量最高,對農產品的污染最重,廣泛存在于各種食品、中草藥及香料中,嚴重危害人類健康[1]。且OTA有熱穩定強、水溶性差的特點,在食品中經高溫加工(250 ℃)難以去除,因此世界各國對各種制品中的OTA含量制定了嚴格的監管限制及檢測技術手段[1-4],具體信息如表1所示。
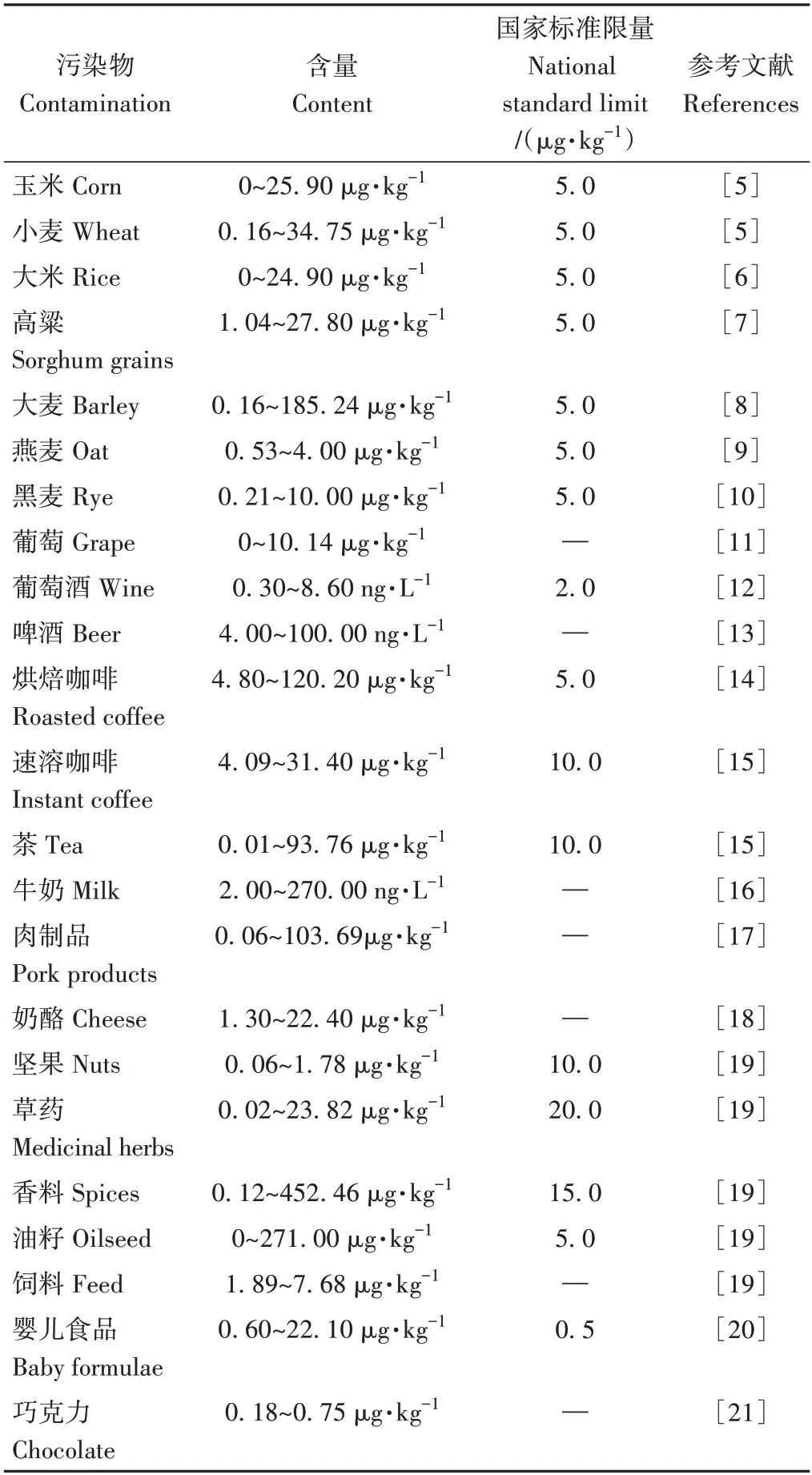
表1 各種制品的污染情況及相關標準限量Table 1 Contamination of various products and relevant standard limits
在已發現的多種真菌毒素中,OTA 的危害程度僅次于黃曲霉毒素。研究表明,OTA具有多種毒害作用,如腎毒性、肝毒性、腸毒性、免疫毒性、致畸、致癌、致突變等,是巴爾干地方性腎病的誘因之一[22]。國際癌癥研究機構(International Agency for Research on Cancer,IARC)和世界衛生組織(World Health Organization,WHO)已將OTA 歸類為2B 類致癌物[23]。組學技術是研究真菌毒素領域的重要工具,用于識別生物標記物,檢測真菌毒素的種類并探究其生物合成途徑。本文擬對近年來應用組學技術對OTA 研究的情況做一概述,旨在為相關科技工作者對OTA 的生物合成機制、致毒機理、污染防控以及抗赭曲霉毒素藥物的開發等方面提供參考。
1 基因組學技術在赭曲霉毒素A 研究中的應用
基因組學是一門對生物體所有基因進行集體表征、定量研究及不同基因組比較研究的交叉生物學學科。基因組學技術能識別與真菌毒素產生有關的基因,并分析相關基因組的結構、功能、進化、定位、編輯和作用[24]。基因組學包括多種內容,如功能基因組學、結構基因組學、比較基因組學和宏基因組學等。其中功能基因組學有助于了解宿主與真菌的相互作用及影響真菌毒素產生的遺傳因素,對于制定防控OTA 污染的策略起重要作用[25]。比較基因組學是用于比較不同物種或不同群體間的基因組差異和相關性的系統生物學研究,目前廣泛用于研究OTA 的生物合成途徑。
隨著基因組學不斷的發展,OTA 的生物合成途徑研究不斷深入。Wang 等[26]利用Aspergillusochraceus、Aspergilluscarbonarius、Aspergillusniger、Aspergillussteynii、Aspergilluswesterdijkiae和Penicilliumnordicum均可以產生OTA,經基因組比較分析,鑒定出了與OTA 生物合成相關的關鍵基因并推測出合成途徑,即起始由乙酰輔酶A 和丙二酰輔酶A 經聚酮合成酶(polyketide synthases,PKS,基因名OtaA)作用合成7-甲基蜂蜜曲霉素,然后被細胞色素P450 單加氧酶(OtaC)氧化生成OTβ。OTβ 和L-β-苯丙氨酸在非核糖體肽合酶(nonribosomal peptide synthetase,NRPS,基因名OtaB)作用下形成酰胺鍵進而形成OTB。OTB 再經鹵代酶(OtaD)氯化,最終得到OTA,如圖1 所示。此外,該項研究還證明了OTβ 和OTB 是OTA 生物合成的中間產物,而OTC 和OTα 則不是。這項研究成功證明了所有OTA 產生菌中都存在一條統一的OTA 生物合成途徑,包含4 個高度保守的基因和1 個堿性亮氨酸拉鏈轉錄因子(basic leucine zipper,bZIP,基因名OtaR1),并闡明了途徑中的特定基因、特定酶與代謝中間產物的關系。在此基礎上,Ferrara 等[27]通過對產OTA 的19 種曲霉和2 種青霉進行基因組比較,分析發現在PKS 和NRPS之間存在一個新基因,該基因序列中的SnoaL 環化酶結構域(OtaY)起到了推動OTA 合成的作用。這是首次在A.carbonarius已知的OTA 生物合成基因簇上發現了一個新的未知基因,基因簇如圖2 所示。這為更深入全面地了解OTA生物合成提供了新證據。
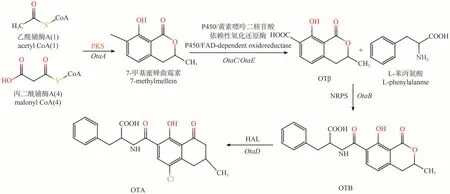
圖1 推測的OTA生物合成途徑Fig.1 The putative OTA biosynthesis pathway

圖2 預測Aspergillus carbonarius的OTA生物合成基因簇Fig.2 Prediction of OTA biosynthesis gene cluster in Aspergillus carbonarius
與傳統的真菌毒素檢測方法相比,聚合酶鏈式反應(polymerase chain reaction,PCR)可以更加便捷、快速、高效、準確地檢測出OTA。Susca 等[28]從奶酪表面分離了5 株A.westerdijkiae并分析其基因組序列數據,發現編碼bZIP 轉錄因子的基因只存在于產OTA 菌株中。利用這一信息設計了一種PCR 方法,可以專一地識別并區分A.westerdijkiae能否產生OTA。張健等[29]利用A.nigerCBS 513.88 中PKS 的酰基轉移酶結構域(acyltransferase,AT)設計引物,建立了一個針對產毒黑曲霉的PCR 檢測方法,該方法適用于產毒黑曲霉的初篩,對黑曲霉產毒污染農產品具有良好的檢測及預警作用。
基因組學的進步引發了系統生物學領域的一場革命,促進了對復雜生物系統的理解。將新發現的每一種產毒菌株的基因組序列進行比較分析,經過不斷修訂,改進基因組注釋并對預測基因進行比較,可以提高對OTA 合成途徑的了解。從基因組數據中挖掘的與OTA相關的基因及不同菌種之間的差異基因都將是研究OTA 調控、防治的重要對象。基因組學還有望促進治療OTA 藥物的開發,并為制定預防人和動物疾病的策略提供重要信息。盡管該技術已經揭示了OTA 生物合成的一些關鍵酶促反應,但其生物合成途徑及其調控機制尚未完全闡明,需要和其他組學技術相結合才能更好地說明問題。
2 轉錄組學技術在赭曲霉毒素A 研究中的應用
轉錄組學是在整體水平上研究細胞中基因轉錄及轉錄調控規律的一門學科,是研究細胞表型和功能的重要手段[30]。轉錄組學已經廣泛應用于研究真菌毒素,可以同時檢測大量基因表達的變化,提供有關基因組結構和有毒化合物誘導細胞機制的信息[31]。因此,應用轉錄組學可以確定OTA 的生物合成途徑、闡明其藥理學及毒理學機制,為預測遺傳毒性和致癌性提供有用的信息。
A.carbonarius是OTA的主要產生菌,是農產品中廣泛存在的真菌病原體,嚴重威脅人和動物的健康,但不是所有的A.carbonarius都能產生OTA,研究菌株之間的差異能制定有效的防控策略,降低食品中OTA 的污染[32-33]。高通量測序技術(transcriptome sequencing,RNA-Seq)、逆轉錄PCR(reverse transcription-PCR,RTPCR)和高通量微陣列分析等轉錄組分析手段已廣泛用于真菌毒素的研究中。利用RNA-Seq 分析兩種A.carbonarius(產毒與不產毒)與OTA 相關的轉錄變化,在不產毒的菌株中存在大量的差異表達基因,并利用實時熒光定量PCR(quantitative real-time PCR,qRTPCR)進行驗證。其中所有與OTA 生物合成相關的假定基因均下調幅度最大,AcOTAbZIP的下調可能是不產OTA 的主要原因。此外,AcOTApks基因中的AT 結構域中存在有害突變,也阻止了OTA的產生[33]。
基因可以在不同的環境條件下進行不同的調節和表達,進而合成不同的代謝物[34],如表2中的環境因素部分所示。干腌火腿是一種重要的肉類產品,通常霉菌有助于火腿感官品質的發展,然而一些霉菌如P.nordicum能在高鹽環境中產生OTA。qRT-PCR 分析表明,NaCl可通過激活參與OTA 生物合成途徑中的otapksPN和otanpsPN基因,從而導致OTA 的產生[24]。此外,產毒能力強的P.nordicum不需要毒素和NaCl的誘導就可產生大量的OTA,而產毒能力弱的菌株則需要誘導[34]。這為減少干腌肉制品中的OTA 污染奠定了基礎。

表2 轉錄組學在影響OTA合成的環境因素、OTA毒理學機制與生物防治方面的應用Table 2 Application of transcriptomics in environmental factors affecting OTA synthesis,OTA toxicological mechanisms and biological control
目前,OTA的多種毒性機制尚未闡明,可以利用轉錄組學技術開展相關的毒理學研究[35-39],如表2 中毒理學機制部分所示。OTA 是一種有效的腎致癌物,且作用效果具有性別差異,以小鼠為研究對象,雄鼠對OTA 更為敏感,雄鼠體內大量的差異表達基因主要與代謝(Cyp2c11、Cyp2d1、Cyp2d5、Dhrs7)、鈣穩態(Gc、S100g)和轉運(Slc51b)有關[35]。斑馬魚中發生肝癌的相關基因和途徑與人類之間高度保守[36],以斑馬魚胚胎為研究對象,研究轉錄組首次發現OTA 對早期發育脊椎動物具有肝毒性并闡明了其作用機制[37]。該研究可為評估孕婦和發育中個體的健康風險提供更多信息。向分化的人腸上皮細胞系Caco-2 細胞加入不同濃度的OTA 共培養后進行轉錄組分析,確定了OTA 引起腸功能損害的部分原因[38]。這項研究強調了OTA的腸道毒性,并提供了生物反應的全基因組視圖,為腸道毒性提供了理論基礎,并有助于確定OTA 的最大殘留限量,但還需進行更詳盡的研究闡明所有的潛在機制。
轉錄組學有助于理解復雜的生物系統和開發新的生物標記物,這些可以幫助早期診斷疾病,并找到有效的治療方法或藥物,如表2 生物防治部分所示。轉錄組學已證明Bacillussubtilis可通過產生伊枯草菌素A抑制A.carbonarius的生長和OTA 的產生[39]。這一發現為開發高效的抗OTA 藥物提供了有效信息,對農業和生物醫學具有重要意義。OTA生物降解的主要機制為酰胺鍵水解后降解為無毒或低毒的OTα。從微生物和動物胰腺中分離或克隆的一些OTA 降解酶,在食品和飼料工業中有著巨大的應用前景,但微生物在食品和飼料工業中的應用必須謹慎,尤其要注意安全性。
由于轉錄調控在真菌次級代謝過程中的重要性,轉錄組分析可以作為深入了解OTA 的重要工具。經過回顧OTA 的相關轉錄組研究,雖然該技術沒有闡明OTA 的作用模式,但有助于研究OTA 的毒理學信息。因此,轉錄分析方面仍需進行大量的工作,以便在轉錄組水平上提取到更多關于OTA 的信息,為研究和理解OTA 的生物學開辟新的途徑。同時,轉錄組與經典毒理學或與其他組學技術相結合的研究將成為熱潮,能更深入地探究影響OTA作用模式的因素。
3 蛋白質組學技術在赭曲霉毒素A 研究中的應用
蛋白質是生理生化途徑的重要組成部分,是體內代謝的主要信號分子,蛋白質組學可以重點識別和表征參與OTA 代謝途徑中的蛋白質,包括研究每種蛋白質的細胞位置、亞型和功能,以闡明生物系統中發生的分子過程,對于揭示生物過程中潛在的分子機制至關重要[40]。微生物種類、營養條件和環境信號等因素影響著OTA 的生物合成[41]。Crespo-Sempere 等[42]首次利用蛋白質組學分析兩種A.carbonarius(產毒與不產毒)中與OTA 產生相關的蛋白質,二維凝膠電泳和質譜法表示這些蛋白質可能在氨基酸代謝、氧化應激和孢子形成通路中發揮作用;同時,還發現了一種上調的功能未知的蛋白質CipC,通過RT-PCR 證實了該蛋白參與OTA 的生物合成,為OTA 生物合成途徑提供了新見解。
環境因素對OTA 生物合成具有顯著影響,如表3環境因素部分所示。蛋白質組學是探究一些曲霉和青霉能夠在高鹽環境中生長并產生OTA 的有力工具[43]。Wang 等[44]利用基于同位素標記相對和絕對定量(isobaric tags for relative and absolute quantification,iTRAQ)的蛋白質組學技術分析赭曲霉在高鹽(70 g·L-1)和低鹽(20 g·L-1)時的蛋白質差異表達,發現NaCl 濃度可影響麥角甾醇的合成途徑、能量代謝、氧化應激反應、蛋白質的合成加工以及次級代謝等方面從而影響OTA 的合成。這些研究為防控OTA 污染,保護食品安全提供了思路。

表3 蛋白質組學在影響OTA合成的環境因素、OTA毒理學機制與生物防治方面的應用Table 3 Application of Proteomics in environmental factors affecting OTA synthesis,OTA toxicological mechanisms and biological control
OTA的多種毒害作用可誘導哺乳動物細胞系中的DNA 損傷、細胞毒性和凋亡,如表3毒理學機制部分所示。microRNA(miRNA)可調控基因表達,參與機體的生理和發育過程并與人類疾病息息相關。Zhao 等[45]首次通過解除miRNA 的調控,利用高通量miRNA 分析、基因本體(Gene Ontology,GO)和京都基因與基因組百科全書(Kyoto Encyclopedia of Genes and Genomes,KEGG)分析研究OTA 對HEK293 和HepG2 細胞造成的損傷,發現miRNA 主要與人類癌癥和信號轉導途徑有關。在探究OTA 誘導早期肝毒性的機制時,將大鼠用OTA 灌胃13周后測量肝臟中miRNA、mRNA 和蛋白質的表達,發現兩種途徑與肝損傷直接相關,分別是初級膽汁酸生物合成和細胞色素P450 對外源性物質的代謝[46]。
據報道,在谷物、飼料和食品中易檢測出OTA,為保障人和動物的安全及減少農民經濟損失,防治OTA污染十分重要[47]。OTA 的生物防治是一種很有前景的策略,生物脫毒方法具有更好的安全性、風味、營養質量、感官特性、可用性和成本效益,比物理和化學脫毒方法更有前景[47-52],如表3 生物防治部分所示。基于iTRAQ 蛋白質組分析發現檸檬醛能夠抑制A.ochraceus的生長和OTA 的積累,這一結果證明了檸檬醛具有對糧食和其他農產品保鮮的潛力,為其在亞抑制濃度下的抗OTA 機制提供了新見解[48]。熊果酸(ursolic acid,UA)廣泛存在于水果、食品和藥用植物的各種表皮蠟中。有研究表明UA 具有保護腎臟功能,利用凝膠電泳法分析UA 對OTA 誘導的腎細胞毒性的保護機制,證明其具有治療腎毒性方面的潛力[49],并為研制治療腎細胞毒性的醫藥提供了新思路。干腌發酵香腸的工業生產過程中,Debaryomyceshansenii和迷迭香衍生物可作為生物防治劑抑制OTA的產生[50-52]。
蛋白質組學通過研究真菌產生OTA 時的蛋白質含量,提高對真菌次級代謝時細胞行為的理解,通過蛋白質譜的變化信息可以增強對生物因素影響真菌次級代謝的了解。蛋白質組學促進了OTA 領域的發展,探究了環境因素影響OTA 生物合成的機制以及OTA 的毒理學機制,為生物防治劑的研制提供了大量的證據。蛋白質組為深入了解OTA 的生物學功能提供了重要的線索,為今后更加深入的研究提供了有力的工具。同時與其他組學技術聯合使用成為今后的研究熱點,能夠更全面系統的了解OTA。
4 代謝組學技術在赭曲霉毒素A 研究中的應用
代謝組學重點分析代謝組,包括有機體中所有的代謝物,如代謝中間體、激素和其他信號分子以及次級代謝物[24]。該技術分為靶向和非靶向兩種,前者側重于識別和量化已知的真菌毒素[53],而后者用于發現新的代謝物。目前,代謝組學通常會基于一系列色譜、質譜聯用的手段來分析檢測真菌毒素,彌補質譜在痕量水平上的缺陷[54-55]。
以真菌為重點,代謝產物譜已被用作真菌分類學和生理學研究的常用工具,還可以用來檢測食品中病原體和腐敗微生物[56]。一些菌株能夠通過防御機制和相關酶的水解或結合反應將親本赭曲霉毒素轉化為衍生赭曲霉毒素[57-60]。通過液相色譜-高分辨質譜(liquid chromatography-high resolution mass spectrometry,LCHRMS)對3株經OTA誘導后的釀酒酵母進行衍生赭曲霉毒素鑒定,鑒定出了OTα、OTβ、OTC、赭曲霉毒素α甲酯、赭曲霉毒素B 甲酯、乙酰胺赭曲霉毒素A、羥基赭曲霉毒素A、羥基赭曲霉毒素A甲酯和赭曲霉毒素A纖維二糖酯。評估葡萄品種和成熟期對形成OTA 及其衍生毒素的影響,LC-HRMS鑒定出了乙酰胺赭曲霉毒素A,這一發現為保證葡萄、葡萄酒等制品的安全和質量提供了新的方向。同時也表明了僅檢測OTA 無法保證食品安全,有必要在加工過程中對這些衍生毒素進行檢測并提出相關的標準法規。
環境是影響OTA 生物合成的重要因素,代謝組會隨著微生物、宿主和環境的波動而不斷變化。如表4環境因素部分所示。在特殊環境空間站中,真菌會產生腐蝕設備的有機酸和危害健康的真菌毒素從而對空間站的長期運行構成威脅,微重力是空間站中不可避免的特殊條件[61]。以A.carbonarius為研究對象,以氣相色譜飛行時間質譜(gas chromatography time-offlight-mass spectrometry,GC-TOF-MS)為手段分析微重力對OTA、有機酸的產生及相關合成途徑的影響,為空間站能長期安全的運行提供了保障。

表4 代謝組學在影響OTA合成的環境因素、OTA毒理學機制與生物防治方面的應用Table 4 Application of metabolomics in environmental factors affecting OTA synthesis,OTA toxicological mechanisms and biological control
代謝組學可從分子水平上理解OTA的致毒機制[62],如表4毒理學機制部分所示。斑馬魚胚胎經OTA誘導后進行代謝譜分析,提出了OTA 肝毒性的綜合模型并確定了相關的代謝途徑。牛奶中通常會同時存在黃曲霉毒素(aflatoxin M1,AFM1)和OTA,基于代謝組評估AFM1 和OTA 在CD-1 小鼠模型中的腎毒性和肝毒性的聯合效果,這是首次嘗試評估和比較OTA 和AFM1的腎毒性。該項研究為制定牛奶中OTA 的限量標準提供證據,也為將OTA 歸類為更高水平的致癌物提供了依據。以氣相色譜-質譜聯用(gas chromatographymass spectrometry,GC-MS)和核磁共振氫譜為基礎的手段,結合病理切片等傳統技術,探討了OTA 影響脂肪酸代謝而導致肝毒性和腎毒性的機制,為全面理解并預防OTA的肝毒性和腎毒性提供了理論基礎。
OTA對腸道上皮細胞具有明顯的侵犯作用,損害了動物健康,減少OTA對畜牧業的不利影響迫在眉睫[65-66],如表4 生物防治部分所示。經液相色譜/質譜法(liquid chromatography/mass spectrometry,LC/MS)分析姜黃素對OTA 誘導后鴨子的血清脂質代謝產物的水平及盲腸消化液中的代謝物的影響,結果顯示姜黃素具有抗氧化功能,調節腸道微生物組成,減輕OTA 的腸毒性作用,對機體具有明顯的保護作用,是預防OTA 誘導的肝氧化損傷的重要物質。
代謝組學分析也具有明顯的缺陷,該技術能顯示不同處理后代謝物的變化,但不能區分這些變化與不同代謝物的因果關系。代謝組學技術為深入了解OTA的生物學功能提供了新的方法,同時與其他組學技術聯合使用成為今后的研究趨勢,能夠從不同維度解析OTA的致毒機制及防控策略,更深入地了解OTA。
5 聯合組學及其他組學技術在赭曲霉毒素A研究中的應用
OTA 的生物合成機制、毒理學機制以及生物防控機制極其復雜,這些機制是多層次網絡相互調節作用的結果。使用單一組學技術難以全面、系統、真實地反映這些機制。近年來,聯合組學分析在OTA 的研究中逐漸增多,如轉錄組學-蛋白質組學聯合、蛋白質-脂質組學聯合、轉錄-脂質組學聯合分析。
通過組學技術聯合應用,更好地探究了環境因素對OTA 生物合成的影響,與分子層面的全局代謝變化相關聯,進而從信號調控、轉錄翻譯、生化反應、代謝途徑等多個維度研究了pH值影響OTA生物合成的機制。Zhao 等[67]聯合轉錄組和蛋白質組揭示了P.citrinum的OTA 的生物合成受pH 調控,在酸性環境(pH 值為3)下毒素產生受到抑制。轉錄組數據發現氨基酸、碳水化合物、無機離子的運輸和代謝,次級代謝物的合成以及能量供應等代謝途徑可能參與OTA 生物合成。蛋白組數據發現,在酸性培養條件下,與OTA 合成相關的酶及蛋白表達水平顯著降低。該研究為進一步研究OTA 生物合成的分子水平提供了基礎,揭示了OTA合成和分子調控的可能機制,也為控制OTA 的合成提供了科學指導。
OTA 的腸毒性是近兩年的研究熱點,通過轉錄組和蛋白質組交叉組學分析AFM1 和OTA 的聯合作用,確定了這兩種毒素在破壞腸道完整性方面具有協同作用,且作用機制與一系列與腸道完整性相關的途徑有關,如腫瘤壞死因子(tumor necrosis factor,TNF)信號通路、肌動蛋白細胞骨架的調節、粘著斑痕、粘附連接和縫隙連接途徑[68]。這些結果表明,AFM1 和OTA 的聯合使用可能會加劇腸道炎癥,因此監管機構在進行風險評估時僅以一種毒素作為標準太過片面,應注意多種毒素對食品的污染。
在OTA 生物防治方面,聯合組學能夠用來挖掘更多有效的生物防治劑減少OTA 的污染,為研制藥物治療腎毒性和肝毒性提供新思路。脂毒性是導致嚴重腎病的最常見原因,目前可供選擇的治療方法很少。轉錄組與脂質組聯合分析,發現曲克蘆丁可有效的降低腎病患者甘油三酯、磷脂酰膽堿和磷脂酰乙醇胺的水平,減輕了OTA 誘導的腎毒性和腎臟炎癥[69]。該研究為曲克蘆丁能治療腎病的潛在醫療用途奠定了基礎。近年來,研究人員發現了大量能夠降解或吸附OTA 的微生物,包括放線菌、細菌、絲狀真菌和酵母菌。蛋白質組和轉錄組分析的結果表明,拮抗酵母Yarrowia lipolyticaY?2 對OTA 的降解可能是對OTA 脅迫的多種防御反應的協同作用[70]。該研究有助于了解酵母菌降解OTA的分子機制并將其用于OTA的生物防治。
微生物組學是以微生物組為研究對象,利用高通量測序和質譜等技術來探究其內部群體間的相互關系、結構、功能及其與環境或宿主間相互關系的學科。近年來,微生物組學已成為食品行業的熱門話題,用來提高食品鏈的質量和安全[71]。時空組學技術是一種空間分辨的轉錄組技術,能更好地闡明外源化學物與生物活性分子的時空特性,對于細胞生命活動的調控機制具有重要意義。該技術在描述生物細胞中的生物活性分子間的互作關系及各種疾病導致的細胞結構和功能的改變等研究中具有應用前景與價值[72-73]。雖然目前鮮有明確研究是利用微生物組學技術、時空組學技術探究OTA,但這些技術是探究產OTA 菌株與復雜環境或宿主關系的有力工具,闡明OTA 的毒性機制,為解決OTA 造成的糧食污染、人和動物的健康危害、環境污染等問題提供革命性的新思路和新方法。
6 結論與展望
組學技術是應用于生物科學的一組分析工具,不同的研究對象對應著不同的組學技術及方法,如圖3所示。基因組學有助于識別與OTA 產生有關的基因,開發新的OTA 防控策略;轉錄組學側重于研究整套RNA,在藥理學、藥物代謝動力學和毒理學領域廣泛應用,有助于了解OTA 的遺傳毒性和致癌的生物學機制;蛋白質組學能夠識別和表征與OTA 生物合成途徑有關的整個肽和蛋白質分布,還可以整合不同的分析方法和技術,了解生物體內細胞過程的全局信息。這兩種組學信息可以幫助農民在作物發育的早期階段預測OTA 污染。最后,代謝組學重點分析的是對食品安全有重大影響的代謝物和小分子,例如衍生赭曲霉毒素。聯合組學是未來生物學研究的一個趨勢,探索解決每個組學所面臨的一些問題,從DNA、RNA、蛋白質和代謝產物等多方面來控制和確保食品安全和質量。如轉錄組學本身并不能產生足夠的信息來理解OTA產生的生物學過程,因此有必要將其與基因組學或蛋白質組學結合,以更清楚地了解其生物合成途徑。此外,還應該結合新興的微生物組學技術、時空組學技術等手段來研究OTA,以便更深入全方位的了解其信息。通過多種組學及聯合組學對OTA 的生物合成途徑、調控因子、信號轉導、毒理學機制等方面進行深入研究,了解更深層的信息。
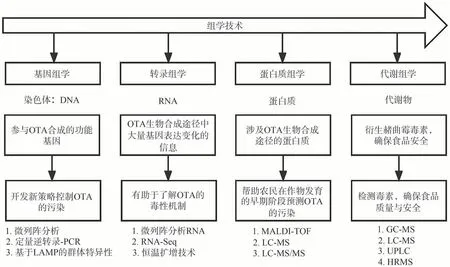
圖3 用于OTA研究的不同組學方法和分析技術示意圖Fig.3 Schematic diagram of different omics approaches and analytical techniques used for OTA research

