川芎嗪通過PINK1/Parkin通路調控自噬對新生大鼠缺氧缺血性腦病的影響
楊丹 王剛 楊麗君 段壬澤 陳顯兵
(1.湖北民族大學附屬民大醫院病理科,湖北恩施 445000;2.湖北民族大學醫學部,湖北恩施 445000)
新生兒缺氧缺血性腦病(hypoxic-ischemic encephalopathy,HIE)是指各種圍生期窒息引起的部分或完全缺氧、腦血流減少或暫停而導致胎兒或新生兒腦損傷。其病死率高,是導致新生兒急性死亡和慢性神經系統損傷的主要原因之一[1]。每年約有100萬新生兒死于出生窒息,無數新生兒因出生窒息造成嚴重的腦損傷且留下長期后遺癥,給家庭與社會造成了嚴重負擔[2]。川芎嗪是活血行氣藥川芎的主要提取物之一,其具有抗炎、抗氧化、抗凝血、細胞保護及改善心功能等作用[3]。段晨陽[4]的研究顯示,大腦缺氧缺血會導致線粒體損傷,而維持線粒體內環境穩態對細胞正常活動及機體健康至關重要。線粒體自噬是細胞內線粒體質量控制的重要機制,在生理水平下,線粒體自噬能夠清除受損細胞器,保護神經元;一旦超出細胞可調控的生理水平,線粒體自噬就將啟動細胞內的凋亡程序,引導細胞死亡[5]。本實驗通過建立HIE新生鼠模型,研究川芎嗪對缺氧缺血誘導的線粒體自噬的影響,并探討川芎嗪治療HIE的可能分子機制,以期為臨床治療提供依據。
1 材料與方法
1.1 實驗動物及試劑
40 只SPF 級7 日齡Sprague-Dawley 新生大鼠,雌雄不限,體重11~14 g,新生大鼠和母鼠由三峽大學實驗動物中心提供。川芎嗪注射液(批號72102041)購于湖北民族大學附屬民大醫院,蘇木精- 伊紅(hematoxylin-eosin, HE) 染色液(C211003)購于珠海貝索生物有限公司,免疫組化試劑盒(1902199710)購于福州邁新生物技術開發有限公司,一步法TUNEL 原位細胞凋亡檢測試劑盒(E-CK-A320)購于武漢伊萊瑞特生物公司,尼氏染色液(C0117)、PTEN 誘導假定激酶1(PTEN-induced putative kinase 1, PINK1) 抗體(AF7755)購于碧云天生物技術有限公司,Parkin抗體(WL02512)購于沈陽萬類生物科技有限公司,自噬特異性基因(Beclin1)抗體(3495S)、泛素結合蛋白(P62)抗體(88588S)購于美國Cell Signaling Technology 公司,微管相關蛋白1 輕鏈3β (microtubule-associated protein 1 light chain 3β,LC3B)抗體(ab51520)、HRP 標記山羊抗兔IgG(ab6721)、HRP標記山羊抗小鼠IgG(ab6789)購于英國Abcam公司。
1.2 新生大鼠HIE模型制備
根據文獻[6]采用的造模方法,將7 日齡新生大鼠用乙醚麻醉后,從頸部正中切開皮膚,鈍性剝離肌肉筋膜,分離出左側頸總動脈并使用5號手術縫合線將左側頸總動脈結扎,逐層縫合皮膚。手術結束后放回母鼠旁恢復1 h,然后將術后新生大鼠置于8% O2+92% N2密閉箱中缺氧2 h(氧流量2 L/min),缺氧結束后放回母鼠籠中常規喂養。
1.3 實驗動物分組與處理
將40 只新生大鼠隨機分為假手術組(n=8)、造模組(n=32)。造模組因各種原因死亡8 只,將存活的24 只隨機分為模型組(n=12)、川芎嗪組(n=12),川芎嗪組在缺氧缺血完成后30 min 給予腹腔注射川芎嗪注射液20 mg/kg,每日1 次,共治療7 d。同時,假手術組只暴露血管,不做其他處理);模型組腹腔注射等體積的0.9%氯化鈉溶液。觀察各組新生大鼠的生長發育、行為活動及對刺激的反應情況。
1.4 標本取材
藥物干預7 d 后,每組隨機抽取4 只新生大鼠進行腦組織固定。具體步驟如下:乙醚麻醉后,斷頭取腦,小心剝離出腦組織,沿大腦視交叉處做4~5 mm 冠狀切片,將其置于4%多聚甲醛中固定48 h,后進行脫水、石蠟包埋。采用HE 染色、尼氏染色觀察腦組織神經元形態學變化,免疫組織化學法觀察PINK1、Parkin 蛋白陽性細胞表達,采用TUNEL 染色觀察神經元凋亡情況。剩余各組新生鼠乙醚麻醉后,斷頭取腦,剝取左側海馬組織及皮質組織,放入事先標記好的EP 管中,放入-80℃冰箱備用。
1.5 HE、尼氏染色
將石蠟塊冷凍10 min 后進行切片,厚度為4 μm,常規烤片后二甲苯脫蠟,梯度酒精至水、蒸餾水洗滌。后將切片放入蘇木素染液中染色10 min,水洗1 min,分化15 s、水洗1 min,后置于伊紅染色2 min,水洗1 min,梯度酒精脫水,二甲苯透明,中性樹膠封片。
同上行4 μm 切片,烤片后二甲苯脫蠟、梯度酒精至水、蒸餾水洗滌。將尼氏染液水浴加熱至37℃,再將切片放入尼氏染液中30 min,蒸餾水洗滌,脫水、透明、中性樹膠封片。
1.6 免疫組織化學染色
同上述方法將蠟塊行4 μm 切片,脫蠟至水,使用EDTA修復液高壓修復,自然冷卻后按照免疫組化試劑盒說明書依次滴加內源性過氧化物酶阻斷液、非特異性染色阻斷劑,PINK1(1∶100)、Parkin(1∶100)一抗孵育1 h,清洗后依次滴加生物素標記羊抗小鼠/兔聚合物、鏈霉菌抗生素蛋白-過氧化物酶,DAB顯色,經復染、分化、返藍后,中性樹膠封片,掃描采集并分析圖片,采用Image J計算陽性染色面積與總面積之比。
1.7 TUNEL染色
將4 μm 切片常規脫蠟后按照試劑盒說明書步驟依次滴加蛋白酶K 工作液、1×DNase Ⅰ Buffer、DNase Ⅰ工作液、TdT Equilibration Buffer,孵育后滴加陽性標記工作液,DAPI 染色后滴加抗熒光猝滅封片劑封片,熒光顯微鏡下觀察神經元凋亡情況,采用Image J計算細胞凋亡率。
1.8 Western blot
按照1 mg腦組織加入9 μL裂解液、0.09 μL蛋白酶抑制劑的比例進行組織勻漿、超聲,勻漿液低溫高速離心(4℃,12 000 r/min,15 min)后取上清液,用BCA 蛋白試劑盒檢測組織蛋白濃度。制備12% SDS-PAGE 凝膠,每孔上樣3 μL,依次進行電泳、轉膜、封閉、TBST 洗膜,加入相應的PINK1(1∶1 000)、Parkin(1∶500)、LC3B(1∶1 500)、P62(1∶1 000)、Beclin1(1∶1 000)一抗,4℃孵育過夜。TBST洗膜3次,10 min/次,加山羊抗兔(1∶6 000)、山羊抗小鼠(1∶6 000)二抗。37℃孵育1 h,TBST洗膜3次,每次10 min,滴加ECL 化學發光顯色液進行曝光處理,采用Image J軟件計算灰度值。
1.9 統計學分析
采用SPSS 22.0 軟件進行統計學分析,計量資料采用均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間兩兩比較采用SNK-q檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 各組新生大鼠一般生長情況
生后7 d假手術組新生大鼠出現細小的絨毛附著在全身皮膚上,兩耳豎立;生后10~11 d鼠毛大致長齊;生后13~14 d雙眼睜開,活動自如,反應敏捷。缺氧缺血造模后新生大鼠出現呼吸窘迫,四處翻滾,可見口周、眼周、四肢發紺、身體顫動、翻身困難、夾尾左旋,行為障礙在3~4 h 消失,生后13~14 d右眼睜開,左眼閉合;與模型組比較,川芎嗪組部分新生大鼠在生后13~14 d雙眼睜開,部分右眼睜開,活動自如。3組新生大鼠一般生長情況無明顯差異。
在總體趨勢上,各組新生大鼠體重都以不同的速度增長,且從造模后第2天起,模型組與川芎嗪組新生大鼠體重均低于假手術組,但3組新生大鼠體重術后不同時間點比較差異無統計學意義(P>0.05)。見圖1。
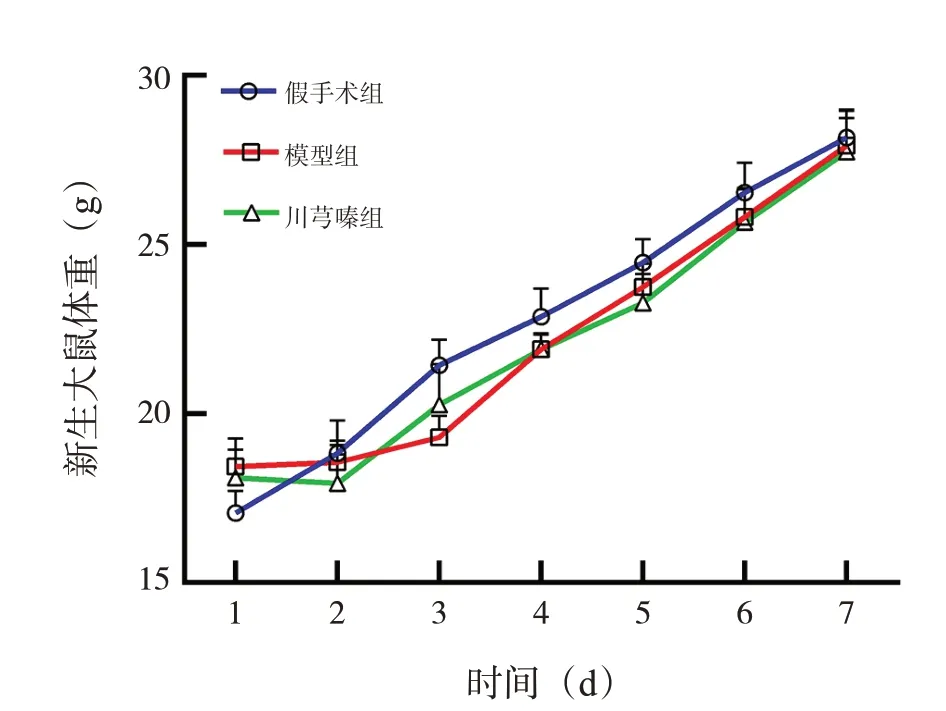
圖1 各組新生大鼠在術后7 d的體重變化情況(n=8)
2.2 各組新生大鼠腦組織形態學的改變
HE 染色及尼氏染色結果顯示,假手術組新生大鼠海馬與皮質中神經元細胞數量豐富,排列整齊,核居正中且圓,核仁清晰,尼氏小體數量豐富。模型組新生大鼠神經元細胞輪廓模糊,細胞間隙增大,數量減少,排列疏松紊亂,胞質空泡化,細胞核固縮,尼氏小體數量減少。川芎嗪組神經元細胞增多,排列整齊,核仁清晰,尼氏小體數量增多。見圖2。
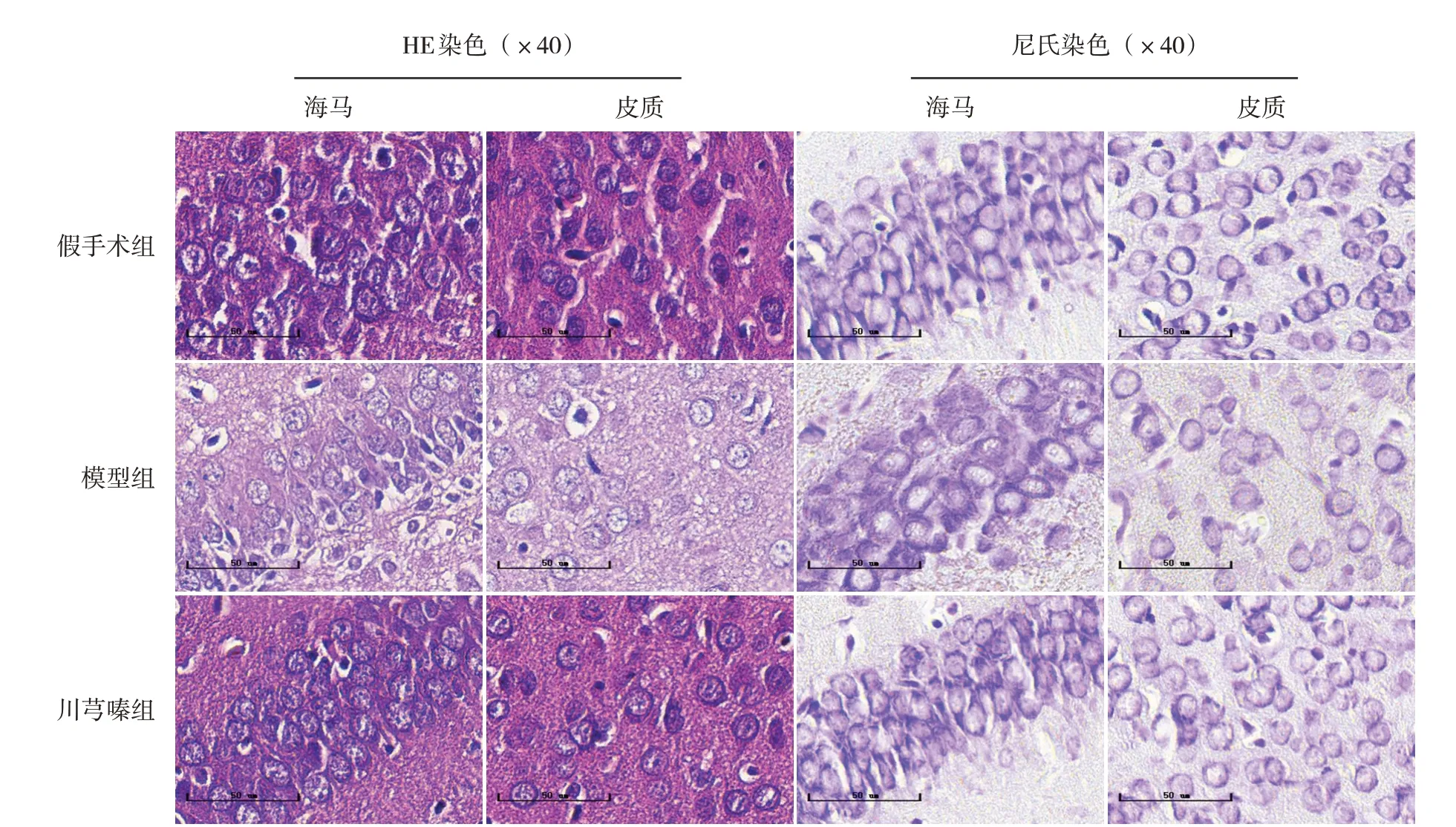
圖2 川芎嗪對HIE新生大鼠腦組織形態學的影響 假手術組腦組織中神經元細胞數量豐富,排列整齊、緊密;模型組腦組織中神經元細胞數量減少,排列疏松,細胞核固縮,胞質空泡化,尼氏小體減少;川芎嗪組神經元細胞數量增多,排列整齊,核仁清晰,尼氏小體數量增多。
2.3 川芎嗪對HIE 新生大鼠腦組織海馬區及皮質區中PINK1、Parkin表達的影響
與假手術組比較,模型組新生大鼠腦組織海馬區及皮質區神經元細胞減少,胞質內均可見PINK1、Parkin陽性表達增多(P<0.05);與模型組比較,川芎嗪組新生大鼠海馬區及皮質區神經元細胞數量增加,PINK1、Parkin 陽性表達減少(P<0.05)。見表1和圖3。
表1 各組新生大鼠腦組織海馬區及皮質區中PINK1、Parkin陽性表達比較 (± s,IOD/Area,n=3)
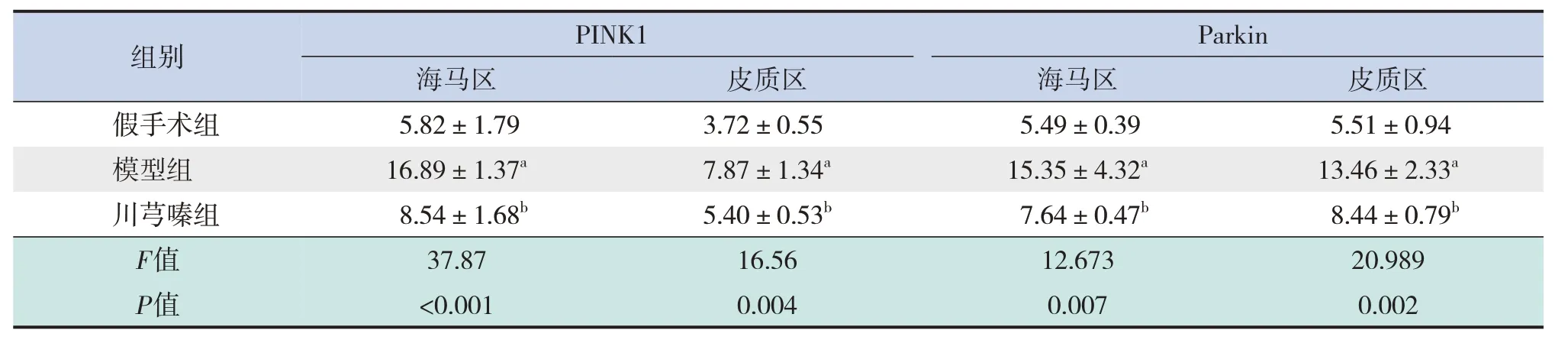
表1 各組新生大鼠腦組織海馬區及皮質區中PINK1、Parkin陽性表達比較 (± s,IOD/Area,n=3)
注:a示與假手術組比較,P<0.05;b示與模型組比較,P<0.05。[PINK1]PTEN誘導假定激酶1。
?
2.4 川芎嗪對HIE新生大鼠神經元凋亡的影響
與假手術組比較,模型組神經元凋亡率升高;與模型組比較,川芎嗪組神經元凋亡率降低(P<0.05)。見圖4~5。
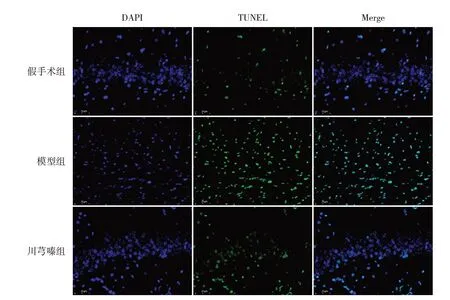
圖4 川芎嗪對HIE新生大鼠神經元凋亡的影響(TUNEL染色,×40,n=3) 綠色為凋亡細胞,藍色為細胞核。假手術組中存在少量凋亡細胞,模型組與川芎嗪組中凋亡細胞數量明顯增加,但川芎嗪組凋亡細胞數量明顯少于模型組。
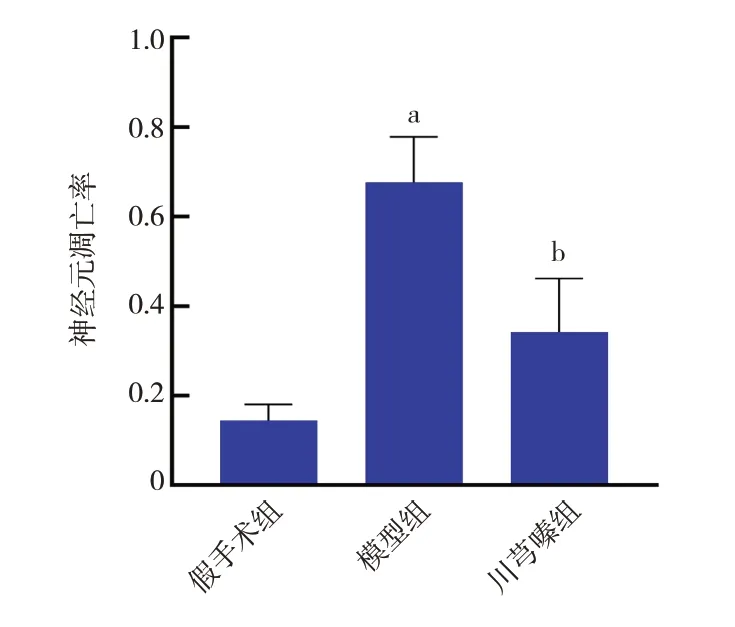
圖5 各組新生大鼠神經元凋亡率比較 a示與假手術組比較,P<0.05;b示與模型組比較,P<0.05。
2.5 川芎嗪對HIE 新生大鼠腦組織中PINK1/Parkin通路蛋白及自噬相關蛋白表達水平的影響
免疫印跡法檢測結果顯示,與假手術組比較,模型組PINK1、Parkin、Beclin1、LC3 蛋白表達明顯升高(P<0.05); P62 蛋白表達明顯下降(P<0.05)。與模型組比較,川芎嗪組PINK1、Parkin、Beclin1、LC3 蛋白表達下降(P<0.05);P62蛋白表達明顯升高(P<0.05)。見表2和圖6。
表2 各組新生大鼠海馬組織中PINK1/Parkin通路蛋白及自噬相關蛋白相對表達水平比較 (± s,n=5)
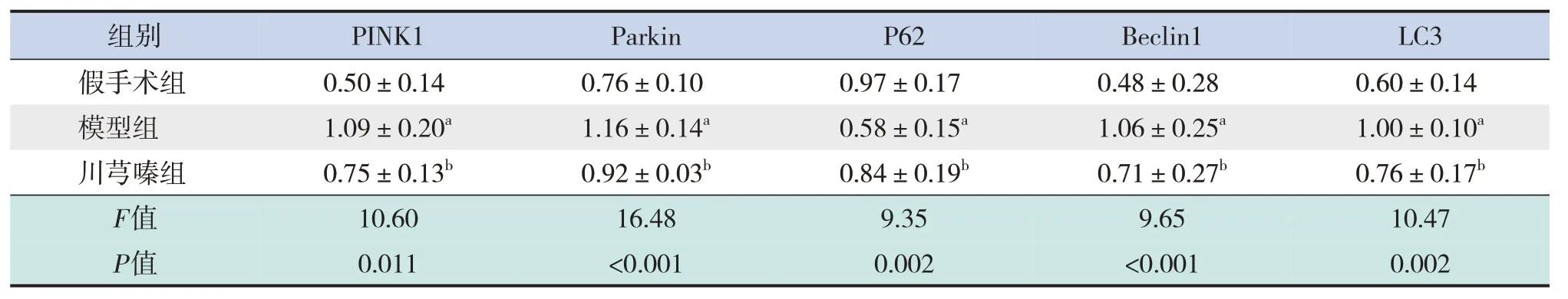
表2 各組新生大鼠海馬組織中PINK1/Parkin通路蛋白及自噬相關蛋白相對表達水平比較 (± s,n=5)
注:a示與假手術組比較,P<0.05;b示與模型組比較,P<0.05。[PINK1]PTEN誘導假定激酶1;[P62]泛素結合蛋白;[Beclin1]自噬特異性基因;[LC3]微管相關蛋白1輕鏈3。
?
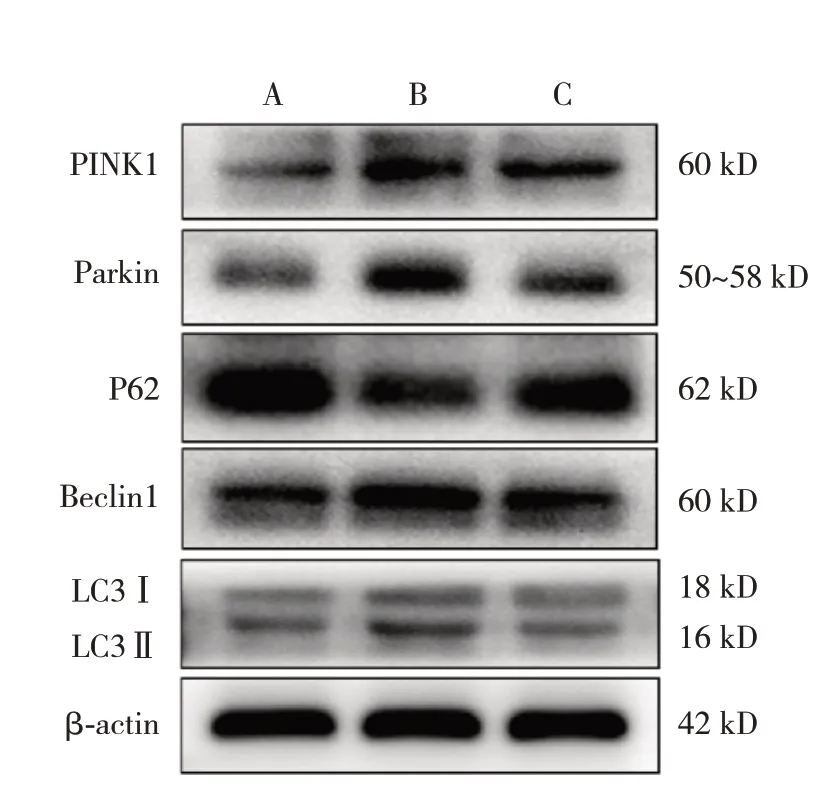
圖6 各組新生大鼠海馬組織中PINK1/Parkin 通路蛋白及自噬相關蛋白表達條帶圖 A:假手術組;B:模型組;C:川芎嗪組。
3 討論
HIE是缺氧缺血性腦損傷導致的急性腦功能紊亂,每1 000 名活產嬰兒中,約有1.5 例發生HIE[7]。目前主要治療方式是亞低溫治療。人體體溫每降低1℃,大腦代謝將會降低約5%。在中度至重度HIE 的足月兒中,在缺氧缺血事件后6 h 內開始治療,全身降溫(33.5±0.5)℃,持續48~72 h,可顯著提高存活率并減少殘疾,但在超過了6 h 后進行亞低溫治療則效果較差[8-10]。目前在資源有限的環境中,并且進一步受到起始治療窗狹窄的限制,亞低溫治療仍是一種昂貴且難以實現的治療方式。因此,鑒于亞低溫治療的局限性,尋找一種適用性更強的療法是全球共同面對的問題。
在新生兒發生缺氧缺血事件時,大腦神經元即可出現原發性細胞損傷。導致新生兒神經細胞損傷的具體機制并不十分明確,但線粒體功能障礙是導致細胞功能障礙的關鍵因素,神經元高度活躍的代謝決定了它對線粒體的穩定的絕對依賴[11]。在缺血損傷后,特別是在二次衰竭受損的神經元中,重建線粒體動力學,通過線粒體自噬去除受損線粒體,從而補充新的線粒體,是功能恢復、臨床癥狀緩解的關鍵一步[12]。一旦缺氧缺血事件發生后,線粒體功能受損,為了維護細胞內環境穩態,線粒體發出一種“吃我”的信號來降解受損細胞器,這一過程稱線粒體自噬。線粒體自噬是維持細胞內環境穩態的重要機制[13]。在神經細胞中,損傷的線粒體若沒有及時被清除,將會誘導細胞色素C 的釋放,進而引發細胞凋亡;但自噬被過度激活就會導致重要細胞器甚至細胞核被吞噬降解,引起細胞自噬性死亡。故自噬程度對細胞是否存活起著至關重要的作用。在嚴重缺氧缺血環境下,過度激活的線粒體自噬導致了神經元的死亡。本實驗發現,各組新生大鼠一般生長情況無明顯差異,但模型組新生大鼠線粒體自噬被激活,神經元凋亡增加。黃陽等[14]的研究顯示,過度激活的線粒體自噬可損傷缺氧缺血小鼠腦組織,通過敲除PINK1基因抑制線粒體自噬后,可對10 日齡缺氧缺血性腦損傷小鼠產生保護作用。
PINK1是一種絲氨酸激酶,Parkin是一種E3泛素連接酶,PINK1 在Parkin 上游發揮作用。PINK1可以靶向受損線粒體,從而啟動線粒體自噬功能[15]。在正常情況下,PINK1 從線粒體外膜移位至線粒體內膜上,并且快速被線粒體內膜蛋白酶PARL 切割、降解。當線粒體受到損傷時,PINK1由外膜移至內膜的通道受阻,然后在線粒體外膜上形成二聚體從而避免被切割,進而完成超激活[16]。超激活后的PINK1 在線粒體外膜上募集并激活大量的E3 泛素連接酶Parkin,將待降解的貨物打上泛素化標簽。本研究結果顯示,模型組新生大鼠腦組織海馬及皮質區中PINK1、Parkin 的陽性表達增加,神經元數量減少,并出現核固縮、尼氏小體減少、細胞凋亡增加等病理改變,提示在腦組織發生缺氧缺血后,激活了PINK1/Parkin通路導致腦組織出現病理損傷,而川芎嗪組抑制了該通路的激活,減輕腦組織病理損傷。提示川芎嗪可通過抑制PINK1/Parkin通路的激活減輕腦組織損傷。
LC3對隔離膜的生長和自噬貨物的識別至關重要,為了發揮其作用,新合成的LC3經過半胱氨酸蛋白酶ATG4 在羧基末端甘氨酸120 位點裂解形成LC3-Ⅰ,通過泛素樣系統使LC3-Ⅰ與磷脂酰乙醇胺(PE)偶聯形成LC3-Ⅱ,后者錨定在自噬小體膜上[17]。Beclin1 也是自噬的核心蛋白之一,Beclin1 的表達可影響缺血誘導的自噬激活,它調控自噬體的合成和自噬體的成熟。眾所周知,P62是自噬的效應因子,也是自噬底物,P62蛋白通過其LC3 相互作用區域(LIR 結構域)與LC3 相互作用附著在自噬體上,從而通過其泛素結構域(UBA結構域)將附著在其上的泛素化物質運輸到溶酶體并降解[18]。以上三者都是自噬順利完成不可或缺的組成部分。本實驗結果顯示模型組中Beclin1、LC3 表達增加,P62 表達下降,表明自噬處于增強狀態,造成了神經元的凋亡增加;給予川芎嗪干預后,Beclin1、LC3 表達下降,P62 表達增加,過度激活的自噬被抑制,神經元凋亡減少,腦組織病理損傷減輕。從而推斷川芎嗪對腦神經具有保護作用,且川芎嗪可通過抑制自噬發揮神經保護作用。上述推斷與Guan等[19]的研究結果一致。
綜上所述,川芎嗪可改善HIE新生大鼠腦組織病理損傷,抑制神經元凋亡,其機制可能與川芎嗪抑制PINK1/Parkin 通路從而抑制線粒體自噬相關。

