PRC1在肝內膽管細胞癌中的表達與作用機制研究
戴龍飛
(山東第一醫科大學附屬省立醫院,山東 濟南 250000)
膽管癌是僅次于肝細胞性肝癌的第二常見肝臟惡性腫瘤,過去幾十年,其發病率不斷上升[1]。大多數膽管癌患者早期無顯著的臨床癥狀,被發現時已屬于晚期,失去了手術機會[2]。因此,探究膽管細胞癌的生物學特征,尋找新的預警分子,提高膽管癌患者的檢出率尤為重要。細胞分裂失敗導致非整倍體可能是導致腫瘤發展的一個重要因素。作為細胞分裂的重要調節因子,胞質分裂蛋白調節因子1(protein regulator of cytokinesis 1,PRC1)調節反平行微管交聯,促進微管結構的形成,支持細胞形態和調節胞質分裂[3]。PRC1的表達失調促進了染色體的不穩定,在腫瘤的發生、發展中起重要作用[4]。目前,已有多項研究報道PRC1在腫瘤中表達升高,如肝癌[3]、胃癌[5]、結腸癌[6]、前列腺癌[7]和口腔鱗狀細胞癌[8]等,且與患者的預后相關。然而,PRC1在腫瘤發生、發展中的分子機制,尤其是在膽管細胞癌中仍然知之甚少。在本研究中,首先探究了PRC1在正常膽管細胞與肝內膽管細胞癌中的表達情況,進一步研究了PRC1在肝內膽管細胞癌中對其生物學功能的影響,并探討其可能的分子機制。
1 材料與方法
1.1 細胞培養和轉染 ICC細胞系(CCLP-1)來自衛生部多器官聯合移植重點實驗室的饋贈,并在含10%胎牛血清(Gibco,USA)和青霉素/鏈霉素的1640完全培養基中培養。小干擾RNA的轉染是將細胞接種在生長至40%的6孔組織培養板上。第2天,使用Lipofectamine 2000試劑(Invitrogen)根據制造商的說明書用靶向人PRC1或對照 siRNA(OriGene,USA)的100 nmol/L siRNA轉染細胞。對于PRC1的siRNA 的靶編碼序列為5'AGCGCUGCAAUUAGAAGUGGAUCGG 3'和5'CCGAUCCACUUCUAAUUGCAGCGCU 3'。所有患者均知情同意,患者均簽署知情同意書,本研究已獲得我院倫理委員會的批準。
1.2 蛋白質印跡分析 培養細胞后,將其裂解并超聲處理以獲得可溶性蛋白裂解物。蛋白質濃度采用Bradford法(Bio-Rad)測定。將等量的蛋白加入到10% NuPAGE Bis-Tris凝膠(Invitrogen)上并進行電泳。然后,將裂解物轉移到PVDF膜上(根據目標蛋白的分子量不同,轉膜時間60~90 min)。用5%脫脂牛奶封閉細胞膜后,將其與相關一抗在4 ℃下孵育過夜。用含有0.05%TWEEN-20的Tris 緩沖鹽水洗滌膜3次,每次洗滌10 min,用 SuperSignal West Pico 化學發光底物(Pierce)檢測信號。使用 Wayne Rasband(National Institutes of Health,Bethesda,MD,USA)的 ImageJ 1.44軟件對波段信號進行量化。使用 GAPDH 作為加載對照。
1.3 免疫組化 將ICC患者的石蠟包埋組織標本切成4 μm厚的切片。切片在二甲苯中脫石蠟,并在一系列分級酒精稀釋液中再水化。所有切片均用微波爐加熱進行抗原修復。然后將切片與3% H2O2孵育10 min,10%正常山羊血清在室溫下孵育15 min,以阻斷內源性過氧化物酶和非特異性抗原。使用以下一抗在4 ℃下對組織切片進行免疫染色:抗PRC1抗體(H70)(1∶50,santa cruz)。用 PBS沖洗3次后,將切片與辣根過氧化物酶標記的第二抗體在室溫下孵育30 min。最后用3,3-二氨基聯苯胺(DAB)觀察顏色的發展,然后用蘇木精復染切片。同時,研究小組的兩位獨立研究者使用 ImagePro Plus 6.0軟件評估免疫反應密度,且對病理數據不知情。石蠟切片半定量評分如下:0級,0%免疫反應細胞;1級,≤10%免疫反應細胞;2級,>10%~50%免疫反應細胞;3級,≥50免疫反應細胞。為了統計學的目的,0級和1級的病例被分類為低表達,而2級和3級的病例被分類為高表達。
1.4 細胞增殖能力測定 對于增殖測定,首先將ICC細胞以1 000個細胞/孔接種于96孔板中,通過細胞計數試劑盒(CCK-8,Dojindo)來測定細胞活力和生長,根據制造商的說明書在450 nm處讀取吸光度。EdU細胞增殖檢測根據試劑商說明書來操作(銳博生物),并在熒光顯微鏡下測定。
1.5 Transwell遷移和侵襲實驗 根據制造商的說明,在 BD Falcon 24孔插入系統(BD Biosciences,San Jose,CA)中進行遷移和侵入測定。對于遷移測定,將無血清培養基中的細胞接種在上腔中,并且沒有包被膜。對于侵襲測定,用35 μL含有基質膠(BD Biosciences,USA)和 RPMI 1640的溶液以1∶7的比例預涂覆過濾器2 h。2個實驗均將5×104個ICC細胞接種于上室,下室加入含10% FBS 的培養基。細胞培養24 h(遷移試驗)和48 h(侵襲試驗)。非遷移性或非侵襲性細胞從過濾器上表面移除。用Wright-Giemsa染色試劑盒(南京建成生物工程研究所,中國)對膜下表面的細胞進行染色。在光學顯微鏡下計數細胞數目。每個實驗至少重復3次。
1.6 細胞凋亡檢測 細胞凋亡是用Annexin V來測定的。細胞死亡的百分比計算為總細胞群中Annexin V陽性/碘化丙啶(PI)陰性細胞(經歷細胞凋亡的早期階段)和Annexin V 陽性/碘化丙啶陽性(經歷細胞凋亡的晚期階段)的百分比的總和。細胞在6孔板上培養24 h后,加入順鉑1.5 μg/mL來誘導細胞凋亡,用Annexin V/PI流式細胞術檢測細胞凋亡。
1.7 統計學分析 采用SPSS 25.0軟件(SPSS)進行統計學分析。兩組之間的差異采用t檢驗進行檢驗。P<0.05提示差異有統計學意義。
2 結果
2.1 PRC1在人ICC組織中表達升高 為探討PRC1在ICC中的表達,研究通過免疫組織化學測量了30對ICC和非癌組織中的PRC1表達,結果顯示與相鄰膽管組織中的表達相比,ICC腫瘤中的PRC1表達上調(圖1)。與鄰近組織相比,共有73.3%(22/30)的腫瘤組織顯示PRC1呈過表達。

圖1 PRC1在肝內膽管細胞癌組織中表達升高。免疫組織化學染色(IHC)檢測30例肝內膽管細胞癌和癌旁組織中PRC1的表達(紅色箭頭指向正常膽管)
2.2 敲低PRC1后抑制ICC細胞的增殖 為了進一步探究PRC1在ICC細胞中的生物學功能,本研究用小干擾RNA敲低了PRC1的表達,而Westernblot證實本研究敲低PRC1成功(圖2A)。接下來用CCK-8法檢測了細胞的增殖情況,結果顯示,敲低PRC1后,會抑制CCLP-1細胞的增殖(圖2B)。通過EdU檢測試劑盒進一步驗證PRC1對增殖的影響,結果同樣顯示,敲低PRC1后,會抑制CCLP-1細胞的增殖(圖2C)。

圖2 敲低PRC1會抑制肝內膽管細胞癌的表達
2.3 敲低PRC1后抑制ICC細胞的遷移和侵襲 轉移也是腫瘤進展的重要因素,遠處轉移可嚴重影響患者的預后。因此,本文研究了敲低PRC1對ICC細胞侵襲和遷移能力的影響。Transwell測定的結果顯示敲低PRC1后抑制了CCLP-1細胞的侵襲和遷移能力(二者均P<0.05,圖3)。
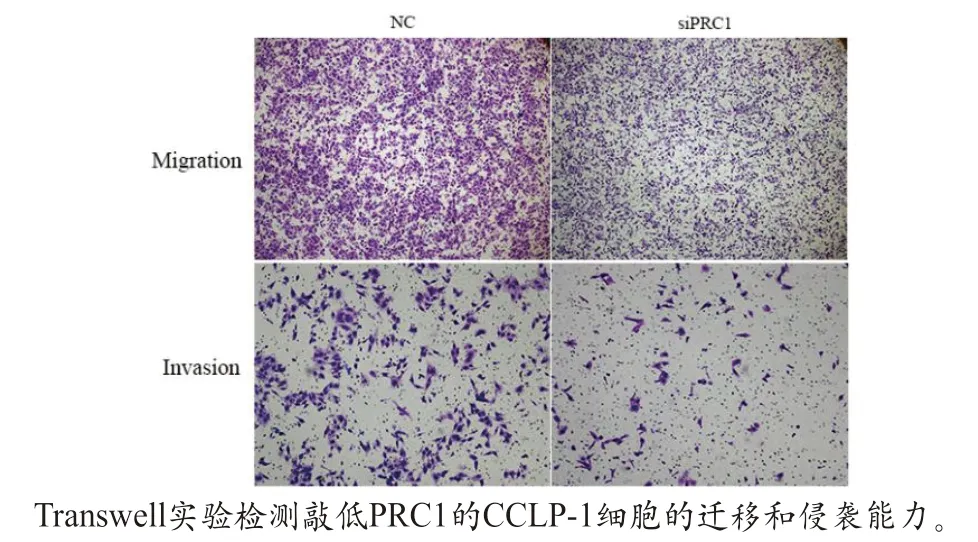
圖3 敲低PRC1會抑制肝內膽管細胞癌的遷移和侵襲
2.4 敲低PRC1后ICC細胞的凋亡增加及凋亡相關蛋白表達改變情況 為了進一步探究PRC1影響增殖的原因,本研究使用Annexin V-FITC/PI細胞凋亡檢測試劑盒通過流式細胞儀檢測了CCLP-1的凋亡情況。結果顯示,敲低PRC1后,ICC細胞的凋亡增加(圖4A)。而對凋亡相關蛋白的測定發現,敲低PRC1后,活化的cle-caspase8、cle-caspase9與BAX表達升高(圖4B)。

圖4 敲低PRC1會促進肝內膽管細胞癌的凋亡
3 討 論
肝內膽管細胞癌(ICC)是肝臟第二原發腫瘤,且近年來發病率逐年升高,其與多種膽道或肝臟疾病有關,如原發性硬化性膽管炎、卡羅里病、肝內膽管結石、乙型肝炎病毒(HBV)和丙型肝炎病毒(HCV)感染、肝吸蟲感染、炎癥性腸病、暴露于有機溶劑等。此外,肥胖、非酒精性脂肪肝和非酒精性脂肪性肝炎可能是導致其發病率不斷上升的原因[9]。ICC患者的臨床癥狀往往是非特異性的,大部分患者在發現時已處于腫瘤晚期,僅有約20%的ICC患者尚有手術的可能,并且術后5年的生存率僅為30%[10]。因此,尋找新的腫瘤標志物,提高ICC患者的檢出率,探究肝內膽管細胞癌的作用機制,制定有效的診斷和治療策略尤為重要。
眾所周知,適當的胞質分裂是基因組穩定所必需的,而胞質分裂失敗可能導致染色體的非整倍體出現而促進癌癥發展[11]。PRC1對胞質分裂和正常細胞分裂至關重要。PRC1是細胞裂解所必需的有絲分裂紡錘體相關微管結合蛋白,PRC1失調導致胞質分裂缺陷,從而促進染色體不穩定性,進而促進腫瘤異質性和癌癥進化[12]。PRC1在多種腫瘤中被證實存在表達異常,并且與預后相關。最新的研究發現,PRC1的表達異常與肝細胞肝癌的臨床分期相關,PRC1的表達升高預示著患者的預后更差[13]。而本文研究發現,在肝內膽管細胞癌中,PRC1表達較癌旁的正常組織升高,提示其可能在ICC發生、發展中發揮作用。因此本研究推測,進一步探討PRC1在ICC發生、發展中的作用及具體機制有重要的臨床意義。
Xu等[5]發現,沉默PRC1可抑制結腸癌細胞的活力,并促進結腸癌細胞凋亡。Liu等[14]研究表明,降低PRC1表達可抑制肝癌細胞增殖,并通過p53通路增強肝癌細胞對紫杉醇的敏感性。Zhang等[6]研究發現,PRC1在胃癌組織中異常表達,并與胃癌患者的預后相關。敲低PRC1促進細胞周期阻滯和凋亡,阻礙胃癌細胞的遷移和侵襲。本研究結果發現,敲低PRC1的表達后,會抑制ICC細胞的增殖、遷移與侵襲,并增加細胞的凋亡。為進一步探究其對細胞凋亡的影響,本文又研究了凋亡相關蛋白的表達。
細胞凋亡是第一個被發現的程序性細胞死亡過程,在腫瘤的化學治療中已被廣泛研究[15]。細胞凋亡是一種程序性的細胞死亡,在基因水平上受到精細調控,細胞凋亡的機制是復雜的,涉及許多信號通路。細胞凋亡可以通過caspase介導的外在途徑或內在途徑觸發。這兩種途徑匯聚在一起激活效應因子凋亡caspases,最終導致細胞形態和生化發生改變[16]本研究發現,敲低PRC1后,會使凋亡啟動因子即活化的cle-caspase8和cle-caspase9升高,同時促凋亡蛋白 BAX的表達也升高。這些研究發現,PRC1參與了ICC的凋亡過程,從而影響了腫瘤細胞的活性。
總之,本研究表明PRC1在肝內膽管細胞癌中表達升高,并且PRC1能夠促進肝內膽管細胞癌的增殖,促進ICC的遷移和侵襲。同時,敲低PRC1后會促進ICC的凋亡。因此,本研究推測PRC1通過抑制ICC細胞的凋亡進而影響腫瘤細胞的活性。因此,PRC1的表達可能為提高ICC患者的檢出率提供一個新的可能。

