弗里德賴希共濟失調YG8R轉基因小鼠的運動行為學及病理變化比較
張曉靜, 林培彬, 歐文倩
弗里德賴希共濟失調(friedreich ataxia,FRDA)是由編碼Frataxin (FXN)蛋白的基因出現隱性突變引起的神經退行性疾病[1,2],為最常見的遺傳性共濟失調。FRDA的病理改變首先發生在背根神經節(dorsal root ganglia,DRG)伴隨感覺神經元丟失,其次是脊髓、后柱、錐體和脊髓小腦束軸索變性和神經元丟失[3]。Frataxin基因第一個內含子中三聯體GAA擴增導致Frataxin蛋白水平降低[4,5]。Frataxin是一種參與鐵硫簇和血紅素生物合成的線粒體蛋白[6]。研究表明,Frataxin表達減少會導致DRG和小腦齒狀核神經元發生氧化應激、線粒體鐵積累和相應的細胞死亡[7]。迄今為止,FRDA尚無有效治療方法,很重要的原因就是缺乏合適的FRDA動物模型且其發病機制不清楚。根據GAA三核苷酸序列重復數目不同,目前主要有3種轉基因FRDA小鼠模型,包括YG8R、YG22R和YG8sR[8]。研究發現,3種轉基因小鼠運動協調性都會逐漸下降,但YG8R小鼠的損傷程度最為顯著[9]。然而,先前的研究,一方面由于FRDA轉基因小鼠需長時間飼養,導致對模型小鼠FXN的神經表型分析不夠徹底,包括從未測試FRDA小鼠的步態異常變化;另一方面對FRDA小鼠不同時間不同行為學差異并不清楚。因此,本研究將以YG8R小鼠為研究對象,進一步分析不同時間YG8R小鼠的運動行為學及病理差異,為進一步明確YG8R小鼠的給藥時間及藥物篩選奠定基礎。
1 材料與方法
1.1 試劑、耗材和實驗動物
TRIzol試劑、SYBR Green I核酸凝膠染料、Random primer、High Capacity RNA-to-cDNA反轉錄試劑盒購自賽默飛公司;多聚甲醛購自廣州化學試劑廠;異氟烷購自深圳瑞沃德生命科技有限公司;PBS粉末、乙醇、氯仿、異丙醇、Nuclease-free H2O購自Sigma公司;引物由上海捷瑞生物工程有限公司合成;Anti-NeuN抗體購自abcam公司;過氧化物酶HRP標記山羊抗兔IgG抗體購自CST公司;免疫組化試劑購自上海碧云天生物公司。
B6.Cg-Fxntm1MknTg YG8Pook/J (Strain #:012253)轉基因小鼠購自Jackson Laboratories公司;所有小鼠均按照暨南大學動物飼養管理規程飼養,房間溫度(23±2) ℃,濕度為50%~70%,房間12 h光照/12 h黑暗交替,小鼠自由進食和飲水,所有小鼠在實驗前至少適應5 d,實驗分為兩組,野生對照組(WT組)和YG8R組,每組均含雌性小鼠8只,雄性小鼠8只。
1.2 實驗方法
1.2.1 體重記錄 利用大小鼠體重稱量天平(上海玉研科學儀器有限公司),每月稱量記錄一次各組小鼠體重(g)。
1.2.2 加速轉棒實驗 該實驗用于評估小鼠的協調平衡能力。將小鼠放在旋轉棒(安徽正華生物儀器設備有限公司)上,旋轉速度從4 r/min逐漸增加到40 r/min,記錄4 min內每只小鼠從棒上掉落的時間。重復測量3次,每次間隔10 min,取3次結果的平均值作為該小鼠的在棒時間,每2個月檢測一次。
1.2.3 曠場實驗 該實驗用于評估小鼠的自發行為活動量及運動軌跡。將小鼠置于礦場實驗箱(安徽正華生物儀器設備有限公司)中,啟動自主攝影系統記錄小鼠在箱內的活動,每只小鼠連續記錄5 min,軟件分析小鼠運動總距離。重復測量3次,每次實驗間隔10 min,取3次結果的平均值作為評估值,每2個月檢測一次。
1.2.4 四肢抓力實驗 該實驗用于評估小鼠的四肢肌肉力量。將小鼠置于抓力板(安徽正華生物儀器設備有限公司)中央臺,輕輕拉動小鼠尾部,記錄小鼠抓力最大值。重復3次,每次間隔5 min,取3次結果的平均值作為評估值,每2個月檢測一次。
1.2.5 步態檢測 MSI DigiGait動物步態成像分析系統(MOUSE SPECIFICS公司)是一個完整的定量評估鼠類模型中動物腳步和步態的工具。將小鼠放于傳送帶上,儀器速度設置為20 r/min,記錄5 s,分析小鼠的步態長度、步寬、觸地和擺動時間。
1.2.6 免疫組化染色 實驗終點,切取脊髓組織,4%多聚甲醛固定后,利用全自動脫水機(德國徠卡公司)進行脫水,石蠟包埋后,切片,厚度5 μm,二甲苯脫蠟復水后,經檸檬酸緩沖液抗原修復后,5%BSA封閉,加入一抗稀釋液稀釋的抗Neuro N抗體(1∶1000稀釋),4 ℃冰箱放置過夜,第二天PBS清洗后加入二抗,最后將組織片放入蘇木素染液中,染色2 min,PBS清洗,經酒精脫水和二甲苯透明后,加入中性樹膠封片,干燥后,利用熒光顯微鏡分別在100X和200X拍照。
1.2.7 實時熒光定量PCR 利用Trizol試劑從小鼠DRG和小腦中提取總的RNA,根據High Capacity RNA-to-cDNA反轉錄試劑盒說明書制備cDNA。使用Applied Biosystems實時熒光定量PCR儀器(賽默飛公司)和SYBR Green探針檢測人類轉基因FXN mRNA表達水平。FXN正向引物:5’-TTGAAGACCTTGCAGACAAG-3’和 FXN反向引物:5’-AGCCAGATTTGCTTGTTTGG-3’,GAPDH正向引物:5’-ACCCAGAAGACTGTGGATGG-3’,GAPDH反向引物:5’-GGATGCAGGGATGATGTTCT-3’。以GAPDH為內參,采用2-ΔΔCt計算目的基因mRNA的相對表達量。
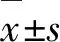
2 結 果
2.1 YG8R小鼠體重未發生顯著變化 每間隔1個月稱量一次小鼠體重,不同時間點兩組小鼠體重無顯著差異(見圖1)。
2.2 YG8R小鼠在棒時間顯著下降 每2個月測量一次小鼠的在棒時間(見圖2),從第4個月開始,與WT組相比,YG8R小鼠的在棒時間明顯下降(P<0.05)。

圖2 各組小鼠在棒時間比較。與WT組相比*P<0.05
2.3 YG8R小鼠運動距離顯著下降 每2個月測量一次小鼠的自主運動距離,對自主運動軌跡(見圖3A)進行統計分析(見圖3B),從第4個月開始,與WT組相比,YG8R小鼠的運動距離明顯下降(P<0.05)。

A:自主運動軌跡;B:運動總距離(% of WT)。與WT組相比*P<0.05和***P<0.001。
2.4 YG8R小鼠抓力顯著下降 每2個月測量一次小鼠的前肢抓力(見圖4)。從第4個月開始,與WT組相比,YG8R小鼠的抓力明顯下降(P<0.05)。

與WT組相比*P<0.05和****P<0.0001。
2.5 YG8R小鼠步態異常 在第6個月,檢測各組小鼠步態情況(見圖5)。與WT組相比,YG8R小鼠左后肢和右后肢步長距離顯著下降(P<0.05),YG8R小鼠兩前肢和兩后肢步寬顯著增加(P<0.01),右后肢的擺動時間顯著下降(P<0.01),左后肢及右后肢觸地時間顯著增加(P<0.05)。

與WT組相比*P<0.05,**P<0.01,***P<0.001和****P<0.0001。
2.6 YG8R小鼠脊髓神經元數量及脊髓中Frataxin mRNA水平下降 免疫組化檢測脊髓神經元損傷情況(見圖6A、圖6B)。YG8R小鼠脊髓中神經元數量顯著降低(P<0.01);利用qRT-PCR檢測FRDA小鼠GAA重復擴增對脊髓和DRG中FXN表達的影響(見圖6C),與WT組相比,YG8R小鼠脊髓和DRG中FXN mRNA水平均顯著降低(P<0.0001)。

與WT組相比**P<0.01和****P<0.0001。
3 討 論
目前臨床前研究主要使用具有不同重復次數GAA三聯體擴增的人類FXN轉基因小鼠,其中YG8R小鼠的損傷程度更為顯著。然而,現有研究缺乏對YG8R小鼠不同時間運動及病理改變的研究。嚙齒類動物在轉棒上停留的時間長度是衡量耐力、平衡協調、身體狀況和運動情況的評價指標,轉棒檢測對評價小腦功能障礙特別敏感[10]。開放場檢測是一種簡單的感覺運動測試,用于確定嚙齒動物中樞神經系統疾病模型的一般活動水平、總體運動活動和探索習慣[11]。
研究發現,從4~12個月,YG8R小鼠的體重顯著增加,在棒協調能力顯著降低,平均速度及運動總距離顯著降低,同時YG8R小鼠的抓力明顯下降[8]。這與我們的研究相一致,我們推測體重增加可能是YG8R小鼠運動不協調的重要原因之一;同時不同腦區Frataxin表達差異導致小鼠出現不同運動差異表型。一般來說,步態是由運動皮質、基底神經節、丘腦、中腦、髓質、腦橋、小腦和脊髓中央模式發生器之間的復雜通訊控制的[12,13]。步態異常與額葉皮質、基底節、海馬、小腦和感覺運動皮質的損傷特別相關[14]。足跡分析結果顯示,與B6和Y47R對照相比,FRDA小鼠的步態模式不均勻,步幅長度顯著降低[8]。
我們的研究發現,在第6個月,與WT小鼠相比,YG8R小鼠的左后肢和右后肢步長距離顯著下降,YG8R小鼠兩前肢和兩后肢步寬顯著增加,右后肢的擺動時間顯著下降,左后肢及右后肢觸地時間顯著增加。這將進一步提供一種新的實驗評價手段,能夠檢測FRDA小鼠中Frataxin水平降低的表型后果,使它們能夠接受新的治療策略。
綜上,考慮到可以進行的不同功能研究,我們建議將步態測試作為評估這些FRDA小鼠協調能力的有價值測試,其操作簡單,可提供良好的重現性和顯著的統計,通過評價小鼠步態異常為將來臨床針對性治療FRDA提供幫助。
研究報道發現,Frataxin表達減少使細胞內出現氧化應激、線粒體鐵積累,導致DRG和小腦齒狀核神經元細胞死亡,進而出現進行性共濟失調、肌肉無力和感覺障礙等癥狀[8,15~17]。與內源性小鼠水平相比,YG22R和YG8R FRDA小鼠表達的人類Frataxin水平相對降低。我們的研究同樣發現,在YG8R小鼠的脊髓中神經元數量顯著降低;與WT組小鼠相比,YG8R小鼠脊髓和DRG中Frataxin mRNA水平均明顯下降,這與相關研究報道相一致。因此,我們認為導致小鼠運動障礙的更重要原因是脊髓及DRG中Frataxin表達降低,導致線粒體功能障礙、氧化損傷和鐵積累,進一步導致脊髓和小腦的齒狀核神經元死亡。綜上,FRDA小鼠模型中已確定的運動功能缺陷可能是由于Frataxin水平降低,從而誘導了類似FRDA的運動障礙。
總之,本研究進一步明確了FRDA小鼠的運動和協調缺陷是由不穩定的GAA重復序列引起的,導致Frataxin水平降低,這為增加Frataxin療法帶來了新的希望。研究還進一步證實了YG8R小鼠作為基于GAA重復的理想FRDA小鼠模型,適用于研究多種不同的治療策略,其中包括可能使用鐵螯合劑和抗氧化劑,優先針對線粒體,以及旨在上調Frataxin表達的新型藥物。

