基于miRNA23/Nocth信號通路探討極低頻電磁場對缺血性腦卒中神經功能的修復作用
盧 燦, 于德洋, 王先文, 賈 萍
缺血性腦出血是最常見的腦出血類型,目前主要的治療方法包括介入及溶栓,雖然再灌注效果確切、但仍不可避免會遺留神經功能損害,致殘率較高[1]。因此,尋找有效策略促進缺血性腦卒中后神經功能恢復是相關研究的熱點。近些年,電磁場對人體健康的影響受到越來越多關注,有研究報道極低頻電磁場(extremely low frequency electromagnetic fields,ELF EMF)具有神經保護作用,能夠改善創傷性顱腦損傷大鼠[2]、海馬損傷大鼠[3]、學習記憶障礙大鼠[4]的神經功能,但ELF EMF在缺血性腦卒中發病過程中的神經保護作用及機制并不清楚。
微小RNA(microRNA,miRNA)是一類在轉錄后水平調節基因表達并發揮生物學作用的非編碼小分子RNA,其中miR-23是一種具有神經保護作用的miR,過表達miR-23對腦缺血再灌注損傷具有抑制作用[5];另有研究證實,miR-23對Notch1信號通路的激活具有促進作用[6]。本課題組前期實驗發現ELF EMF對miR-23的表達具有促進作用,提示ELF EMF可能通過miR-23發揮神經保護作用。基于此,本研究將在缺血性腦卒中大鼠中研究ELF EMF通過miR-23/Notch信號通路促進神經功能缺失恢復的作用及機制。
1 材料與方法
1.1 動物 SPF級雄性SD大鼠、8~10周齡、體質量160~200 g(上海菲諾克生物科技有限公司),生產許可:SCXK(滬)2018-0005。
1.2 試劑與儀器 2,3,5-氯化三苯基四氮唑(TTC,Sigma公司),細胞凋亡檢測試劑盒(TUNEL法,上海碧云天公司),miR提取、反轉錄及熒光定量PCR試劑盒(北京天根生化公司),Notch1、Jagged1、Hes1、β-actin一抗(Abcam公司)。正置顯微鏡(Nikon公司),熒光定量PCR儀(ABI公司),凝膠電泳系統及成像系統(上海天能公司)。
1.3 方 法
1.3.1 動物分組及干預 動物實驗分為兩部分,第一部分驗證ELF EMF改善缺血性腦卒中大鼠神經功能的作用;第二部分驗證miR-23/Notch通路在ELF EMF改善缺血性腦卒中大鼠神經功能中的作用。
在第一部分實驗中,實驗動物隨機分為假手術組、模型組、ELF EMF組,每組各16只。模型組、ELF EMF組參照Zea Longa[6]采用線栓法制備缺血性腦卒中模型,造模后24 h參照Zea Longa[7]評分進行神經功能評價,得分1~3分為造模成功;假手術組僅進行分離血管的假手術操作、但不阻塞血管。判斷造模成功后,ELF EMF組進行ELF EMF干預,將鼠籠放入電磁發射器,設置參數為頻率15 Hz、場強5G,每天一次、每次90 min。
在第二部分實驗中,實驗動物隨機分為miR-NC+假手術組、miR-NC+模型組、miR-NC+ELF EMF組、miR-23+ELF EMF組,每組各16只。miR-NC+模型組、miR-NC+ELF EMF組、miR-23+ELF EMF組參照Zea Longa采用線栓法制備缺血性腦卒中模型,miR-NC+假手術組進行假手術操作,參照Zea Longa評分判斷造模成功后,進行NC miR或miR-23抑制物的側腦室注射,而后miR-NC+ELF EMF組、miR-23+ELF EMF組進行ELF EMF干預,方法參照ELF EMF組。
1.3.2 神經功能缺失程度的評估 每組大鼠在干預后7 d、14 d時采用Zea Longa[6]評分評估神經功能缺失程度。
1.3.3 腦梗死體積的檢測 每組隨機選擇8只大鼠,處死后解剖完整腦組織,-20 ℃迅速冷凍15 min,而后進行冠狀位連續切片、連續切取5片、厚度2 mm,將切片在TTC溶液中避光染色25 min,染色后的切片在4%多聚甲醛中4 ℃固定24 h。最后拍照并錄入電腦,對每張切片的腦梗死面積進行測量,分別記為S1、S2、S3、S4、S5,按照公式:厚度×(S1+S2+S3+S4+S5)-厚度×(S1+S5)/2計算腦梗死體積。
1.3.4 細胞凋亡率的檢測 每組剩余的8只大鼠取缺血側皮質組織適量,4%多聚甲醛固定后制作病理切片,采用細胞凋亡檢測試劑盒進行TUNEL染色及DAPI染色,在顯微鏡下觀察染色情況并對陽性染色的細胞進行計數,TUNEL陽性細胞數/DAPI陽性細胞數即為細胞凋亡率。
1.3.5 miR-23表達水平的檢測 取缺血側皮質組織適量,采用miR提取試劑盒進行組織miR的提取,采用miR cDNA第一鏈合成試劑盒進行miR的反轉錄、得到cDNA,采用miR熒光定量PCR檢測試劑盒進行PCR反應,體系為:cDNA 2 μl、反應預混液10 μl、上游引物及下游引物(5 μmol/L)各0.6 μl、去離子水6.8 μl,程序為:95 ℃預變性3 min,95 ℃ 15 s、60 ℃ 34 s的程序反應40個循環。完成PCR反應后得到循環曲線及閾值,以U6為內參、計算miR-23的表達量。
1.3.6 Notch1、Jagged1、Hes1表達水平的檢測 取缺血側皮質組織適量,采用組織裂解液進行勻漿、提取蛋白,采用BCA法檢測蛋白含量后取30 μg蛋白進行蛋白電泳,分離不同分子量的蛋白后電轉移至NC膜,用5%脫脂牛奶進行NC膜室溫封閉、共1 h,用1∶1000稀釋的Notch1、Jagged1、Hes1一抗或1∶5000稀釋的β-actin一抗進行NC膜4 ℃孵育、過夜;次日,用1∶2000稀釋的二抗進行NC膜室溫孵育、共1 h,最后在凝膠成像系統中顯影,根據顯影得到蛋白條帶的灰度值、以β-actin為內參計算Notch1、Jagged1、Hes1的蛋白表達水平。
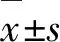
2 結 果
2.1 ELF EMF對缺血性腦卒中大鼠神經功能及腦梗死體積的影響 假手術組未出現神經功能缺失及腦梗死灶,模型組及ELF EMF組均出現神經功能缺失及腦梗死灶。與假手術組比較,模型組的Zea Longa評分7 d(2.49±0.45)、14 d(2.36±0.35)及腦梗死體積均明顯增加(P<0.05);與模型組比較,ELF EMF組的Zea Longa評分7 d(1.87±0.29)、14 d(1.12±0.1)及腦梗死體積均明顯降低(P<0.05)(見圖1)。

與假手術組比較*P<0.05;與模型組比較#P<0.05。
2.2 ELF EMF對缺血性腦卒中大鼠腦組織細胞凋亡的影響 與假手術組比較,模型組的腦組織細胞凋亡率明顯增加(P<0.05);與模型組比較,ELF EMF組的腦組織細胞凋亡率明顯降低(P<0.05)(見圖2)。

與假手術組比較*P<0.05;與模型組比較#P<0.05。
2.3 ELF EMF對缺血性腦卒中大鼠腦組織中miR-23表達的影響 與假手術組(1.00±0.19)比較,模型組腦組織中miR-23的表達水平為(0.39±0.08)明顯降低(P<0.05);與模型組比較,ELF EMF組腦組織中miR-23的表達水平為(0.89±0.13)明顯增加(P<0.05)。
2.4 ELF EMF對缺血性腦卒中大鼠腦組織中Notch通路的影響 與假手術組比較,模型組腦組織中Notch1、Jagged1、Hes1的表達水平明顯降低(P<0.05);與模型組比較,ELF EMF組腦組織中Notch1、Jagged1、Hes1的表達水平明顯增加(P<0.05)(見圖3、表1)。
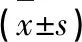
表1 3組大鼠腦組織中Notch1、Jagged1、Hes1表達水平的比較
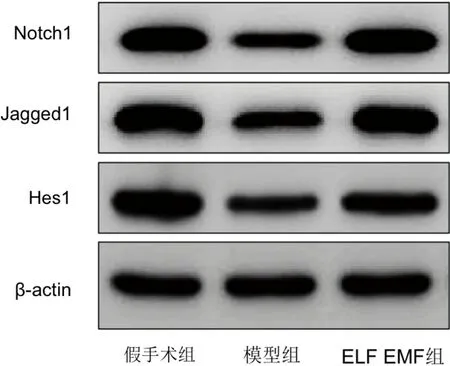
圖3 3組大鼠腦組織中Notch1、Jagged1、Hes1的電泳圖
2.5 局部注射腺病毒敲低miR-23的效果 與miR-NC+假手術組(1.00±0.20)比較,miR-NC+模型組腦組織中miR-23的表達水平(0.41±0.09)明顯降低(P<0.05);與miR-NC+模型組比較,miR-NC+ELF EMF組腦組織中miR-23的表達水平(0.92±0.14)明顯增加(P<0.05);與miR-NC+ELF EMF組比較,miR-23+ELF EMF組腦組織中miR-23的表達水平(0.32±0.08)明顯降低(P<0.05)(見表2)。
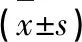
表2 3組大鼠腦組織中miR-23表達水平的比較
2.6 敲低miR-23對ELF EMF調控缺血性腦卒中大鼠神經功能及腦梗死體積的影響 與miR-NC+假手術組比較,miR-NC+模型組的Zea Longa評分及腦梗死體積均明顯增加(P<0.05);與miR-NC+模型組比較,miR-NC+ELF EMF組的Zea Longa評分及腦梗死體積均明顯降低(P<0.05);與miR-NC+ELF EMF組比較,miR-23+ELF EMF組的Zea Longa評分及腦梗死體積均明顯增加(P<0.05)(見圖4、表3)。
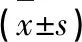
表3 4組大鼠Zea Longa評分的比較
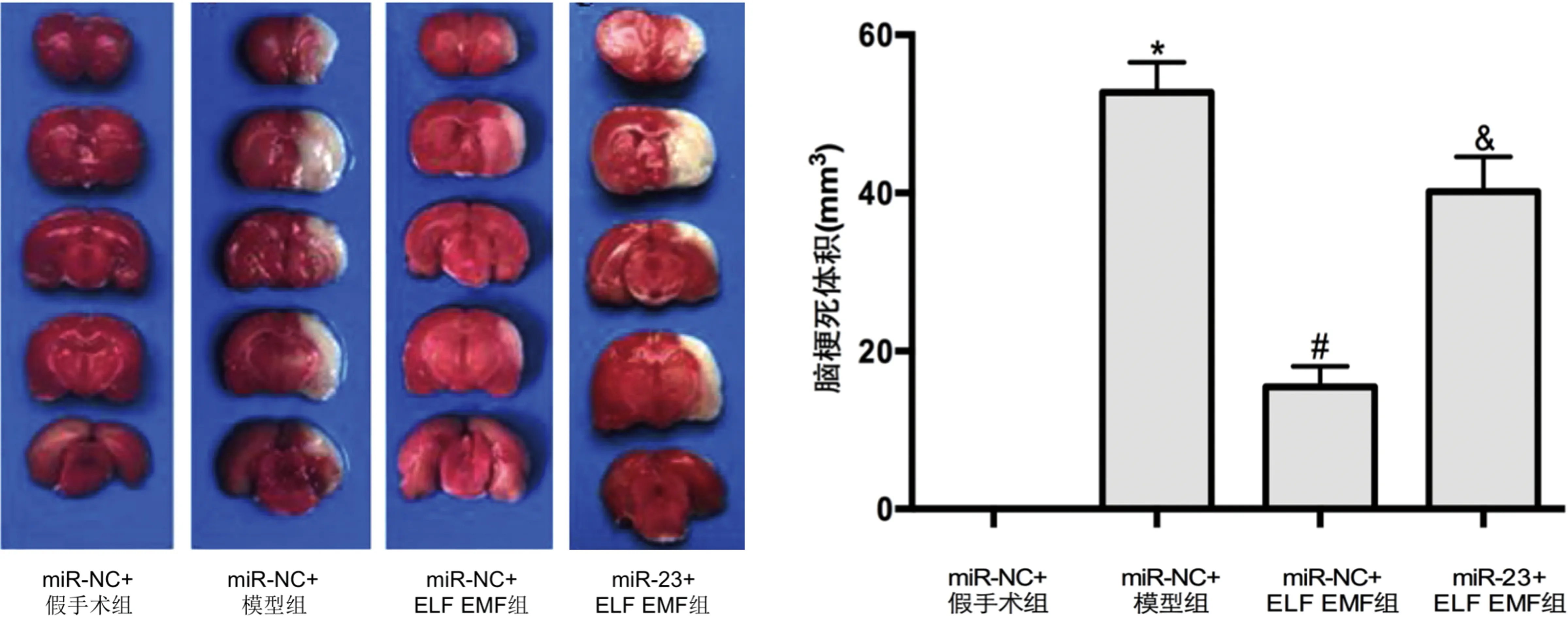
與miR-NC+假手術組比較*P<0.05;與miR-NC+模型組比較#P<0.05;與miR-NC+ELF EMF組比較&P<0.05。
2.7 敲低miR-23對ELF EMF調控缺血性腦卒中大鼠腦組織細胞凋亡的影響 與miR-NC+假手術組比較,miR-NC+模型組的腦組織細胞凋亡明顯增加(P<0.05);與miR-NC+模型組比較,miR-NC+ELF EMF組的腦組織細胞凋亡明顯降低(P<0.05);與miR-NC+ELF EMF組比較,miR-23+ELF EMF組的腦組織細胞凋亡明顯增加(P<0.05)(見圖5)。
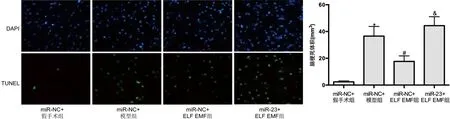
與miR-NC+假手術組比較*P<0.05;與miR-NC+模型組比較#P<0.05;與miR-NC+ELF EMF組比較&P<0.05。
2.8 敲低miR-23對ELF EMF調控缺血性腦卒中大鼠腦組織中Notch通路的影響 與miR-NC+假手術組比較,miR-NC+模型組腦組織中Notch1、Jagged1、Hes1的表達水平明顯降低(P<0.05);與miR-NC+模型組比較,miR-NC+ELF EMF組腦組織中Notch1、Jagged1、Hes1的表達水平明顯增加(P<0.05);與miR-NC+ELF EMF組比較,miR-23+ELF EMF組腦組織中Notch1、Jagged1、Hes1的表達水平明顯降低(P<0.05)(見圖6、表4)。
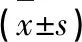
表4 4組大鼠腦組織中Notch1、Jagged1、Hes1表達水平的比較

圖6 4組大鼠腦組織中Notch1、Jagged1、Hes1的電泳圖
3 討 論
ELF EMF是近些年發現的具有神經保護作用的物理治療手段,機體內環境的頻率在15 Hz左右,通過ELF EMF給予一個頻率與內環境相近的外加電磁場有利于機體內環境形成諧振作用,使血管及組織的自律運動振幅增加并改善血管通透性,最終改善病灶局部的缺血缺氧、促進病灶修復[8,9]。已有研究證實ELF EMF對創傷性顱腦損傷大鼠[2]、海馬損傷大鼠[3]、學習記憶障礙大鼠[4]的神經功能具有改善作用,本研究在已有研究的基礎上將ELF EMF用于缺血性腦卒中的治療,通過線栓法建立缺血性腦卒中模型后進行ELF EMF干預,結果發現缺血性腦卒中大鼠的神經功能明顯改善、腦梗死體積明顯縮小,表明ELF EMF能夠在缺血性腦卒中發生后起到神經保護作用。
在證明ELF EMF的神經保護作用后,本研究深入探究了與神經保護作用相關的分子機制。miR在中樞神經系統中的作用受到越來越多關注,多種miR在缺血性腦組織的發病過程中起到保護作用,相應的外周血miR表達也能作用缺血性腦卒中的病情評價標志物[10,11]。另有多項針刺、電刺激相關的研究證實,不同的物理治療手段能夠通過調控miR的表達起到神經保護作用[12,13]。MiR-23是目前受到廣泛關注一種具有神經保護作用的miR,在缺血性腦卒中動物模型[5]、缺氧誘導神經元損傷模型[14]中表達降低。本研究也證實缺血性腦卒中模型大鼠腦組織中miR-23的表達水平降低,在給予ELF EMF干預后、腦組織中miR-23的表達水平增加,提示ELF EMF可能通過增加miR-23的表達起到神經保護作用。
本研究進一步通過側腦室注射miR-23抑制物的方式驗證miR-23在ELF EMF減輕缺血性腦卒中大鼠神經功能損害中的作用,在ELF EMF干預前側腦室注射miR-23抑制物能夠敲低miR-23,在敲低miR-23后ELF EMF減輕神經功能損害、縮小腦梗死體積、抑制腦組織細胞凋亡的作用發生逆轉,表明ELF EMF在缺血性腦卒中發生后起到的神經保護作用與增加miR-23的表達有關。
近些年關于miR-23的研究表明Notch1信號通路受到miR-23的調控[6]。Notch1信號通路有Notch1、Jagged1、Hes1組成,該通路激活具有促進細胞存活、抑制細胞凋亡的作用。多項基礎研究證實,缺血性腦卒中發病過程中Notch1信號通路受到抑制[15,16],Gao[17]的研究還發現ELF EMF在腦缺血過程中促進Notch1信號通路的激活。本研究的結果與既往文獻的報道一致,缺血性腦卒中大鼠腦組織中Notch1、Jagged1、Hes1的表達降低,ELF EMF干預后Notch1、Jagged1、Hes1的表達增加。進一步觀察miR-23對Notch1的調控作用可知:在ELF EMF干預前側腦室注射miR-23抑制物能夠使Notch1、Jagged1、Hes1的表達降低,表明miR-23可能在缺血性腦卒中發病及治療中參與Notch1通路的調控,ELF EMF可能通過增加miR-23的表達促進Notch1信號通路激活,進而發揮神經保護作用。
綜上所述,ELF EMF能夠促進缺血性腦卒中大鼠神經功能缺失恢復,同時增加miR-23表達、促進Notch1通路激活,通過側腦室注射抑制物敲低miR-23的表達后、ELF EMF的神經保護作用減弱,進而提示ELF EMF在缺血性腦卒中大鼠中的神經保護作用與增加miR-23表達、激活下游Notch1通路有關。

