釀酒酵母乙酸代謝調控機制及低產菌株選育的研究進展
鄧海霞,郭晨晨,李二虎,*
(1.華中農業大學食品科學技術學院,湖北 武漢 430070;2.果蔬加工與品質調控湖北省重點實驗室(華中農業大學),湖北 武漢 430070)
果酒是水果經破碎、榨汁、發酵、澄清、陳釀等工藝加工后獲得的低酒精度飲料,其酒精體積分數一般在7%~18%。經發酵釀制而成的果酒,既保留了水果的風味又增加了其營養價值,符合人們當前的消費需求,受到廣大消費者的喜愛。果酒中的有機酸包括固定酸和揮發酸。乙酸作為揮發酸的主要成分,其含量高低是影響果酒品質的重要因素[1]。乙酸含量過高不僅會導致果酒口感苦澀、刺激,而且會導致酵母細胞死亡,阻礙發酵正常進行[2]。通常情況下,果酒中乙酸質量濃度在0.1~0.5 g/L,當質量濃度超過0.8 g/L就會出現酸敗味[3]。2020年制定的《果酒通用技術要求》規定,果酒中的乙酸質量濃度應不高于1.2 g/L。但是實際生產中因原料質量及釀造工藝等因素的影響,常有果酒乙酸含量超標的現象發生,阻礙了我國果酒產業的高質量發展。
果酒中的乙酸主要來源于3 個方面:1)果酒發酵原料帶入。水果成熟后易受病蟲害浸染,表面滋生微生物,由病原體感染或自然形成引起的果皮破裂,使得醋酸菌能夠進入果實的內部,并利用天然酵母發酵產生的乙醇作為其首選碳源,使得果汁中乙酸含量超標[4-5];2)果酒發酵過程釀酒酵母(Saccharomyces cerevisiae)代謝生成。在酒精發酵過程中,丙酮酸脫氫酶活性在厭氧條件下受到抑制,阻礙了丙酮酸轉化成乙酰輔酶A。為了滿足酵母細胞基本能量和物質的合成,酵母丙酮酸脫氫酶旁路被激活,乙酸則是釀酒酵母通過丙酮酸脫氫酶旁路形成的一種重要副產物,主要產生于酒精發酵初期,其產量受酵母菌株[6-7]、含糖量[8-10]、氮源[11-12]和發酵條件[13-16]等因素影響;3)陳釀階段產生。果酒在陳釀過程中,如果貯存管理不科學,果酒與空氣接觸,感染雜菌或酒中的乙醇被氧化,也會導致乙酸含量增加[17]。其中,在發酵原料和陳釀階段產生的乙酸,國內外學者已開展了大量研究,并提出了相應的生產控制措施[18-19]。而針對酒精發酵過程中釀酒酵母生成導致果酒乙酸含量過高的問題,學術界和工業界至今仍未能找到有效的解決措施。雖然通過優化發酵工藝條件能夠在短期內快速調整果酒中乙酸含量[20-21],但是由于原料的差異性以及發酵環境的復雜性,對生產設備和發酵工藝提出了較高的要求。因此,要想從根本上解決果酒乙酸含量超標的問題,應該從釀酒酵母乙酸代謝調控機制出發,選育優良的低產乙酸酵母菌株。本文介紹酒精發酵過程中釀酒酵母乙酸代謝途徑及其調控基因,并在此基礎上闡述釀酒酵母乙酸調控機制研究策略以及低產乙酸菌株選育方法的研究進展,以期為精準調控果酒中乙酸含量、提高果酒品質提供理論指導。
1 釀酒酵母乙酸代謝途徑及調控基因
酒精發酵過程中釀酒酵母產生的乙酸是引起果酒揮發酸含量升高的重要原因。研究乙酸在釀酒酵母細胞內的代謝過程對控制果酒乙酸有重要意義。圖1展示了釀酒酵母中乙酸代謝的主要途徑及關鍵調控基因。
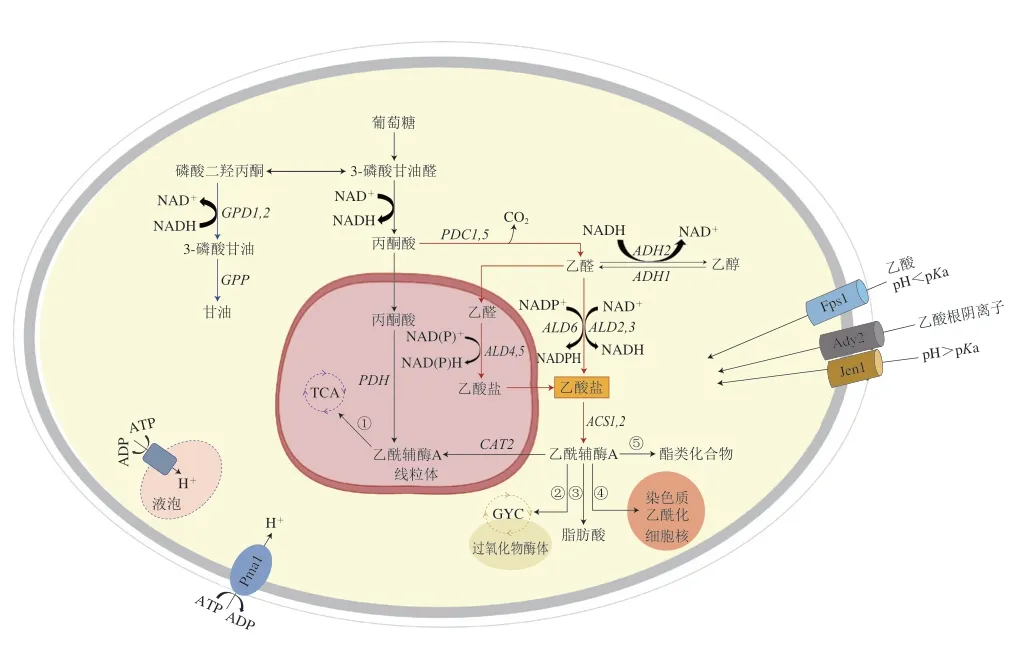
圖1 釀酒酵母乙酸轉運及代謝途徑[22-26]Fig.1 Acetic acid transportation and metabolism pathways in S.cerevisiae[22-26]
1.1 乙酸的合成代謝
釀酒酵母代謝生成乙酸的實際生化途徑雖然還沒有明確闡明,但國內外學者普遍認為乙酸是釀酒酵母經過丙酮酸脫氫酶旁路的副產物[27-28]。該途徑涉及到丙酮酸在丙酮酸脫羧酶的催化下生成乙醛,之后乙醛通過乙醛脫氫酶被氧化為乙酸(圖1)。Verduvn等[29]研究發現,在厭氧條件下,具有最低乙醛脫氫酶活性酵母產生的乙酸含量最低。在高糖發酵基質中,釀酒酵母合成乙酸與甘油總是同步的,因此有人提出釀酒酵母產生乙酸以平衡響應高滲應激和甘油過量產生的NAD+可能是乙酸形成的機制[30-31]。除了上述兩種說法以外,Jost等[32]提出乙酸也可由乙酰輔酶A水解酶水解乙酰輔酶A以及檸檬酸裂解酶裂解檸檬酸生成。
1.2 乙酸的分解代謝
乙酸在酵母細胞中的轉運取決于胞外pH值(圖1)。在低pH值條件下(pH<4.76),乙酸處于未解離(質子化)狀態,可以通過水甘油孔通道蛋白(Fps1p)或通過簡單擴散進入細胞[23]。但Mollapour等[33]卻發現當酵母細胞被突然暴露在高質量濃度乙酸(6 g/L)環境下時,絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)會被迅速激活,使Fps1p磷酸化,這種磷酸化會導致Fps1p的內吞和降解,阻止乙酸進入細胞。未解離的乙酸一旦進入細胞質,就會解離成乙酸根陰離子和質子,質子可以通過質膜質子泵ATP酶(Pma1p)或液泡質子泵ATP酶(V-ATPase)被排出到細胞質外,以恢復細胞內pH值[34]。當外界pH值高于4.76時,乙酸根離子主要通過兩個電中性轉運蛋白(Ady2p和Jen1p)進入細胞內[35]。
進入細胞的乙酸根陰離子以乙酸鹽的形式進入丙酮酸脫氫酶旁路被代謝。乙酸鹽在乙酰輔酶A合成酶的催化下與輔酶A結合生成乙酰輔酶A。乙酰輔酶A作為釀酒酵母體內一種重要的輔因子,參與了包括TCA、GYC[25]、脂肪酸合成[36]、酯類化合物合成[32]和染色質蛋白乙酰化[26]等細胞內多種生化反應。
1.3 乙酸代謝調控基因
釀酒酵母生成乙酸是多個基因共同調控的結果。目前對乙酸調控基因的研究主要集中在丙酮酸脫氫酶旁路途徑和甘油合成途徑(圖1),現對這兩條代謝通路的關鍵調控基因以及相關轉錄因子進行介紹,并闡述其對乙酸的調控作用。
1.3.1 丙酮酸脫氫酶旁路途徑調控基因
丙酮酸經過丙酮酸脫羧酶脫羧生成乙醛和二氧化碳,該反應中的丙酮酸脫羧酶主要由PDC1和PDC5控制編碼,且該酶80%~90%的活性來源于Pdc1p[37],而Wang Depei等[38]研究表明,PDC5才是完全實現丙酮酸脫羧酶活性的主導基因。PDC1被報道在厭氧條件下對酵母乙酸的生成影響不顯著[39],但Curiel等[40]在有氧條件下敲除酵母的PDC1,結果發現乙酸產量下降了57%。說明PDC1對乙酸的調控作用可能與氧氣有關。
乙醛在乙醛脫氫酶催化作用下被氧化為乙酸,并伴隨著NAD+還原成NADH。釀酒酵母中已鑒定出3 種編碼細胞質乙醛脫氫酶的基因(ALD2、ALD3和ALD6)和2 種編碼線粒體乙醛脫氫酶基因(ALD4和ALD5)。ALD2與ALD3使用NAD+作為輔因子,其活性受到應激脅迫誘導和葡萄糖抑制[41]。ALD6由Mg2+激活并優先利用NADP+作為輔助因子,對葡萄糖和乙醇條件下酵母的生長發揮作用[42]。ALD5是編碼線粒體乙醛脫氫酶的一種次要基因,由K+激活,并利用NAD+和NADP+作為輔助因子,在電子傳遞鏈組分的調節或生物合成中發揮作用,并受滲透應力誘導[43-44]。ALD4由K+激活,主要參與酵母在乙醇條件下的生長,對酵母在葡萄糖條件下的生長無明顯作用[45]。目前,尚不清楚是哪一種編碼乙醛脫氫酶的基因在乙酸調控方面占主導地位,不同的菌株背景和發酵條件下,基因表達情況也有所不同。在大部分果酒發酵過程中,ALD6主要負責酒精發酵過程中乙酸的生成,ALD3和ALD4的表達均受到葡萄糖的抑制[46-48]。在模擬葡萄汁發酵過程中,ALD6主要負責乙酸的合成,ALD5起輔助作用[49]。若刪除野生型菌株的一個或兩個拷貝的ALD6,可以使酒中乙酸產量分別降低為野生型的75%和40%,而ALD4可以部分補償ALD6缺失引起的乙酸產量降低[40,49]。在冰酒發酵的高滲透脅迫條件下,ALD3的高水平表達似乎有助于維持釀酒酵母細胞內氧化還原平衡和發酵過程中乙酸的產生[9,50]。
乙酸在乙酰輔酶A合成酶的催化下與輔酶A結合生成乙酰輔酶A,并伴隨著ATP水解。乙酰輔酶A合成酶受兩個基因編碼,分別是ACS1和ACS2。研究表明由ACS1編碼的酶與乙酸鹽的親和力約是ACS2編碼酶的30 倍,但ACS1的表達在厭氧條件下會受葡萄糖抑制,這種抑制作用會在ACS2缺失時被削弱[51]。Shiba等[52]研究發現釀酒酵母的ALD6過表達會導致乙酸產量會升高,ACS1過表達導致乙酸產量降低,而當二者同時過表達時,乙酸產量降低,說明ACS1對乙酸的調控作用比ALD6更顯著。
1.3.2 甘油合成途徑調控基因
酒精發酵初期,釀酒酵母細胞內乙醇脫氫酶的活性被抑制,氧化還原反應不平衡引發甘油的合成。甘油合成過程對NADH的需求增加,誘導釀酒酵母生成更多的乙酸以平衡甘油合成途徑中消耗的NADH[31]。磷酸二羥丙酮是合成甘油的底物,在細胞質中經NADH依賴性甘油-3-磷酸脫氫酶和甘油-3-磷酸酶催化后轉化為甘油。甘油-3-磷酸脫氫酶是甘油形成的關鍵限速酶,由兩個同源基因(GPD1和GPD2)編碼[53]。GPD1的表達受到滲透壓應激誘導并通過高滲甘油信號(highosmolarity glycerol response,HOG)途徑調節[54]。GPD2的表達不受外部滲透壓變化的影響,但與厭氧條件下維持氧化還原的平衡有關[55]。Pigeau等[50,56]發現在冰酒發酵過程中,與稀釋后的冰酒汁相比,高糖脅迫條件下冰酒中乙酸含量增加了7 倍,釀酒酵母GPD1表達量增加了2.5 倍,但GPD2表達量變化不顯著。
1.3.3 轉錄因子
除了上述的調控基因外,一些轉錄因子可通過調控編碼乙醛脫氫酶的基因或蛋白進而調控乙酸的生成。Rsf2p是一種可以調節ALD6的轉錄因子[57],但敲除菌株的RSF2對酵母乙酸生成無顯著影響[47],說明RSF2對乙酸調控不具有主要作用。Aaf1p是一種鋅指轉錄因子,在葡萄酒發酵條件下定位于細胞核中[47]。Aaf1p可直接或者通過介導Ald6p調節ALD4和ALD6的轉錄水平,從而調節乙酸的生成。Walkey等[58]研究發現,AAF1敲除菌株產生的乙酸量比野生型菌株少39%左右,其效果比RSF2的敲除更顯著。Yap1p是一種控制釀酒酵母氧化應激反應的轉錄因子。氧化條件下的ChIP芯片全基因組定位分析表明,Yap1可直接與ALD5和ALD6基因的啟動子相互作用,參與釀酒酵母乙酸的調控[59]。Cordente等[60]發現,YAP1突變的釀酒酵母表現出較低的乙酸產量和較低的乙醛脫氫酶活性。
研究表明,當釀酒酵母細胞中編碼乙醛脫氫酶的5 個基因都被敲除時,該缺失菌株依舊可以產生乙酸[49],說明還存在其他調控基因可通過影響乙醛脫氫酶活性進而影響乙酸的生成,或者是除丙酮酸脫氫酶旁路外,可能還存在其他產生乙酸的途徑。因此,釀酒酵母乙酸代謝通路及其調控的關鍵基因,仍需進一步探索和挖掘。
2 釀酒酵母乙酸代謝調控機制研究策略
為了更有效地調控釀酒酵母乙酸的生成,需要深入揭示酵母乙酸調控機制。釀酒酵母產乙酸特性是受多基因控制的數量性狀,是基因與基因、基因與環境互作的結果,每個基因都具有復雜的表達調控網絡,這給低產乙酸分子機制的解析提出了挑戰。可采用組學技術和數量性狀基因座(quantitative trait loci,QTL)定位技術挖掘調控釀酒酵母乙酸產量的關鍵基因,解析乙酸表型-基因型關系,既可明晰釀酒酵母調控乙酸代謝的分子機制,又能夠為低產乙酸酵母菌株選育提供理論依據。
2.1 組學技術
組學技術的發展為了解菌株的代謝途徑、尋找差異表達基因及生物標志物提供了有力的分析平臺。利用下一代測序技術進行測序比對,通過轉錄組學、代謝組學等技術對基因及代謝物進行定性定量,結合生物信息學分析對其進行功能注釋及分類,尋找基因表達及代謝物豐度差異,進而解析基因型與表型關系。
轉錄組學通常用于比較不同組織或生理狀況下基因表達水平的差異,發現與特定生理功能相關的基因,從而研究基因與相關代謝通路調控規律。轉錄組分析技術主要包括基于雜交的DNA微陣列技術、基于標簽的基因表達系列分析和大規模平行測序技術、基于新一代高通量測序的轉錄組測序(RNA sequencing,RNA-seq)技術。RNA-seq技術通過新一代測序技術對cDNA文庫進行測序,對轉錄本進行全方位的研究,無需進行熒光標記,數據準確可靠、操作簡單方便,逐漸成為轉錄組研究中應用最廣泛的技術。Baumann等[61]通過RNA-seq技術確定釀酒酵母與其高產辛酸改造菌株的差異表達基因,通過對這些基因進行敲除和過表達,驗證了RPL40B的過表達對辛酸的產生發揮了重要的作用。沈璐[62]利用RNA-Seq技術研究抗葡萄糖阻遏菌株乳源酵母Kluyveromyces marxianus246解阻遏的機制,通過對不同碳源的細胞進行轉錄組測序,確定了MIG1的低表達使得半乳糖代謝途徑相關基因獲得適應性進化,從而具有抗葡萄糖阻遏作用。對釀酒酵母乙酸代謝機制的研究,也可利用轉錄組學技術比較同一菌株不同時期或不同乙酸表型釀酒酵母菌株同一時期的基因表達,挖掘與乙酸產量密切連鎖的主效基因,揭示表型背后的分子機制。
代謝組學是研究生物體內因基因或基因表達被擾動而導致的代謝產物、代謝途徑變化規律的學科。代謝組技術通常基于質譜與氣相色譜、高效液相色譜等技術聯用對代謝產物進行定性定量分析[63]。代謝組學技術通常被用于確定生物體系代謝途徑,從代謝的水平上揭示物質調控機制。Ogawa等[64]采用非靶向代謝組學結合氣相色譜-質譜技術研究酒花酵母的葡萄糖酸代謝,結果表明葡萄糖酸的代謝涉及到包括TCA循環和甘油脂代謝在內的4 個代謝途徑,提出可基于這些途徑進一步調控葡萄酒中的葡萄糖酸含量。依靠代謝組學能夠找到與乙酸相關的代謝通路,從而進一步探究釀酒酵母的乙酸代謝途徑及調控機制。
利用轉錄組分析可以得到大量差異基因以及眾多調控網絡,但難以確定關鍵調控途徑。代謝組分析可以反映表型狀態的變化,但無法解釋表型的基因機理。因此,越來越多學者選擇采用組學聯合的方法分析差異基因與差異代謝物的相關性,確定關鍵基因,構建核心調控網絡,闡釋生物學現象。Zhang Zhiyong等[65]采用代謝組學結合轉錄組學探究馬克斯克魯維酵母(Kluyveromyces marxianus)和釀酒酵母在蘋果酒中靜態發酵條件下的揮發性化合物含量及代謝途徑變化規律,分析表明馬克斯克魯維酵母糖酵解和乙醇合成途徑的相關基因都有很高的表達量,從而促進了乙酸乙酯和相關酯的合成。Zhu Yuanyuan等[66]以轉錄組和代謝組研究木質纖維素抑制劑對樹干畢赤酵母(Pichia stipitis)的代謝機制影響,發現在抑制劑的作用下,畢赤酵母細胞內參與碳源代謝的基因表達顯著下調,氨基酸合成途徑基因表達顯著上調。轉錄組學和代謝組學相結合策略也可被應用在研究釀酒酵母乙酸代謝的分子機制上,通過轉錄組和代謝組測序獲得差異表達基因和差異代謝物,并計算差異基因和差異代謝物的相關性,構建相關性網絡,找出引起乙酸變化的關鍵作用基因,確定關鍵的調控通路。
2.2 數量性狀基因座定位
釀酒酵母乙酸產量是受多基因與環境共同調控的復雜數量性狀。如果能找到與乙酸產量密切連鎖的主效基因,將會對酵母乙酸調控機制的研究以及低產菌株的選育工作提供很大的幫助。近年來,隨著分子生物學技術的發展,復雜數量性狀主效基因的挖掘效率和成功率不斷提高[67-68]。解析數量性狀基因座的一般方式為:首先通過連鎖分析等方法從目標物種的基因組上定位與目標數量性狀間存在顯著相關關系的區段,即QTL;隨后在定位到的QTL區段內通過篩選與鑒定,尋找數量性狀候選基因(quantitative trait gene,QTG);采用基因置換、相互半合子分析(reciprocal hemizygosity analysis,RHA)等方法對候選基因進行克隆鑒定;通過等位基因間的比對尋找引發該數量性狀改變的有效數量性狀核苷酸突變(quantitative trait nucleotide,QTN),最終對其分子機制進行解析[67]。Offei等[69]以布拉氏酵母(Saccharomyces boulardii)與釀酒酵母為親本菌株,采用混合分離全基因組序列分析,對布拉氏酵母高乙酸產量基因進行QTL定位,結合互惠半合子分析、等位基因置換、序列分析確定了布拉氏酵母候選基因sdh1F317Y、whi2S287*對高乙酸產量的重要作用。Marullo等[70]對兩株產乙酸量存在差異的親本菌株的后代采用高密度核苷酸微陣列進行基因分型,并建立性狀與分子遺傳標記之間的統計聯系,從而定位決定乙酸產量顯著差異的QTL,進一步研究表明,該QTL僅在以天冬酰胺為主要氮源時才有效。
定位QTL的方法主要有構建遺傳圖譜法、全基因組關聯分析法(genome-wide association study,GWAS)和分離群體分組分析法(bulked segregant analysis,BSA)。傳統的構建遺傳圖譜法,需要對所有個體進行基因分型和表型測定,時間長、成本高。GWAS涉及使用從種群或物種中采樣的遺傳多樣性個體識別遺傳變異和性狀之間的關聯[71],具有更高的遺傳作圖分辨率,并能夠對物種中存在的遺傳多樣性進行更廣泛的采樣。GWAS在檢測人群中常見的遺傳變異方面最為有效,因此低頻的因果變異可能無法識別[72]。隨著高通量測序的發展,下一代測序技術為目標性狀連鎖標記及基因快速定位提供了有效手段,分離群體分組分析與全基因組重測序技術相結合(BSA-seq),具有所需樣本量少、成本低、效率高等特點,已成為QTL定位的主流方法。自1991年由Michelmore等報道以來[73],BSA-seq技術在作物農藝性狀[74]和酵母數量性狀[75-76]基因定位的研究中應用十分廣泛。目前,BSA-seq技術已成功用于探索調控釀酒酵母耐受性[77]、發酵速率[78]、氮源利用[79]、甘油產量[80]、香氣合成[81]及微生物互作[82]等數量性狀的主效基因。因此,可利用BSA-seq策略挖掘果酒發酵過程中釀酒酵母乙酸產量性狀主效QTL,從而分析釀酒酵母調控乙酸生成分子機制。如圖2所示,首先篩選出兩株乙酸產量差異極顯著的釀酒酵母,形成后代雜合孢子,后代孢子是攜帶來自親本(紅色和藍色片段)遺傳物質的嵌合體;對F2代進行表型篩選,分別構建低產乙酸混池和高產乙酸混池,對不同表型的子代混池樣本及親本進行全基因組重測序,通過生物信息學分析實現QTL定位[67]。
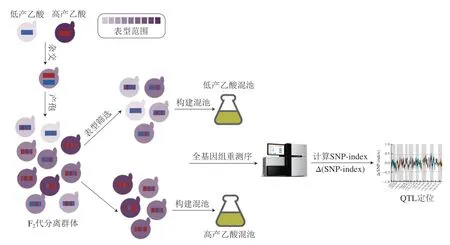
圖2 基于BSA-seq技術定位釀酒酵母乙酸產量主效數量基因座的方法示意圖[67]Fig.2 Schematic diagram of the method for locating the major effect QTL of acetic acid production in S.cerevisiae based on BSA-seq technology[67]
3 低產乙酸釀酒酵母的選育方法
為了控制釀酒酵母產生乙酸,以往采取的措施主要是從自然發酵中篩選低產乙酸的菌株[83-84]。然而這種方式不僅消耗大量的人力和物力,而且所篩菌株性狀往往不夠理想,不能夠滿足現代產業的需要。隨著釀酒酵母乙酸代謝機制研究的不斷深入,研究人員逐漸傾向于依靠誘變、雜交和代謝工程等功能菌種選育技術選育出優良的低產乙酸酵母菌株,實現果酒乙酸的調控。
3.1 誘變育種
誘變育種是目前應用最廣泛的菌種選育技術,主要是指采用物理和化學等誘變劑處理釀酒酵母,使其基因的突變率大幅提高,從而獲得具有特定功能菌株的育種技術。物理誘變包括紫外誘變與常壓室溫等離子體誘變技術,通過增大釀酒酵母菌株DNA的堿基錯配率,進而提高釀酒酵母的基因突變率。紫外誘變通過破壞菌株DNA雙鏈解旋和堿基配對,影響菌株DNA正常復制,形成突變體[85]。常壓室溫等離子體技術通過發射等離子體,造成菌株DNA損傷以及不完全修復,進而形成可穩定遺傳的突變株[86]。陳雪等[87]通過常壓室溫等離子體對釀酒酵母進行誘變,得到一株低產揮發酸突變菌株,該菌株遺傳穩定性好,釀造的冰酒揮發酸含量低,但導致其低產揮發酸的原因有待探究。
化學誘變是一種經濟方便的育種方法,并且較物理誘變,采用不同化學誘變劑對染色體、基因等的誘變專一性更強[88]。張菡[89]以淺藍菌素為誘變劑處理釀酒酵母,從得到的淺藍菌素突變體中篩選出穩定、高效的低產乙酸目標菌株,ALD6的堿基突變可能是突變菌株低產乙酸的原因。Mizuno等[90]從釀酒酵母的2-脫氧葡萄糖(2-deoxyglucose,2-DG)突變體中分離出具有低乙酸和高乙醇生產力的突變體2-DGR19,并且通過DNA微陣列分析發現,ADH的高表達與ALD的低表達是導致該突變體具有這些特性的主要原因。
單一的誘變方式效率較低,且很少能得到性狀十分優良同時能夠穩定遺傳的菌株。因此,有些學者選擇采用物理誘變與化學誘變技術相結合的方式來提高篩菌效率。Kosugi等[91]通過紫外誘變分離耐2,4-二硝基苯酚(2,4-dinitrophenol,2,4-DNP)的清酒酵母菌株,這些菌株顯示出高產蘋果酸和低產乙酸,進一步研究發現低線粒體活性和高NADH/NAD+比率是導致兩種有機酸含量改變的原因。物理和化學誘變技術都是目前比較常見的育種技術,操作簡單、成本低。但酵母菌的基因結構使得這種育種方法應用起來有局限性,因為大部分的酵母基因都有2 個以上的拷貝,隱性突變的選擇很困難[92],而且長期使用誘變劑會導致菌株產生耐受性。
3.2 雜交育種
雜交育種是指將不同優良表型的親本菌株進行雜交,從而得到具有雙親優良性狀雜交種的育種方法。雜交一般可通過4 種方式實現:孢子雜交、罕見雜交、大規模雜交、原生質體融合。孢子雜交類似于自然交配,由具有不同交配型的孢子接合,雜交成功率大,遺傳穩定性好[93],但實驗中無法對孢子的表型進行表征,形成的雜交種可能會丟失親本的優良表型[94]。大規模雜交使用大量來源于不同親本的單倍體進行隨機交配,可以以快速且相對容易的方式獲得多種有益突變累加在一起的表型。Steensels等[95]通過從301 株酵母菌株中選擇3 株具有遺傳多樣性的釀酒酵母作為親本菌株,以果香化合物為標準對其142 個分離孢子進行篩選,共選擇17 個單倍體進行雜交,最終獲得高產乙酸異戊酯的雜交菌株H44,乙酸異戊酯產量比親本菌株(Y354和Y397)提高了152%和145%。罕見雜交是指當二倍體酵母菌株交配型位點的雜合性自發消失時,該酵母可與其互補的酵母菌株雜交,這種方式交配率極低,往往需要選擇性標記分離雜種。原生質體融合包括去除親本細胞壁、融合原生質體、新細胞壁合成,這種方法不需要考慮菌株的產孢及交配能力,并且形成的雜種基因組具有較低的穩定性[96]。Bellon等[97]將釀酒酵母與低產乙酸的貝酵母(Saccharomyces bayanus)進行種間雜交獲得雜交酵母,兩種雜交種產生的乙酸水平約為釀酒酵母的65%,并可用于生產具有特征風味與香氣的葡萄酒。
酵母菌雜交育種也存在一定局限性,主要是由于酵母菌的多倍體基因排列,使得自然界中能形成孢子的菌株出現幾率很小,還有一些特殊的酵母菌屬間雜交不會將結合子的理想特性傳遞給子代,另外,能夠被交換或傳遞到子代、結合子上的理想性狀特點也是有限的。
3.3 代謝工程育種
代謝工程是近年來發展迅速的新興學科領域,能夠突破物種間的障礙,最大限度地定向構造菌株。代謝工程通過對釀酒酵母細胞內乙酸代謝途徑進行有目的地修飾和改造,從而改變細胞特性,并與細胞基因調控、代謝調控及生化工程技術相結合,構建低產乙酸的代謝途徑。隨著對控制乙酸產量主效基因的挖掘以及釀酒酵母乙酸代謝調控機制研究的深入,運用代謝工程手段定向構造低產乙酸酵母菌株已成為了研究熱點(表1)。Shi Wenqi等[98]以釀酒酵母為研究對象,通過引入異源醇乙酰轉移酶過表達ACS1和ALD6,并刪除負責丙酮酸和乙酰輔酶A線粒體轉運的基因(POR2、MPC2、PDA1),以此降低乙酸含量、提升乙酸乙酯的產量。Eglinton等[99]通過構造ALD6缺失型菌株,使得乙酸產量減少至原來的1/3,但也導致發酵速率減慢以及一些次級代謝產量降低。

表1 代謝工程對釀酒酵母乙酸產量和發酵特性的影響Table 1 Effect of metabolic engineering on acetic acid production and fermentation characteristics of S.cerevisiae
雖然通過敲除或過表達乙酸合成途徑中的基因可以達到降低乙酸含量的目的,但是這種方式往往會影響菌株的正常生長及釀酒性能。針對這一問題,可以考慮采用逆向代謝工程進行低產乙酸釀酒酵母的選育,即首先確定乙酸產量的關鍵基因或特定的環境因子,然后通過遺傳修飾或改變環境,使低產乙酸表型在特定生物中表達[103]。用此手段構造的菌株,僅攜帶與低產乙酸相關的有利突變,并且保留了野生型菌株的優良性狀。
4 結語
釀酒酵母代謝是果酒酒精發酵過程中乙酸生成的主要原因,該過程受多個基因的調控。基于組學及BSAseq技術進一步確定釀酒酵母控制乙酸產量的主效基因,揭示酵母乙酸的代謝調控機制,對選育出優良的低產乙酸酵母菌株、實現果酒乙酸的精細化調控有重要意義。目前,針對發酵過程中乙酸含量的控制方法多集中于從自然環境中篩選低產乙酸的菌株或采用轉基因及非轉基因手段改造釀酒酵母。篩選、誘變和雜交都是采用非轉基因手段從龐大的細胞池中篩選具有特定表型的酵母細胞,而細胞池中僅有少數表現出有益突變的細胞,通過多輪誘變、誘變后定向進化、雜交前菌株表型篩選可以幫助縮小范圍同時靶向特定表型,但這些操作也可能造成其他表型丟失,導致突變株或雜交株表現弱于原始株。代謝工程可以通過敲除或過表達乙酸代謝途徑中的關鍵基因達到降低乙酸產量的目的,但這種基于轉基因方式制作的食品可能會使消費者難以接受。因此,未來仍需要探索更加合適的菌種選育方式,以獲取更加適用于工業及商業需求的酵母菌株。

