外周血淋巴細胞亞群及腫瘤標志物變化對晚期非小細胞肺癌免疫治療療效的預測價值
周 雙 朱正秋 倪子龍
據相關研究數據統計,肺癌是最常見的癌癥,也是癌癥死亡的主要原因,其中非小細胞肺癌(non-small cell lung cancer,NSCLC)是肺癌中最常見的病理類型,約占肺癌患者的70%~85%,而晚期NSCLC患者的5年總生存率低于5%[1,2]。近年來在NSCLC治療方面取得了許多革命性的新進展,免疫治療就是其中之一,免疫檢查點抑制劑(immune checkpoint inhibitors,ICIs)的使用給NSCLC患者帶來了前所未有的生存獲益,如KEYNOTE-001研究結果表明,一線接受帕博麗珠單抗(Pembrolizumab)治療的晚期NSCLC患者5年總生存率可達23.2%[3]。雖然生存率有了顯著的提高,但只有少數患者可以從免疫治療中長久獲益,因此迫切需要療效預測性生物學標志物[4]。
目前,大量研究致力于探索程序性死亡受體配體1(programmed cell death ligand 1, PD-L1)表達水平、腫瘤浸潤性淋巴細胞(tumor infiltrating lymphocyte, TIL)及腫瘤突變負荷(tumor mutation burden, TMB)等生物學標志物作為免疫治療療效預測因子是否可行,但此類標志物由于檢測方法費用高、過程復雜、耗時長等限制其臨床常規應用[5]。因此通過聯合經濟、方便、可行的常規實驗室指標對免疫治療療效進行預測就顯得尤為重要。目前,臨床上關于手術、放療、化療等抗腫瘤治療對于患者的免疫功能及瘤標影響的報道已有很多[6,7]。但有關淋巴細胞亞群聯合瘤標與晚期NSCLC免疫治療療效之間的研究還不多見。故本研究旨在探索聯合外周血T淋巴細胞亞群及腫瘤標志物的動態變化對晚期NSCLC患者免疫治療療效的預測價值。
資料與方法
1.臨床資料:回顧性分析2018年9月~2021年11月于徐州醫科大學附屬醫院接受免疫藥物治療的110例晚期NSCLC患者。所有患者均符合如下標準:入組標準:①經細胞學或病理學上明確診斷為NSCLC;②接受過免疫藥物治療,包括單藥或聯合治療方案;③初診時臨床分期為不可手術的Ⅲ期或Ⅳ期;④病歷資料完整,有可評估療效的影像學資料。排除標準:①合并其他惡性腫瘤;②合并自身免疫性疾病或血液系統疾病的患者;③無可測量病灶的癌癥患者;④臨床資料缺失的患者。并收集患者其他臨床資料:年齡、性別、吸煙史、病理類型、TNM分期、ECOG-PS、放療史、治療線數、治療方案等。本研究經筆者醫院醫學倫理學委員會審批(倫理學審批號:XYFY2022-KL355-01)。
2.治療方法:具體治療方案如下:單藥方案的患者每3周接受一次帕博麗珠單抗、信迪利單抗、卡瑞麗珠單抗或替雷麗珠單抗靜脈注射固定劑量200mg。聯合化療方案為含鉑雙藥化療,其他藥物根據腫瘤組織學應用,包括培美曲塞、紫杉醇/白蛋白紫杉醇、多西紫杉醇、吉西他濱。聯合抗血管生成藥物為貝伐珠單抗。
3.觀察指標及療效評價:分別于治療前、治療后第6周和第12周收集患者的血液學指標,包括T淋巴細胞亞群(CD4+絕對計數、CD8+絕對計數、CD4+/CD8+水平),以及癌胚抗原(CEA)、細胞角質蛋白19片段抗原21-1(CYFRA 21-1)水平變化及治療后12周的臨床療效。根據實體瘤療效評價標準(Response Evaluation Criteria in Solid Tumor,RECIST1.1)評估所有患者的治療療效[8]:完全緩解(complete response, CR):所有目標病灶完全消失;部分緩解(partial response, PR):基線病灶最長徑總和減少≥30%;疾病進展(progressive disease,PD):基線病灶長徑總和增加≥20%或出現新病灶;疾病穩定(stable disease,SD):基線病灶長徑總和縮小但未達到PR,或增加未達到 PD。將完全緩解和部分緩解患者納入有效組,疾病穩定和疾病進展患者納入無效組。
4.統計學方法:應用SPSS 25.0統計學軟件對數據進行統計分析,對入組患者T淋巴細胞亞群及血清腫瘤標志物結果進行正態分布檢驗,不符合正態分布的數據以中位數(四分位數間距)[M(Q1,Q3)]表示,組間比較采用獨立樣本的秩和檢驗、組內比較采用配對樣本秩和檢驗;使用χ2檢驗分析影響療效的因素;并采用MedCalc軟件繪制受試者特征操作曲線(receiver operator characteristic,ROC),分析T淋巴細胞亞群、CEA、CYFRA21-1單一指標與三者聯合對NSCLC免疫治療后療效預測價值,計算曲線下面積(area under curve,AUC),以P<0.05為差異有統計學意義。
結 果
1.外周血淋巴細胞亞群計數與NSCLC臨床特征的關系:治療前患者CD4+絕對計數、CD8+絕對計數、CD4+/CD8+比值在不同的年齡、性別、是否吸煙、病理類型、臨床分期、ECOG評分、有無放療、治療線數、治療方案之間比較,差異均無統計學意義(P均>0.05),詳見表1。
2.免疫治療療效的比較:本研究完成12周治療后,110例患者中,3例達到CR,33例達到PR,58例達到SD,16例PD,將CR和PR患者納入有效組(n=36),SD和PD患者納入無效組(n=74)。
不同療效組及各組治療前后T淋巴細胞亞群的比較:免疫治療前,兩組患者CD4+、CD8+絕對計數及CD4+/CD8+比較,差異均無統計學意義(P均>0.05)。免疫治療6周后,有效組患者CD8+低于本組治療前,且CD4+、CD4+/CD8+明顯高于本組治療前和無效組,差異均有統計學意義(P均<0.01)。免疫治療12周后,有效組患者CD4+/CD8+高于本組治療6周后,CD8+低于本組治療6周后,無效組患者CD4+、CD4+/CD8+低于本組治療6周后,CD8+水平高于本組治療6周后,差異均有統計學意義(P均<0.05),并且有效組患者CD4+水平及CD4+/CD8+均高于無效組,CD8+水平低于無效組,差異均有統計學意義(P均<0.01),詳見表2。
不同療效組及各組治療前后腫瘤標志物的比較:免疫治療前,兩組患者CEA、CYFRA21-1水平比較,差異均無統計學意義(P均>0.05)。免疫治療6周,有效組患者CEA、CYFRA21-1水平均明顯低于治療前及無效組,無效組患者CYFRA21-1水平高于治療前,差異均有統計學意義(P均<0.01)。免疫治療12周,有效組患者CYFRA21-1水平明顯低于本組治療6周后,無效組CEA、CYFRA21-1水平均高于治療6周后,且有效組CEA、CYFRA21-1水平均低于無效組,差異均有統計學意義(P均<0.05),詳見表3。
不同療效患者的臨床特征:結果顯示,在PD-L1表達水平、治療線數、治療方案水平上NSCLC患者的免疫治療效果比較,差異無統計學意義(P>0.05),詳見表4。
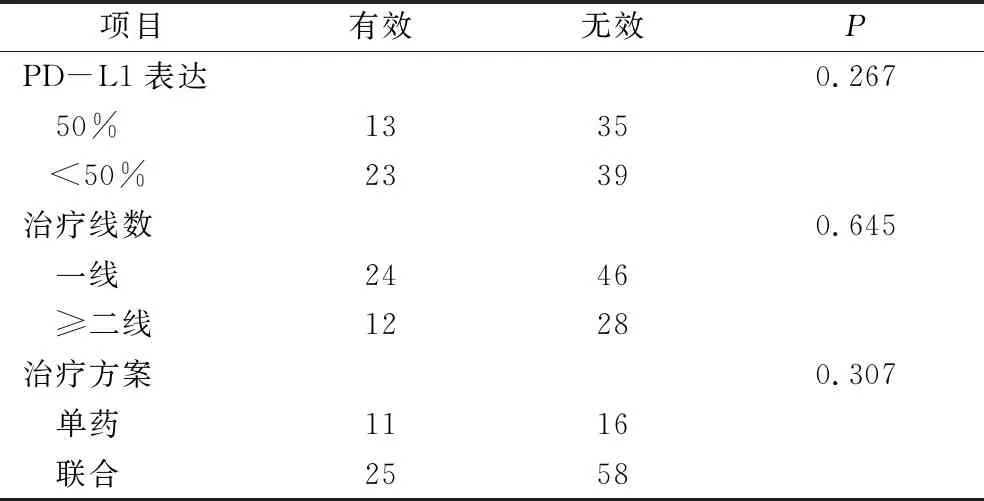
表4 不同療效患者的臨床特征
T淋巴細胞亞群、CEA及CYFRA21-1對NSCLC免疫治療療效預測價值:ROC曲線結果顯示,T淋巴細胞亞群、CEA及CYFRA21-1檢測對于NSCLC免疫治療療效具有一定預測價值,并且三者聯合檢測評估NSCLC免疫治療療效的AUC為0.933,明顯高于三者單獨診斷(P<0.05),詳見表5及圖1。
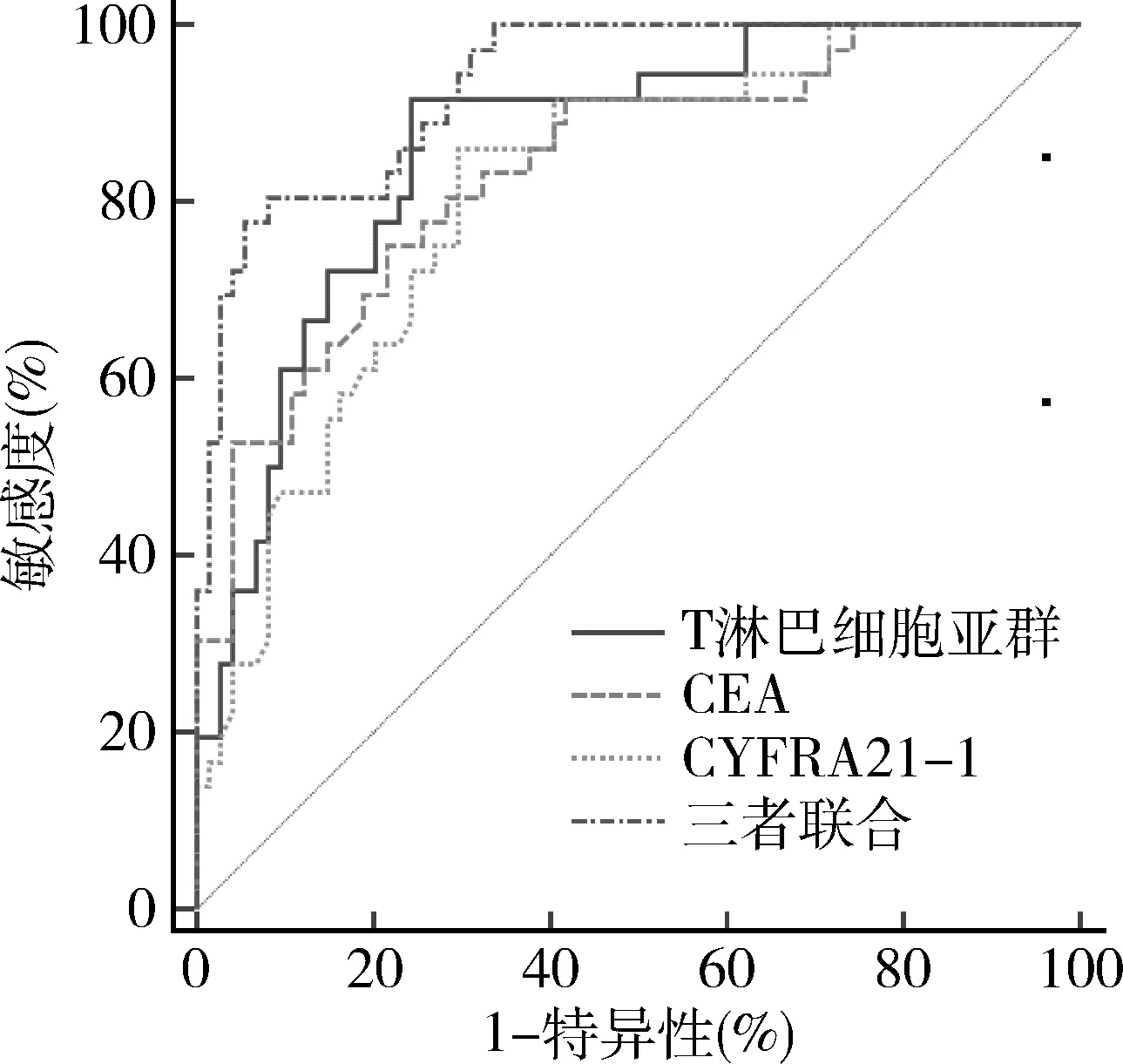
圖1 T淋巴細胞亞群、CEA及CYFRA21-1對NSCLC免疫治療療效的預測價值的ROC曲線圖

表5 T淋巴細胞亞群、CEA及CYFRA21-1對NSCLC免疫治療療效的預測價值
結 果
研究證實,傳統的治療方式并沒有明顯延長NSCLC患者長期生存期,Yan等[9]研究顯示,很多中晚期患者對于放化療是抵抗的,也有很多患者最終由于無法耐受而放棄治療,甚至即便是早期診斷,在術后的半年至2年內會再次復發。所以在此背景下免疫治療成為近幾年臨床研究的熱點,對于沒有驅動基因突變和ICIs藥物無禁忌證的患者,免疫治療作為單一療法或聯合治療已經成為晚期鱗狀和非鱗狀肺癌的一線治療方式,并且許多研究表明,對于晚期NSCLC患者,相比傳統化療ICIS有更顯著的療效獲益[10~12]。
在機體抗腫瘤免疫的過程中,細胞免疫機制發揮強大作用,其中最重要的就是T淋巴細胞群(主要包括CD4+T細胞、CD8+T細胞、CD4+/CD8+)介導[13]。CD4+T 細胞多為輔助性T細胞,其不僅能促進B淋巴細胞分泌大量的抗體,且對細胞免疫有正向作用[14]。CD8+T 細胞多為抑制性T細胞,對免疫功能起負向作用,其數量越多,免疫抑制越強,腫瘤細胞越容易增殖與轉移[15]。而CD4+/CD8+比值是反映機體免疫平衡的一個重要指標,有助于評估機體的免疫調節能力[16]。本研究同時比較了不同療效組及各組免疫治療前后的T淋巴細胞亞群的變化,結果證明,NSCLC患者在接受ICIS治療后,隨著治療療程的延長,療效較好的患者CD4+、CD4+/CD8+水平逐漸升高,CD8+水平逐漸下降,表明其免疫抑制狀況明顯好轉,機體的抗腫瘤免疫應答能力提高,有利于患者的預后和生存;療效不佳的患者結果正相反,表明其體內的免疫狀態未能得到很好的恢復。另外,本研究中強調的是淋巴細胞亞群絕對計數而不是百分比,相關研究表明通常報道的淋巴細胞百分比沒有考慮到白細胞計數,而白細胞計數在接受抗腫瘤治療后可能經常改變,所以相對來講絕對計數會更準確衡量機體免疫狀態[17]。
CEA是一種廣譜腫瘤標志物,對于肺癌的早期診斷、病情評估及療效預測具有重要意義,CYFRA 21-1是一種新型腫瘤標志物[18]。已有研究顯示它對NSCLC有較高的敏感度和特異性[19]。既往研究表明手術、化療或放療治療NSCLC有效時,血清腫瘤標志物水平較治療前有所下降,而在腫瘤進展時則會再次上升,表明其水平有助于評價治療療效以及預測腫瘤復發[20]。
本研究結果顯示,免疫治療后有效組患者的CEA、CYFRA21-1水平均出現降低,而無效組患者CEA、CYFRA21-1水平呈明顯升高趨勢,與上述研究結果相符。此外,通過比較顯示PD-L1表達水平、治療線數、治療方案對免疫治療效果的影響不明顯,這可能與樣本量較小有關。最后,進一步通過ROC曲線分析發現,T淋巴細胞亞群、CEA及CYFRA21-1三者聯合檢測評估NSCLC免疫治療療效的AUC明顯高于三者單獨判斷,說明多項指標聯合預測NSCLC患者免疫療效的價值可能更高。但本研究尚存在一些不足,如樣本量有限,隨訪時間尚短,仍需擴大樣本量、延長隨訪時間,來進一步研究ICIS治療對于NSCLC患者免疫功能的影響。另外,在有條件的情況下可考慮結合免疫相關因子分析,以進一步為臨床選擇治療方案的提供參考依據。
綜上所述,免疫治療可以調節NSCLC患者體內的淋巴亞群變化,改善機體的免疫功能,顯著降低血清腫瘤標志物水平,因此動態監測淋巴細胞亞群及腫瘤標志物水平對晚期非小細胞肺癌免疫治療療效有重要的預測價值。

