環(huán)糊精葡萄糖基轉(zhuǎn)移酶合成AA-2G反應(yīng)條件初探
何亞妹,劉振楊,鄭 婉,蘇瑞陽,吳華偉
(長江大學(xué)生命科學(xué)學(xué)院,湖北荊州 434025)
維生素C(Vitamin C,VC)廣泛存在于水果蔬菜中,是人類和少數(shù)生物體內(nèi)不可或缺的營養(yǎng)元素。它能保護人體免受氧化劑傷害、預(yù)防疾病和治療壞血病等[1]。但VC在氧氣、pH、金屬和熱量中容易降解,難以長期保存[2],故限制了其他領(lǐng)域的應(yīng)用。為改善VC的穩(wěn)定性,許多VC衍生物被相繼合成,如VC金屬鹽,VC脂類和VC糖苷類等[3]。其中VC糖苷類是對VC的C2、C3、C5 和C6 原子上進行糖基化修飾后獲得的VC衍生物[4]。2-O-α-D-吡喃葡萄糖基-L-抗壞血酸(Ascorbic acid 2-glucoside,AA-2G)是VC的C2 原子上連接了一個吡喃葡萄糖苷而形成的衍生物,在所有的VC糖苷類衍生物之中,以AA-2G的藥理學(xué)研究最多,應(yīng)用也十分廣闊,因為AA-2G是最理想的VC衍生物,是VC最好的替代品[5],市場需求量較大。它除了具有與VC相同的活性外[6],還具有良好的穩(wěn)定性和安全性,優(yōu)異的抗氧化性,容易被人體吸收,可用于化妝品、醫(yī)藥、食品等領(lǐng)域[7],具有巨大的開發(fā)價值。
目前,AA-2G 的合成以生物酶法為主,與化學(xué)法相比生物法更高效,反應(yīng)條件溫和,可用于連續(xù)生產(chǎn),更適合工業(yè)化生產(chǎn)[8]。用于合成AA-2G 的酶有α-葡萄糖苷酶[9]、環(huán)糊精葡萄糖基轉(zhuǎn)移酶[10](Cyclodextrin glucosyltransferase,CGTase)、淀粉酶[11]、蔗糖磷酸化酶[12]和α-異麥芽糖基葡萄糖形成酶[13]。其中,CGTase 是一種多功能酶,且作為一種工業(yè)用酶,因其具有底物特異性高和轉(zhuǎn)化率高等優(yōu)點,被認為是合成AA-2G 最高效的酶,是催化合成AA-2G 的酶中應(yīng)用最廣、研究最多的一種酶,已被廣泛用于AA-2G 工業(yè)生產(chǎn)[14]。其合成原理是將糖基供體的糖苷鍵轉(zhuǎn)移至糖基受體的C2 位點上生成中間產(chǎn)物AA-2Gn(n≤6),然后添加糖化酶水解混合物產(chǎn)生AA-2G 和其他副產(chǎn)物[15]。CGTase 能將多種糖基供體用于AA-2G 的合成,但產(chǎn)量受糖基供體的影響較大[16]。目前CGTase 催化合成AA-2G 存在轉(zhuǎn)化率低、酶產(chǎn)量低等問題,導(dǎo)致AA-2G 的生產(chǎn)成本高,限制了其廣泛應(yīng)用[17]。所以優(yōu)化AA-2G 的合成是目前研究的熱點,如利用分子半侶共表達[18],增加異源蛋白的可溶性表達,從而提高合成產(chǎn)量;余磊等[19]用全細胞催化方法生產(chǎn)AA-2G,產(chǎn)量達到了35.7 g/L;郭嬌梅[20]對CGTase 進行固定化后制備AA-2G,使酶可以重復(fù)利用并增強其穩(wěn)定性;對CGTase 進行分子改造[21?26],提高酶的熱穩(wěn)定性和對底物的特異性,提高合成產(chǎn)物的特異性和產(chǎn)量;為了提高AA-2G 作為抗氧化劑的有效性,Violaine 等[27]研究了AA-2G和輔助抗氧化劑的協(xié)同作用。此外,有研究表明環(huán)糊精為AA-2G 合成的最優(yōu)糖基供體[28],但由于環(huán)糊精價格昂貴導(dǎo)致生產(chǎn)成本過高,不適于大規(guī)模的工業(yè)生產(chǎn),故選擇成本低的糖基供體對AA-2G 的生產(chǎn)具有重要意義。
目前國內(nèi)缺少可用于AA-2G 工業(yè)化生產(chǎn)的酶,市場上的兩種商品化CGTase 僅由國外提供,價格十分昂貴,特別是在化妝品領(lǐng)域中,AA-2G 大部分來源于日本林原國際有限公司,占據(jù)壟斷地位。因此需要挖掘和改造適合生產(chǎn)AA-2G 的CGTase,本實驗室以前期構(gòu)建的重組表達菌株為研究對象,首次將其用于AA-2G 的合成,探究其合成效果,同時,對合成AA-2G 的反應(yīng)條件進行單因素優(yōu)化,選擇合適且成本低的糖基供體,確定最適的合成條件,以提高AA-2G 的產(chǎn)量,為尋找合適的工業(yè)用酶,加快工業(yè)化生產(chǎn)提供參考意義。
1 材料與方法
1.1 材料與儀器
重組菌株pET-28a(+)-cgt-T1/BL21(DE3)為本實驗室構(gòu)建保存[29];4,6-亞乙基-對硝基苯-α-D-麥芽七糖苷(4,6-Ethylidene-p-nitrobenzene-α-D-maltopeptide,EPS)、異丙基-β-D-硫代半乳糖糖苷(Isopropylbeta-D-thiogalactoside,IPTG)、AA-2G 和VC標(biāo)準(zhǔn)品 上海源葉生物科技有限公司;甲醇 色譜純,美國TEDDIA 公司;VC、可溶性淀粉和葡萄糖 國藥集團化學(xué)試劑有限公司;考馬斯亮藍R250、酚酞 天津天力化學(xué)試劑有限公司;α-環(huán)糊精(Cyclodextrin,α-CD)、β-環(huán)糊精(Cyclodextrin,β-CD)、γ-環(huán)糊精(Cyclodextrin,γ-CD)梯希愛化成工業(yè)發(fā)展有限公司;α-葡萄糖苷酶、糖化酶(100 U/mg)、牛血清白蛋白北京索萊寶科技有限公司;硫酸卡那霉素(Kanamycin sulfate,Kana)、麥芽糊精、麥芽糖 上海麥克林生化科技有限公司;酵母提取物、胰蛋白胨 英國OXOID 公司;所用無機試劑和有機溶劑均為國產(chǎn)分析純;LB 培養(yǎng)基:酵母提取物5.0 g,胰蛋白胨10.0 g,氯化鈉10.0 g 溶解到1 L 去離子水,使用NaOH 調(diào)節(jié)pH 至7.0~7.2,121 ℃滅菌20 min。
TE3102S,TE124S 電子分析天平 德國賽多利斯公司;MJ-54A 高壓滅菌鍋 美國施都凱公司;TU1900 紫外分光光度計 北京普析公司;IS-RDS3恒溫搖床 美國Crystal 公司;SPX-250B-Z 生化培養(yǎng)箱 上海博迅實業(yè)有限公司;5417R 超速冷凍離心機 德國Fritsch 公司;SCIENTZ-IID 超聲波細胞粉碎機 寧波新芝生物科技股份有限公司;DYCZ-24DN 雙垂直電泳槽、DYY-8C 型電泳儀電源 北京市六一儀器廠;Gel Doc EZ 凝膠圖像儀 美國BIO-RAD 公司;Ni-NTA His Bind Resin 親和純化柱 上海七海復(fù)泰生物科技有限公司;Millipore 超濾離心管 上海羽令過濾器材有限公司;PB-10 pH計 德國賽多利斯公司;HH-4 水浴鍋 金壇市杰瑞爾電器有限公司;X-30R 離心機 美國Beckman 公司;Water e2695 HPLC 高效液相儀 美國Water 公司;Enspire 酶標(biāo)儀 鉑金埃爾默企業(yè)管理(上海)有限公司。
1.2 實驗方法
1.2.1 重組菌株誘導(dǎo)表達及粗酶純化 在前期研究中確定了最佳誘導(dǎo)條件[29],把重組菌株接種至30 mL 含終濃度為50 μg/mL Kana 的LB 液體培養(yǎng)基中,37 ℃,200 r/min 過夜培養(yǎng),然后按1%接種量轉(zhuǎn)接至1 L 含終濃度為50 μg/mL Kana 的LB 液體培養(yǎng)基中,當(dāng)菌體濃度OD600達到0.80 時,添加終濃度為0.30 mmol/L 的IPTG 溶液,25 ℃,200 r/min 條件下,培養(yǎng)10 h。在4 ℃,10000 r/min 離心5 min,用0.01 mol/L PBS 緩沖液懸浮細胞,得到菌懸液,冰浴中超聲破碎,參數(shù)設(shè)置75%功率(總功率500 W),工作3 s,間歇6 s,總時長35 min。4 ℃,10000 r/min離心15 min,收集上清,即為粗酶液。
使用Ni-NTA His Bind Resin 親和純化柱,參照七海生物產(chǎn)品說明書對粗酶液進行純化。然后將目的蛋白流出液置于超濾離心管中,4 ℃,5000 r/min,離心40 min,進行除鹽和蛋白濃縮,得到純化酶,于?20 ℃保存。用SDS-PAGE 分析純化酶,使用10%的分離膠和5%的濃縮膠,取適量純化酶加入上樣緩沖液,混勻,煮沸10 min,8000 r/min 離心6 min,取上清液10 μL 上樣,5 μL Marker,80 V 電泳25 min,調(diào)電壓至120 V,電泳1 h 左右,然后將凝膠用考馬斯亮藍R250 染色液染色,再用脫色液脫色,最后用凝膠圖像儀觀察結(jié)果。采用Bradford 法[30]測定純化酶濃度,用于后續(xù)比酶活的測定。
1.2.2 純化酶β-環(huán)化活性的測定 參考Tesfai 等[31]的方法,對其稍加修改,測定其酶活與比酶活。取0.10 mL 適當(dāng)稀釋的純化酶液(0.01~0.03 mg/mL),加入1.00 mL 的4%(w/v)淀粉溶液(使用pH6.0 的10 mmol/L 磷酸鹽緩沖液配置),混勻,65 ℃水浴反應(yīng)10 min,加入3.50 mL 30 mmol/L NaOH 溶液終止反應(yīng),再向混合物中加入0.50 mL 0.02%(w/v)酚酞溶液,室溫靜置15 min,550 nm 處測量吸光度。以蒸餾水為空白調(diào)零,滅活酶液為對照。一個酶活單位(U)的定義為上述條件下每分鐘生成1 μmolβ-環(huán)糊精的酶量。
1.2.3 純化酶歧化活性的測定 參考Vanderveen 等[32]的方法,對其稍加修改,測定其酶活與比酶活。取1.00 mL 6 mmol/L 的EPS 和10 mmol/L 的 麥芽糖(用10 mmol/L pH6.0 磷酸鹽緩沖液配制)的混合底物,65 ℃預(yù)熱10 min 后,加入0.10 mL 適當(dāng)稀釋的純化酶液(0.01~0.03 mg/mL),65 ℃反應(yīng)10 min,取0.10 mL 混合反應(yīng)物,加入20 μL 1.20 mol/L 的HCl溶液(4 ℃),60 ℃孵育10 min 失活,再加入20 μL 1.20 mol/L 的NaOH 溶液中和后,添加60 μLα-葡萄糖苷酶(1 U,使用10 mmol/L pH7.0 磷酸緩沖液溶解),37 ℃反應(yīng)1 h,最后加入1.00 mL 1 mol/L Na2CO3溶液(調(diào)pH 至8 以上),401 nm 測定吸光度。以蒸餾水為空白調(diào)零,滅活酶液為對照。一個酶活單位(U)的定義為上述條件下每分鐘轉(zhuǎn)化1 μmol EPS 的酶量。
1.2.4 AA-2G 的酶法合成 參考韓瑞枝[33]的方法,將純化后的環(huán)糊精葡萄糖基轉(zhuǎn)移酶用10 mmol/L乙酸-乙酸鈉緩沖液(pH5.0)稀釋到蛋白質(zhì)濃度為1.00 mg/mL,以5%(w/v)的純化酶液加入底物終濃度均為10 g/L 的VC和β-CD(糖基供體)的等比例(VC/糖基供體)混合的底物中(底物溶液使用10 mmol/L pH5.0 乙酸鈉緩沖液配制,VC溶液使用20% NaOH溶液調(diào)pH 至5.0),混合均勻,反應(yīng)pH 為5.0。將混合物置于37 ℃(反應(yīng)溫度)、黑暗、無氧的條件下恒溫反應(yīng)24 h(反應(yīng)時間)。最后將10 U 糖化酶(使用與配制底物相同的緩沖液進行配制)加入到反應(yīng)混合物中,在60 ℃的條件下靜置24 h,使中間體AA-2Gn(其中n 是連接到L-抗壞血酸的糖基的數(shù)目)水解,最終得到AA-2G。
1.2.5 AA-2G 的標(biāo)準(zhǔn)曲線及定性與定量檢測 取5.00 mg AA-2G 標(biāo)準(zhǔn)品用pH2.5 的0.01 mmol/L 磷酸緩沖液定容至5 mL 容量瓶中,配制成1.00 g/L 的標(biāo)準(zhǔn)品溶液。再用標(biāo)準(zhǔn)品溶液和pH2.5 的0.01 mmol/L磷酸緩沖液配制濃度分別為0、0.025、0.05、0.10、0.20、0.40、0.60 和0.80 g/L 的AA-2G 溶液。采用HPLC 色譜法檢測AA-2G[33],色譜柱:Inertsil ODS-3 C18柱(5 μm,250×4.60 mm);紫外檢測波長:238 nm;流動相:2%的甲醇和98% 0.01 mmol/L 磷酸緩沖液(85%磷酸調(diào)pH 至2.5);流速:0.60 mL/min,進樣量:10 μL;柱溫:25 ℃。HPLC 圖譜中AA-2G 的峰面積(uV·S)和濃度(g/L)成正比,以AA-2G 的峰面積為縱坐標(biāo),AA-2G 濃度為橫坐標(biāo),繪制標(biāo)準(zhǔn)曲線。得到標(biāo)準(zhǔn)曲線公式:y=25901377x+24727,回歸系數(shù)R2=0.9994,可信度較高。
將反應(yīng)結(jié)束后的反應(yīng)混合物適當(dāng)稀釋,8000 r/min,離心10 min,取上清液,并使用0.22 μm 濾膜過濾,得到反應(yīng)液樣品,與AA-2G 和VC的標(biāo)準(zhǔn)品同時進行HPLC 檢測,參數(shù)同上。根據(jù)得到的色譜圖數(shù)據(jù),對比標(biāo)準(zhǔn)品與反應(yīng)液樣品出峰時間是否一致,對AA-2G 進行定性分析;將反應(yīng)液樣品AA-2G 的峰面積代入標(biāo)準(zhǔn)曲線公式,得出AA-2G 的濃度,對AA-2G 進行定量分析。
1.2.6 AA-2G 的酶法合成條件初探 各因素的實驗水平設(shè)計均參考宋凱[34]的方法,對其稍加修改。
1.2.6.1 糖基供體對反應(yīng)的影響 將AA-2G 酶法合成的糖基供體β-CD 分別更換為α-CD,β-CD,γ-CD,可溶性淀粉,麥芽糊精,麥芽糖和葡萄糖,其他條件與1.2.4 相同,反應(yīng)產(chǎn)物使用HPLC 色譜法檢測AA-2G 的含量。
1.2.6.2 底物濃度對反應(yīng)的影響 將AA-2G 酶法合成的底物終濃度分別更換為10、30、50、70、90 和110 g/L 的VC和糖基供體(可溶性淀粉和麥芽糊精),其他條件與1.2.4 相同,反應(yīng)產(chǎn)物使用HPLC 色譜法檢測AA-2G 的含量,計算AA-2G 生成率。由于底物濃度不同,無法進行AA-2G 含量的比較,故選用AA-2G 生成率作為此優(yōu)化因素的比較依據(jù)。
AA-2G 生成率計算公式:
式中:A:不同底物濃度下AA-2G 生成率,%;c:對應(yīng)條件下生成AA-2G 的含量,g/L;a:對應(yīng)條件下底物VC的含量,g/L。
1.2.6.3 pH 對反應(yīng)的影響 在最適底物濃度下,將AA-2G 酶法合成的反應(yīng)pH 分別更換為4.0、4.5、5.0、5.5、6.0(用10 mmol/L 的乙酸-乙酸鈉緩沖液配制底物溶液)6.0、6.5、7.0(用0.01 mmol/L 磷酸緩沖液配制底物溶液),其他條件與1.2.4 相同,反應(yīng)產(chǎn)物使用HPLC 色譜法檢測AA-2G 的含量。
1.2.6.4 溫度對反應(yīng)的影響 在最適底物濃度和pH下,將AA-2G 酶法合成的反應(yīng)溫度分別更換為23、30、37、44 和51 ℃,其他條件與1.2.4 相同,反應(yīng)產(chǎn)物使用HPLC 色譜法檢測AA-2G 的含量。
1.2.6.5 底物比例對反應(yīng)的影響 在最適pH 和溫度下,將AA-2G 酶法合成的底物比例(VC/糖基供體)分別更換為1/5、2/4、3/3、4/2、5/1,其他條件與1.2.4相同,反應(yīng)產(chǎn)物使用HPLC 色譜法檢測AA-2G 的含量。
1.2.6.6 蛋白濃度對反應(yīng)的影響 在最適pH,溫度和底物比例下,將AA-2G 酶法合成的蛋白濃度分別更換為1.0、5.0、10.0、15.0 和20.0 mg/mL,其他條件與1.2.4 相同,反應(yīng)產(chǎn)物使用HPLC 色譜法檢測AA-2G 的含量。
1.2.6.7 時間對反應(yīng)的影響 在最適pH,溫度,底物比例和蛋白濃度下,將AA-2G 酶法合成的反應(yīng)時間分別更換為0、6、12、18、24、30、36 和42 h,其他條件與1.2.4 相同,反應(yīng)產(chǎn)物使用HPLC 色譜法檢測AA-2G 的含量。
1.2.7 AA-2G 的酶法合成動力學(xué)分析 將糖基供體的不同底物濃度(2.0、4.0、8.0、16.0 g/L)進行固定,測定其不同濃度下VC(4.0、8.0、16.0、20.0、32.0 g/L)合成AA-2G 的產(chǎn)量,在最適反應(yīng)溫度和pH 下,反應(yīng)6 h,根據(jù)下面的公式[33],計算出合成AA-2G 的動力學(xué)參數(shù)。
乒乓反應(yīng)機制:
式中:V:不同底物濃度下的反應(yīng)速率(每毫克酶每小時催化生成AA-2G 的量),g/L/mg/h;Vmax:反應(yīng)的最大速率,g/L/mg/h;a:受體(VC)的濃度,g/L;b:糖基供體(麥芽糊精/可溶性淀粉)的濃度,g/L;KmA:VC的親和常數(shù);KmB,糖基供體的親和常數(shù);KiB:底物糖基供體的抑制常數(shù)。
1.3 數(shù)據(jù)處理
酶活性測定實驗每個反應(yīng)重復(fù)3 次,單因素優(yōu)化實驗每個反應(yīng)設(shè)置2 個平行,數(shù)據(jù)以平均數(shù)±標(biāo)準(zhǔn)差(mean±SD)表示。利用Excel 2019 進行數(shù)據(jù)處理和繪圖,利用SPSS 19.0 軟件進行數(shù)據(jù)統(tǒng)計分析,顯著性水平P<0.05。
2 結(jié)果與分析
2.1 CGTase-T1 的純化
CGTase-T1 經(jīng)純化和脫鹽濃縮后,得到了分子量為75 kDa 的單一條帶(圖1),與大多數(shù)CGTase 的分子量相符[35],說明得到了純化的環(huán)糊精葡萄糖基轉(zhuǎn)移酶。
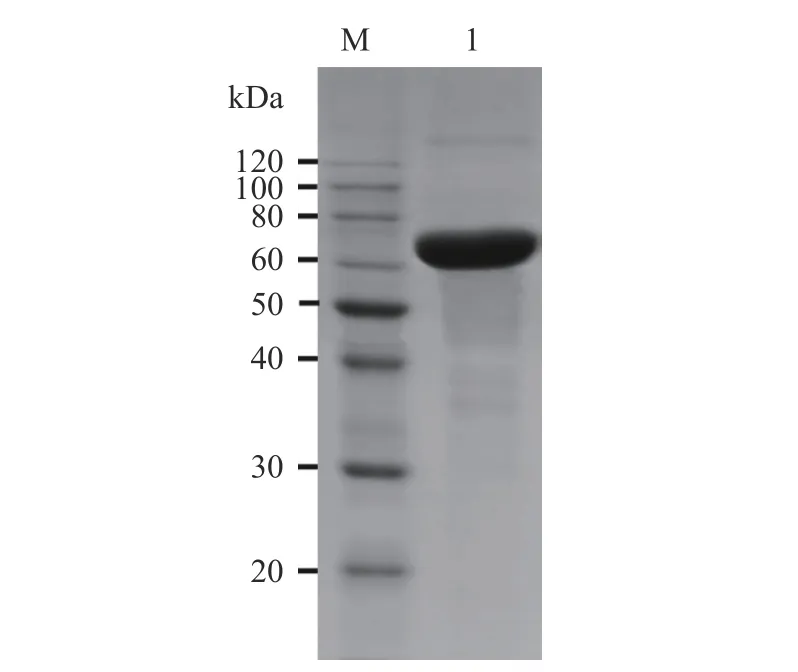
圖1 純化CGTase-T1 的SDS-PAGE 電泳圖Fig.1 SDS-PAGE electropherogram of purified CGTase-T1
2.2 酶活性測定
分別測定了純化酶的β-環(huán)化活性和歧化活性,測得純化酶的濃度為7.368 mg/mL,經(jīng)計算得出其酶活與比酶活。如表1 所示,β-環(huán)化反應(yīng)的酶活性最高,比酶活可達1169.40 U/mg。大多數(shù)的CGTase以環(huán)化反應(yīng)為主活性,與本文結(jié)果相同,可能是由于CGTase 更喜歡吸附淀粉分子內(nèi)部的α-1,4 鏈,然后轉(zhuǎn)移新形成的寡聚糖的還原端到自身的非還原端,產(chǎn)生α-1,4 環(huán)[36]。而且環(huán)化反應(yīng)是CGTase 的特征反應(yīng),是一種分子內(nèi)轉(zhuǎn)糖基反應(yīng),原理是將直鏈麥芽低聚糖上非還原末端的O-4 或C-4 轉(zhuǎn)移到同一直鏈上還原末端的C-1 或O-1 上,形成6-8 個糖基的環(huán)狀結(jié)構(gòu)[37]。

表1 酶反應(yīng)的環(huán)化和歧化反應(yīng)的活性Table 1 Activity of cyclization and disproportionation reactions of enzymatic reactions
2.3 AA-2G 的定性與定量測定
使用HPLC 色譜法分析AA-2G 的含量,由于VC與AA-2G 的結(jié)構(gòu)相似度較高,在238 nm 處均有吸光度,由圖2 所示,反應(yīng)樣品AA-2G 和VC的出峰時間分別為9.6 min 和8.9 min,與標(biāo)準(zhǔn)品的出峰時間一致,表明CGTase-T1 具有合成AA-2G 的能力。根據(jù)AA-2G 標(biāo)準(zhǔn)曲線,計算所得反應(yīng)樣品中AA-2G 含量為0.67 g/L,合成產(chǎn)量較低,剩余大量的VC未被消耗,說明糖基受體VC未得到來自糖基供體的糖苷鍵,未生成大量中間體合成產(chǎn)物。據(jù)報道,經(jīng)反應(yīng)條件優(yōu)化后,來源于Bacillus alkalophilus7-12[38]、Paenibacillussp.[39]、Bacillussp.SK 13.002[40]、Bacillus agaradhaerensY112[41]、Paenibacillus macerans154[42]、Anaerobranca gottschalkii[43]、Bacillus circulans251[43]和Thermoanaerobactersp.[44]的CGTase合成產(chǎn)量分別為0.095、2.98、5.50、10.60、17.50、28.90、35.70 和143.00 g/L,與大多用于合成AA-2G的CGTase 相比,CGTase-T1 的合成產(chǎn)量較低,所以對其反應(yīng)條件進行優(yōu)化,探究其合成AA-2G 的潛力。

圖2 標(biāo)準(zhǔn)品和反應(yīng)樣品的HPLC 圖Fig.2 HPLC profile of standard and reaction samples
2.4 AA-2G 酶法合成條件初探
2.4.1 糖基供體對反應(yīng)的影響 CGTase 可與不同糖基供體生成AA-2G,故尋找合適的糖基供體可增加AA-2G 的產(chǎn)量。由圖3 所示,最適糖基供體為α-CD,其次為γ-CD、可溶性淀粉和麥芽糊精。據(jù)報道,可用于合成AA-2G 的大多數(shù)CGTase 的最適糖基供體為α-CD,它與CGTase 有著較高的專一性,致使其轉(zhuǎn)化率高于其他糖基供體[45],而γ-CD 雖然有較高的溶解度和較大的空腔能包接較大的分子[36],但當(dāng)α-CD 和γ-CD 用于AA-2G 合成時,會導(dǎo)致生產(chǎn)成本過高,不利于AA-2G 的大規(guī)模工業(yè)生產(chǎn)。各組之間均存在顯著性差異,根據(jù)結(jié)果,為降低生產(chǎn)成本,故選用價格便宜的可溶性淀粉和麥芽糊精作為糖基供體,用于后續(xù)實驗。

圖3 不同糖基供體對合成反應(yīng)的影響Fig.3 The effect of different glycosyl donors on the synthesis reaction
2.4.2 底物濃度對反應(yīng)的影響 為考察底物濃度對AA-2G 合成的影響,選用了不同底物濃度用于AA-2G 的合成。由圖4 所示,當(dāng)糖基供體為可溶性淀粉時,最適底物濃度為70 g/L,AA-2G 的生成率最高;當(dāng)糖基供體為麥芽糊精時,最適底物濃度為30 g/L,AA-2G 的生成率最高。同時,發(fā)現(xiàn)在底物濃度過高,如麥芽糊精的濃度超過30 g/L 時,會抑制AA-2G 的合成,導(dǎo)致AA-2G 生成率下降,可能與底物抑制反應(yīng)機制有關(guān)[33]。各組之間只有可溶性淀粉作為糖基供體時,110 g/L 組與30、90 g/L 兩組之間沒有顯著性差異,根據(jù)結(jié)果,最終選擇可溶性淀粉反應(yīng)的最適底物濃度為70 g/L,麥芽糊精反應(yīng)的最適底物濃度為30 g/L。

圖4 不同底物濃度對合成反應(yīng)的影響Fig.4 Effects of different substrate concentrations on the synthesis reaction
2.4.3 pH 對反應(yīng)的影響 為考察pH 對AA-2G 合成的影響,選用了不同pH 的緩沖液用于AA-2G 的合成。由圖5 所示,當(dāng)可溶性淀粉為糖基供體時,最適pH 為4.5,當(dāng)pH 大于4.5 之后,AA-2G 的產(chǎn)量近乎直線下降;當(dāng)麥芽糊精為糖基供體時,最適pH 為5.0,當(dāng)pH 大于5.0 之后,AA-2G 的產(chǎn)量減少到與pH4.5 時基本相同。結(jié)果表明,該酶是一種酸性CGTase,隨著pH 的增加,對AA-2G 的合成影響增大,與宋凱[34]的研究結(jié)果相一致。可能是VC在高pH 下不穩(wěn)定[17],在不同pH 條件下底物分子和酶分子的帶電狀態(tài)不同,從而影響酶和底物的結(jié)合,影響酶的穩(wěn)定性[46],導(dǎo)致AA-2G 的產(chǎn)量變低。各組之間均存在顯著性差異,根據(jù)結(jié)果,最終選擇可溶性淀粉的最適反應(yīng)pH 為4.5,麥芽糊精的最適反應(yīng)pH 為5.0。

圖5 不同pH 對合成反應(yīng)的影響Fig.5 The effect of different pH on the synthesis reaction
2.4.4 溫度對反應(yīng)的影響 為考察溫度對AA-2G合成的影響,選用了不同溫度用于AA-2G 的合成。由圖6 所示,當(dāng)可溶性淀粉和麥芽糊精為糖基供體時,最適溫度均為37 ℃。當(dāng)溫度低于37 ℃時,AA-2G 產(chǎn)量隨溫度的上升而增加,而當(dāng)溫度高于37 ℃時,AA-2G 的產(chǎn)量明顯下降。可能是溫度過低不利于CGTase 的活性反應(yīng),而當(dāng)溫度過高時VC會降解[17],AA-2G 在高溫時也會容易分解[47],均導(dǎo)致AA-2G 產(chǎn)量降低。而單麗媛等[48]以可溶性淀粉和VC為底物,其反應(yīng)最適溫度為15 ℃,相比而言,其最適溫度較低,可能是由于酶的來源不同,在低溫下其活性較高。各組之間均存在顯著性差異,根據(jù)結(jié)果,最終選擇可溶性淀粉和麥芽糊精的最適反應(yīng)溫度均為37 ℃。

圖6 不同溫度對合成反應(yīng)的影響Fig.6 The effect of different temperatures on the synthesis reaction
2.4.5 底物比例對反應(yīng)的影響 為考察底物比例對AA-2G 合成的影響,選用了不同底物比例用于AA-2G 的合成。由圖7 所示,當(dāng)可溶性淀粉為糖基供體時,最適底物比例為3/3(VC/糖基供體,w/w),為等比比例;當(dāng)麥芽糊精為糖基供體時,最適底物比例為4/2(VC/糖基供體,w/w),為倍比比例。結(jié)果表明,不同的糖基供體用于AA-2G 合成時,它們的底物比例會有所差異,可能是因為酶對底物的特異性不同,且底物比例過高或過低都容易造成低含量底物供應(yīng)不足,而不利于AA-2G 的合成,與黃燕等[49]對底物比例優(yōu)化的結(jié)果一致。各組之間均存在顯著性差異,根據(jù)結(jié)果,最終選擇可溶性淀粉反應(yīng)的最適底物比例為3/3,麥芽糊精反應(yīng)的最適底物比例為4/2。

圖7 不同底物比例對合成反應(yīng)的影響Fig.7 The effect of different substrate ratios on the synthesis reaction
2.4.6 蛋白濃度對反應(yīng)的影響 為考察蛋白濃度對AA-2G 合成的影響,選用了不同蛋白濃度用于AA-2G 的合成。由圖8 所示,當(dāng)可溶性淀粉和麥芽糊精為糖基供體時,最適蛋白濃度均為5.0 mg/mL。當(dāng)?shù)鞍诐舛瘸^5.0 mg/mL 時,AA-2G 的產(chǎn)量逐漸下降,表明過高的蛋白濃度不利于AA-2G 的合成。隨著加酶量的增加,AA-2G 的產(chǎn)量并沒有增加,可能是因為CGTase 是一種多功能酶,可以催化4 種反應(yīng),其中歧化反應(yīng)和耦合反應(yīng)可以降解糖基供體產(chǎn)生小分子糖,隨著加酶量的增加,這2 種反應(yīng)強度增強,小分子糖增多,而小分子糖的存在會使得該酶的耦合反應(yīng)加劇,使小分子糖無法與受體結(jié)合,從而降低AA-2G 的產(chǎn)量[32]。各組之間均存在顯著性差異,根據(jù)結(jié)果,最終選擇可溶性淀粉和麥芽糊精反應(yīng)的最適蛋白濃度均為5.0 mg/mL。

圖8 不同蛋白濃度對合成反應(yīng)的影響Fig.8 The effect of different protein concentrations on the synthesis reaction
2.4.7 時間對反應(yīng)的影響 為考察時間對AA-2G合成的影響,選用了不同的反應(yīng)時間合成AA-2G。由圖9 所示,AA-2G 的產(chǎn)量隨著反應(yīng)時間的增加而逐漸增加。當(dāng)可溶性淀粉為糖基供體時,反應(yīng)42 h后AA-2G 的產(chǎn)量達到最高(12.68 g/L);當(dāng)麥芽糊精為糖基供體時,反應(yīng)30 h 后AA-2G 的產(chǎn)量達到最高(4.96 g/L),它們分別是未優(yōu)化反應(yīng)條件產(chǎn)量的18.93倍和7.40 倍。在反應(yīng)初期處于消耗底物的快速反應(yīng)期,6 h 后開始逐漸變得平緩,反應(yīng)后期隨著底物和酶的消耗反應(yīng)逐漸停止,可溶性淀粉作為糖基供體時,初始合成速度更快,合成產(chǎn)量更高,可能是由于不同糖基供體對酶的親和力不同而影響了反應(yīng)的快慢和合成的產(chǎn)量[45],而且較少的反應(yīng)時間和較高的產(chǎn)量有利于降低生產(chǎn)成本,提高反應(yīng)效率。各組之間均存在顯著性差異,根據(jù)結(jié)果,最終選擇可溶性淀粉的最適反應(yīng)時間為42 h,麥芽糊精的最適反應(yīng)時間為30 h。

圖9 不同反應(yīng)時間對合成反應(yīng)的影響Fig.9 The effect of different reaction times on the synthesis reaction
2.5 AA-2G 的酶法合成動力學(xué)分析
為考察CGTase-T1 合成AA-2G 的動力學(xué),選用了不同濃度的底物用于AA-2G 的合成。經(jīng)數(shù)據(jù)擬合后,得到CGTase-T1 合成AA-2G 反應(yīng)的Lineweaver-Burk 曲線(圖10)。線性擬合結(jié)果符合底物抑制反應(yīng)機制,表明底物會對AA-2G 的合成產(chǎn)生抑制作用。帶入其公式中,得到酶法合成AA-2G 的動力學(xué)參數(shù),由表2 所示,可溶性淀粉的Kcat值高于麥芽糊精,表明可溶性淀粉合成AA-2G 反應(yīng)中的催化效率較高,致使其合成AA-2G 的產(chǎn)量高于麥芽糊精。而且可溶性淀粉的KmA高于麥芽糊精,表明在不同糖基供體合成時,酶對不同底物的特異性不同,會影響CGTase-T1 與底物的親和力,可能與底物作用力有關(guān)[50],故選用合適的糖基供體有利用AA-2G 的產(chǎn)量的增加。

表2 動力學(xué)參數(shù)Table 2 Kinetic parameters

圖10 麥芽糊精(a)和可溶性淀粉(b)合成AA-2G 反應(yīng)的Lineweaver-Burk 曲線Fig.10 Lineweaver-Burk curve of maltodextrin (a) and soluble starch (b) synthesis of AA-2G
3 結(jié)論
本研究將異源表達的CGTase-T1 用于合成AA-2G,經(jīng)高效液相色譜法分析后,得到含量為0.67 g/L的AA-2G,合成量較少。為增加CGTase-T1 合成AA-2G 的產(chǎn)量,依次對糖基供體、底物濃度、反應(yīng)pH、反應(yīng)溫度、底物比例、蛋白濃度和反應(yīng)時間進行了單因素優(yōu)化。當(dāng)糖基供體為可溶性淀粉時,AA-2G 最優(yōu)合成條件是:底物濃度70 g/L,反應(yīng)pH4.5,反應(yīng)溫度37 ℃,底物比例3/3(VC/糖基供體),蛋白濃度5.0 mg/mL,反應(yīng)時間42 h;當(dāng)糖基供體為麥芽糊精時,AA-2G 最優(yōu)合成條件是:底物濃度30 g/L,反應(yīng)pH5.0,反應(yīng)溫度37 ℃,底物比例4/2,蛋白濃度5.0 mg/mL,反應(yīng)時間30 h。在最適條件下,AA-2G 的最高產(chǎn)量分別為12.68 g/L 和4.96 g/L,是未優(yōu)化反應(yīng)條件下的18.93 倍和7.40 倍。同時,對其合成AA-2G 的動力學(xué)分析進行分析,發(fā)現(xiàn)糖基供體可溶性淀粉的催化效率高于麥芽糊精,致使其AA-2G 的產(chǎn)量較高,表明此酶對可溶性淀粉的特異性優(yōu)于麥芽糊精,可溶性淀粉更適合作為此酶的糖基供體合成AA-2G。
CGTase 是AA-2G 工業(yè)生產(chǎn)中主要用酶,但生產(chǎn)成本和轉(zhuǎn)化率限制了大規(guī)模AA-2G 的工業(yè)生產(chǎn),導(dǎo)致其價格昂貴。而本研究以可溶性淀粉和麥芽糊精作為AA-2G 合成的底物,降低了生產(chǎn)成本,可為其AA-2G 的工業(yè)化生產(chǎn)提供參考。但本研究仍存在蛋白可溶性表達量不足,產(chǎn)物特異性差異大、底物轉(zhuǎn)化率低、合成產(chǎn)量不足等問題,后續(xù)可將CGTase-T1 進行分子改造,改善酶的穩(wěn)定性和底物特異性,進一步提高AA-2G 的產(chǎn)量。

