術前中性粒細胞與淋巴細胞比值與卵巢癌手術患者預后的關系
董玉寧,范文英,李瓊瓊
洛陽市東方人民醫院婦產科,河南 洛陽 471003
卵巢癌為臨床常見的婦科惡性腫瘤,近年來,中國卵巢癌的發病率呈逐年升高趨勢[1-3]。早期卵巢癌多缺乏典型癥狀,隨著健康體檢的普及,卵巢癌的早期檢出率不斷提高。早期卵巢癌通過手術治療能夠獲得理想的預后,腹腔鏡手術屬于微創術式,能夠有效減輕患者的術后炎性反應,有利于卵巢癌患者的術后恢復[4-6]。部分中晚期卵巢癌患者可通過新輔助化療等綜合輔助治療獲得手術治療機會,但部分患者術后仍可出現疾病進展甚至死亡。卵巢癌手術患者的臨床分期、惡性程度、病理類型及自身免疫功能等均具有較大差異,導致圍手術期綜合治療方案也具有較大差異。因此,早期預測手術患者的預后,據此制訂圍手術期綜合治療方案,對延長患者的術后生存期、改善預后有重要意義。隨著臨床對惡性腫瘤相關研究的不斷深入,目前已認可,惡性腫瘤的發生、發展均與患者的炎性反應相關[7-8]。中性粒細胞與淋巴細胞比值(neutrophil-to-lymphocyte ratio,NLR)是全身炎性反應的一項重要評估指標,其表達水平可作為多種惡性腫瘤患者預后的評估指標。本研究探討術前NLR 與卵巢癌手術患者預后的關系,現報道如下。
1 資料與方法
1.1 一般資料
選取2019 年3 月至2021 年3 月洛陽市東方人民醫院收治的卵巢癌患者。納入標準:①符合《卵巢惡性腫瘤診斷與治療指南(第四版)》[9]中關于卵巢癌的診斷標準,經術后病理學檢查確診為卵巢癌;②依據國際婦產科聯盟(International Federation of Gynecology and Obstetrics,FIGO)分期[10]進行臨床分期;③在洛陽市東方人民醫院接受手術治療;④術前或新輔助化療前空腹外周靜脈血NLR 檢測資料完整;⑤病歷資料完整。排除標準:①術前合并感染性疾病、創傷或既往14 天內接受過其他手術治療;②合并免疫系統疾病或免疫功能異常;③術前存在營養不良;④術前3 個月內有免疫抑制類藥物應用史;⑤術后未能完成相關治療;⑥術后1 年內未能按時復查或接受隨訪;⑦合并溝通障礙、認知功能障礙和精神疾病。依據納入和排除標準,本研究共納入104 例卵巢癌患者,年齡54~65 歲,平均(56.98±5.12)歲;病理類型:漿液性囊腺癌56 例,黏液性囊腺癌7 例,子宮內膜樣癌33 例,透明細胞癌8 例;分化程度:高分化11 例,中低分化93 例;FIGO 分期:Ⅰ~Ⅱ期29 例,Ⅲ~Ⅳ期75 例。本研究經醫院倫理委員會批準通過,所有患者均知情同意。
1.2 資料收集
收集104 例卵巢癌患者的一般資料,包括年齡、病理類型、分化程度、FIGO 分期、糖類抗原125(carbohydrate antigen 125,CA125)水平、術前NLR。以術后1 年內發現新發病灶、復發、轉移等疾病進展或癌因性死亡判定為預后不良。
1.3 統計學方法
采用SPSS 25.0 軟件對所有數據進行統計分析,計量資料經K-S 檢驗均呈正態分布,以均數±標準差(±s)表示,組間比較采用t檢驗;計數資料以例數和率(%)表示,組間比較采用χ2檢驗;卵巢癌患者預后的影響因素采用多因素Logistic 回歸分析;繪制受試者工作特征(receiver operating characteristic,ROC)曲線,計算曲線下面積(area under the curve,AUC),評估術前NLR 對卵巢癌手術患者預后的預測價值,AUC﹥0.9 為預測價值較高,0.7﹤AUC≤0.9 為預測價值中等,0.5≤AUC≤0.7 為預測價值較差,AUC﹤0.5 為基本無預測價值;以P﹤0.05 為差異有統計學意義。
2 結果
2.1 卵巢癌手術患者預后影響因素的單因素分析
104 例卵巢癌患者中,預后良好52 例,預后不良52 例。預后良好與預后不良卵巢癌手術患者年齡、病理類型、分化程度、CA125 水平比較,差異均無統計學意義(P﹥0.05)。預后良好與預后不良卵巢癌手術患者術前NLR、FIGO 分期比較,差異均有統計學意義(P﹤0.01)。(表1)

表1 卵巢癌手術患者預后影響因素的單因素分析
2.2 卵巢癌手術患者預后影響因素的多因素分析
將單因素分析中差異有統計學意義的術前NLR、FIGO 分期作為自變量,卵巢癌手術患者的預后情況作為因變量納入多因素Logistic 回歸分析,結果顯示,術前NLR 升高、FIGO 分期為Ⅲ~Ⅳ期均為卵巢癌手術患者預后不良的獨立危險因素(P﹤0.01)。(表2)

表2 卵巢癌手術患者預后影響因素的多因素Logistic 回歸分析
2.3 術前NLR 對卵巢癌手術患者預后的預測價值
術前NLR 預測卵巢癌手術患者預后的AUC為0.790(95%CI:0.703~0.877),預測價值中等,此時的靈敏度為57.69%,特異度為90.38%,cut-off 值為4.270。(圖1)
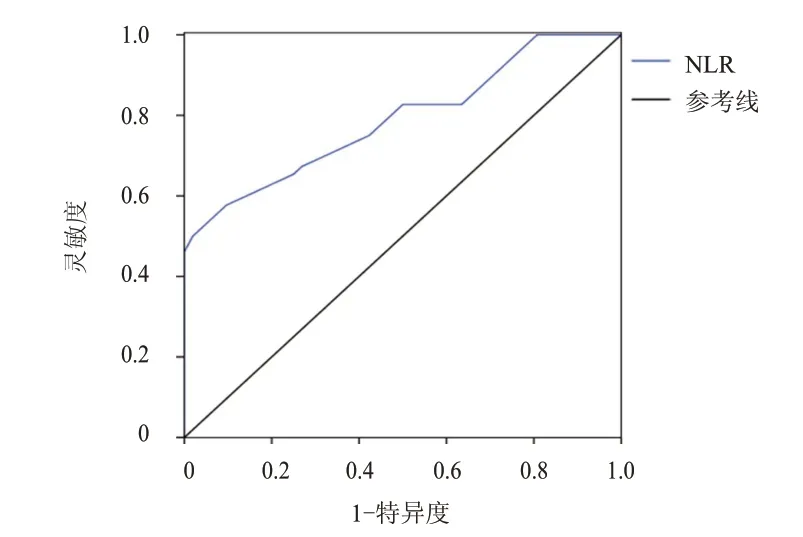
圖1 術前NLR預測卵巢癌手術患者預后的ROC曲線
3 討論
卵巢癌為女性生殖系統三大惡性腫瘤之一,具有較高的發病率及病死率[11-12]。卵巢癌患者的病情較為復雜,在相同FIGO 分期、相同病理類型的患者中,其疾病進展、預后情況也不盡相同。因此術前準確評估患者的預后,能夠為圍手術期綜合輔助治療方案的制訂提供重要指導[13-15]。近年來,隨著卵巢癌相關研究的逐步深入,臨床已經認識到慢性炎癥在卵巢癌的形成與演進中均發揮著重要的促進作用。炎癥可誘發局部細胞損傷與過氧化反應,促使前列腺素水平升高,繼而導致p53等基因發生突變從而促進腫瘤惡變與侵襲式生長。基因突變是惡性腫瘤發生發展的重要基礎,隨著惡性腫瘤細胞的生長,會進一步加重腫瘤周圍細胞的損傷從而加劇炎性反應,炎性反應標志物水平的檢測成為卵巢癌患者預后評估的新思路。
中性粒細胞與淋巴細胞均屬于血常規檢測中的白細胞分類[16-17]。中性粒細胞由骨髓合成,具有吞噬、趨化及殺菌作用。淋巴細胞為體積最小的一種白細胞,由淋巴器官合成,是免疫應答的主要細胞成分。淋巴細胞具有免疫識別能力,可分為T淋巴細胞、B 淋巴細胞、自然殺傷細胞等。術前NLR 與卵巢癌患者預后的關系目前尚無定論,但術前NLR 異常可為卵巢癌患者的預后評估做出參考,主要與以下3 個方面有關:①機體的抗腫瘤免疫能力主要取決于淋巴細胞,淋巴細胞計數減少可導致NLR異常,且淋巴細胞計數減少可導致免疫介導的腫瘤拮抗能力下降,為惡性腫瘤細胞的增殖、轉移提供了便利條件,因此可導致預后不良[18];②中性粒細胞可合成血管內皮生長因子(vascular endothelial growth factor,VEGF),惡性腫瘤在生長過程中可出現大量異常新生血管,VEGF 表達升高,能夠促進惡性腫瘤細胞的生長和轉移,因此中性粒細胞可出現異常升高,導致NLR 升高[19];③NLR 提示人體的免疫平衡機制,NLR 的升高提示免疫平衡機制被打破,導致抗腫瘤免疫反應與促腫瘤炎性反應間的平衡機制紊亂,促進了腫瘤細胞的生長、轉移[20]。
本研究結果表明,預后良好與預后不良卵巢癌手術患者術前NLR、FIGO 分期比較,差異均有統計學意義(P﹤0.01),提示預后不良患者術前已經存在不同程度的NLR 異常升高。多因素Logistic回歸分析結果顯示,術前NLR 升高、FIGO 分期為Ⅲ~Ⅳ期均為卵巢癌手術患者預后不良的獨立危險因素(P﹤0.01),提示術前NLR 異常升高提示卵巢癌患者可能預后不良。ROC 曲線分析結果進一步明確,術前NRL 預測卵巢癌手術患者預后的AUC 為0.790(95%CI:0.703~0.877),預測價值中等,此時的靈敏度為57.69%,特異度為90.38%,cutoff 值為4.270。提示術前NLR 作為卵巢癌患者預后不良的獨立危險因素應給予足夠的重視,當患者術前NLR≥4.270 時便可認為其是不良預后的高危患者,應考慮預后不良的可能,及時給予圍手術期綜合輔助治療是改善患者預后的重要方法。
營養狀態與患者的免疫功能密切相關,對于預后不良的高危患者應根據其具體情況給予圍手術期營養支持治療、免疫增強治療等,同時術后給予下肢靜脈血栓預防、創口感染預防等預防性治療,以避免術后炎性反應引起的免疫平衡紊亂加劇,對患者的預后造成不良影響。手術后疼痛等會引起患者生理和心理應激,導致機體產生非特異性全身反應,進而導致免疫功能抑制,釋放炎性介質[21]。因此,對于預后不良的高危患者給予心理疏導、術后鎮痛等干預有利于患者的術后恢復。且由于NLR檢測操作便捷、重復性好、易于開展,術前應加強對NLR 的檢測。
綜上所述,術前NLR≥4.270、FIGO 分期為Ⅲ~Ⅳ期均是卵巢癌手術患者不良預后的獨立危險因素,應根據患者的具體情況給予圍手術期綜合輔助治療,以改善患者的預后。

