氮離子注入對金蓮花種子發芽率及幼苗生理特性的影響
曹天光 張新旭 秦 壘 王 慧 耿金鵬
(河北工業大學生物物理研究所,天津 300401)
金蓮花(Trollius chinensisBunge)為毛茛科(Ranunculaceae)金蓮花屬多年生草本植物,分布于華北、東北等地區的海拔1 800 m 以上的高山草甸[1],其花、莖、葉均可入藥,主要藥用成分為黃酮類及生物堿類化合物[2],有良好的清熱去毒、抗菌消炎等作用[3-4],已被選為預防嚴重急性呼吸道綜合征疾病[5]和新型冠狀病毒肺炎[6]的中藥處方成分。目前由于過度采摘利用,野生金蓮花資源已經非常稀少,而人工栽培存在種質資源匱乏、種源繁殖系數低和品質下降等問題,產量不能滿足日益增長的市場需求。此外,金蓮花喜冷涼濕潤環境、根系淺、怕干旱、忌水澇,使人工栽培和引種繁殖面臨著一系列問題[7-8]。因此,利用現代育種技術對金蓮花進行品質改良,對豐富金蓮花種質資源以滿足市場需求具有重要意義。
離子束注入誘變育種技術利用加速的氣體離子(等離子體)轟擊生物材料,使之發生遺傳變異,從而創制出新的品種[9]。離子注入裝置的示意圖如圖1 所示。與傳統的X、γ 射線等輻射技術相比,離子束誘變具有作用效應局部、可控[10]、損傷輕、存活率和突變率高等特點[11-12],已越來越多地應用于谷物[13]、經濟作物[14]、花卉[15]等植物的誘變育種。
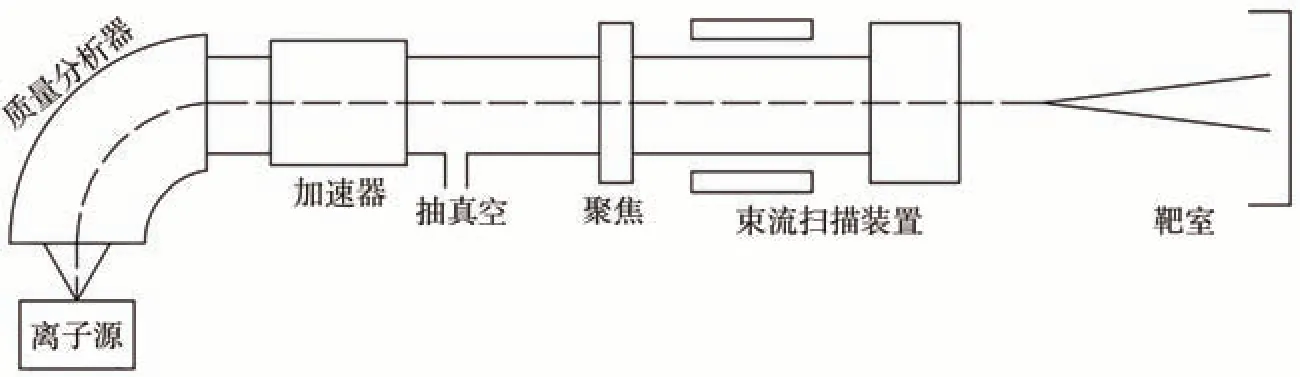
圖1 離子注入裝置示意圖Fig.1 Schematic diagram of ion implantation machine
前人研究表明,一定劑量的離子注入可刺激植物的生長發育。例如,張紅等[16]研究發現,低能量低劑量的氮離子注入可以增加大豆種子的活力,提高其發芽率。趙子睿等[17]發現30 keV 氮離子注入毛葉山桐子種子可顯著增加種子發芽率、幼苗株高、冠幅、葉片數等表觀性狀。李海金等[18]發現,低劑量氮離子注入紅小豆種子,顯著提升了紅小豆的株高、單株莢數等農藝性狀。離子注入作為一種非生物脅迫,會使植物體內產生大量的活性氧(reactive oxygen species,ROS),這些ROS 會攻擊生物大分子[19],引起蛋白質、核酸等的損傷。植物體會啟動自身的保護系統,誘導抗氧化系統的活性,進行自我修復,清除ROS,緩解氧化損傷[20]。同時抗氧化能力的增強有助于提高生物體抵御逆境的能力,從而保證正常的生理代謝[21]。吳座功等[22]將氮離子注入蒙古黃芪種子后,通過分析抗氧化酶發現,低劑量的離子注入有利于抗氧化酶的活化,促進種子萌發。張紅等[16]發現,一定劑量的氮離子注入大豆種子后,其植株的超氧化物歧化酶(superoxide dismutase,SOD)、過氧化物酶(peroxidase,POD)、過氧化氫酶(catalase,CAT)活性,可溶性蛋白含量都表現出明顯增加現象。黃洪云等[23]認為氮離子注入能有效提高干旱脅迫下玉米幼苗葉片脯氨酸含量、SOD 和POD 活性,從而增強玉米葉片的抗旱性。然而,關于氮離子注入對金蓮花生長發育的影響,目前鮮有研究報道。
因此,本研究以金蓮花種子為材料,通過低能氮離子注入金蓮花種子,探討氮離子注入對金蓮花種子萌發和幼苗生理特性的影響,以期為氮離子注入誘變金蓮花提供理論參考。
1 材料與方法
1.1 試驗材料
金蓮花種子采于河北省承德市圍場滿族蒙古族自治縣,經河北工業大學耿金鵬副教授鑒定為性狀穩定的野生金蓮花種子。
SOD、POD、CAT、過氧化氫(hydrogen peroxide,H2O2)測試試劑盒,北京索萊寶科技有限公司;Trizol,美國Invitrogen 公司;PrimeScriptTMRT reagent Kit(Perfect Real Time)、TB Green?Premix Ex TaqTMII(Tli RNaseH Plus)測試試劑盒,日本TaKaRa 公司;三氯乙酸(分析純)、牛血清蛋白(生物技術級,96%)、85%磷酸、考馬斯亮藍G250(分析純)、2-硫代巴比妥酸,阿拉丁試劑(上海)有限公司。
1.2 儀器與設備
5424R 冷凍高速離心機,德國Eppendorf 公司;SpectraMax i3x 酶標儀,美國Moleculer Devices 公司;CFX96 實時熒光定量PCR(quantitative real-time PCR,qRT-PCR)儀,美國Bio-Rad 公司;UV5Nano 超微量紫外可見分光光度計,美國Mettler Toledo 公司;TYS-4N植物葉綠素測定儀,北京中科維禾科技發展有限公司。
1.3 樣品制備
1.3.1 種子處理 氮離子注入試驗在河北工業大學生物物理研究所離子注入機室完成。氮離子注入能量為30 keV,注入劑量為1.0×1015、2.0×1015、3.0×1015、4.0×1015、5.0×1015、6.0×1015、7.0×1015、8.0×1015ions·cm-2。以同批次相同數量未經處理的種子作為對照。試驗挑選顆粒飽滿、大小均勻的金蓮花種子,每組3 次重復,每重復500粒。
1.3.2 種子發芽試驗 取經過氮離子注入處理的種子和未經過注入的種子各100粒,3個重復。使用赤霉素(600 mg·L-1)浸泡金蓮花種子24 h 打破種子休眠,后用75%乙醇處理30 s,無菌水沖洗,2%次氯酸鈉消毒20 min,放置于鋪有2 層濕潤濾紙的培養皿中25 °C恒溫培養,每天光照12 h。
1.3.3 幼苗培養 種子萌發后播種于將其移植于含有草炭土的穴盤內,種植于河北工業大學輻照研究基地。每2 d澆水1次,后將其轉移至花盆中,2個月后取葉片,測定各項生理指標。
1.4 測定指標和方法
1.4.1 發芽指標 發芽第4 天開始記錄發芽數量,每天觀察記錄種子的發芽情況,共培養至16 d。發芽結束后計算種子的發芽率。
1.4.2 生理指標的測定 取金蓮花幼苗相同部位葉片鮮樣,用蒸餾水沖洗干凈,吸水紙擦干后用于生理生化指標的測量,SOD、CAT、POD 活性和H2O2含量的測定參照試劑盒說明書;MDA 含量測定采用硫代巴比妥酸法;可溶性蛋白含量測定采用考馬斯亮藍法;葉綠素含量(相對值)測定采用TYS-4N植物葉綠素測定儀。
1.4.3 抗氧化相關基因的表達檢測 采用熒光定量PCR 法檢測離子注入前后金蓮花幼苗葉片基因的表達。采集各處理組的葉片樣品并采用Trizol 法提取總RNA,采用PrimeScriptTM1stStrand cDNA Synthesis Kit試劑盒進行反轉錄合成cDNA。qRT-PCR分析采用TB Green?Premix Ex TaqTMII(Tli RNaseH Plus)試劑盒,每個樣品重復3 次。根據前期測序結果篩選Fe/Mn-SOD1、Cu/Zn-SOD1、CAT3、POD2基因及內參基因肌動蛋白(actin,ACT)的序列[24]合成引物,引物序列如表1 所示。引物由生工生物工程(上海)股份有限公司合成。采用2-ΔΔCt方法計算目的基因的相對表達量[25]。

表1 用于檢測基因表達的引物Table 1 Primers used to detect gene expression
1.5 數據統計與分析
所有數據均來自3 個獨立的重復試驗(n=3)。以平均值±標準偏差的方式表示。采用SPSS對數據的差異性進行單因素方差(analysis of variance,ANOVA)檢驗,采用Origin繪制圖表。
2 結果與分析
2.1 低能氮離子注入對金蓮花發芽率的影響
種子的發芽率是衡量種子活力的主要指標。如圖2所示,低能氮離子注入處理的金蓮花種子的發芽率隨注入劑量的增加呈現“升-降-升-降”的變化趨勢。與對照相比,在注入劑量為2.0×1015、3.0×1015、5.0×1015ions·cm-2時,種子的發芽率均顯著升高(P<0.05),在3.0×1015ions·cm-2時最高,比對照升高了14 個百分點。在劑量為7.0×1015、8.0×1015ions·cm-2時,種子發芽率大幅下降,比對照分別降低了20 和40 個百分點(P<0.05)。結果表明,氮離子注入對金蓮花種子具有刺激作用,在較低劑量時促進了種子的萌發,在較高劑量時抑制了種子的萌發。
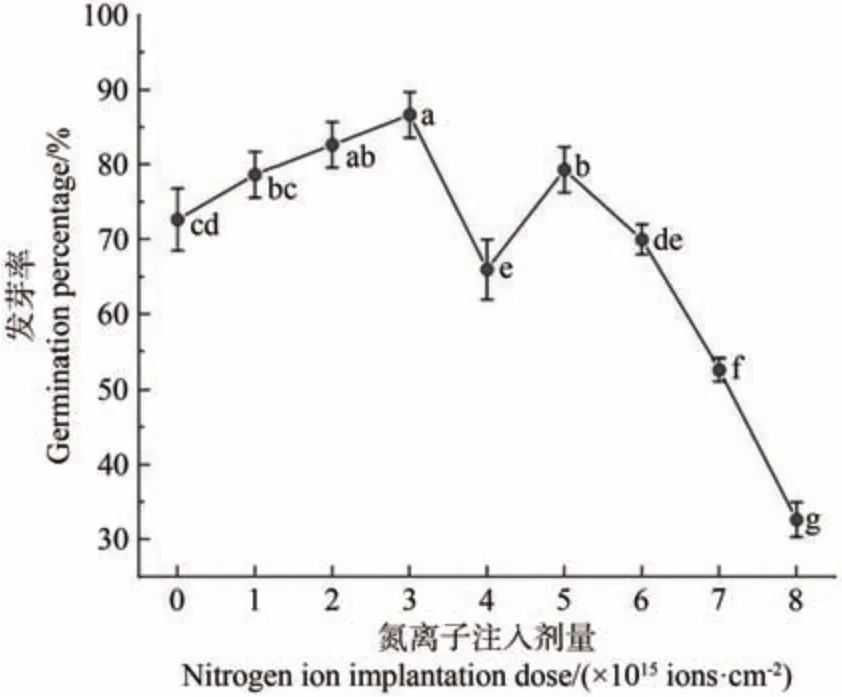
圖2 金蓮花種子發芽率與氮離子注入劑量的關系Fig.2 Relationship between the germination rate of T.chinensis seeds and the dose of nitrogen ion implantation
2.2 低能氮離子注入對金蓮花幼苗葉綠素相對含量(soil and plant analyze development, SPAD)的影響
葉綠素是光合作用的主要色素,是反映光合作用的強弱的重要指標,其含量增加有助于碳水化合物在幼苗體內的累積。由圖3可知,低能氮離子注入處理的金蓮花種子萌發后,其幼苗的葉綠素相對含量隨注入劑量的增加呈現“升-降-升-降”的變化趨勢。在氮離子注入劑量為5.0×1015ions·cm-2時,葉綠素含量最高,比對照顯著升高了28.93%(P<0.05)。當劑量超過5.0×1015ions·cm-2時,幼苗葉綠素含量開始下降,在劑量為8.0×1015ions·cm-2時最低,比對照降低了6.40%(P>0.05)。

圖3 金蓮花幼苗SPAD值與氮離子注入劑量的關系Fig.3 Relationship between the SPAD value of T. chinensis seedlings and the dose of nitrogen ion implantation
2.3 低能氮離子注入對金蓮花幼苗可溶性蛋白的影響
植物體內的可溶性蛋白質大多數是參與各種代謝活動的酶類,是重要的滲透調節物質和營養物質,其含量的增加可提高細胞的保水能力,對細胞的生命物質及生物膜起到保護作用,是篩選抗性的指標之一。由圖4 可知,氮離子注入處理的金蓮花種子萌發后,其幼苗的可溶性蛋白含量隨注入劑量的增加呈現“升-降-升-降”的變化趨勢。與對照相比,在氮離子注入劑量為1.0×1015、2.0×1015、3.0×1015、6.0×1015、7.0×1015ions·cm-2時,幼苗的可溶性蛋白含量均升高,在劑量為3.0×1015ions·cm-2時最高,比對照升高了28.63%(P<0.05)。在注入劑量為4.0×1015、5.0×1015、8.0×1015ions·cm-2時,幼苗的可溶性蛋白含量降低,在劑量為5.0×1015ions·cm-2時最低,比對照降低了9.5%(P<0.05)。

圖4 金蓮花幼苗可溶性蛋白與氮離子注入劑量的關系Fig.4 Relationship between the soluble protein content of T.chinensis seedlings and the dose of nitrogen ion implantation
2.4 低能氮離子注入對金蓮花幼苗MDA 和H2O2含量的影響
MDA 和H2O2通常被認為是氧化應激的主要指標,能夠反映細胞受損傷的程度。
由圖5-A可知,低能氮離子注入處理金蓮花種子萌發后,其幼苗的MDA 含量隨注入劑量的增加呈現“升-降-升-降”的變化趨勢。與對照相比,在氮離子注入劑量為1.0×1015、2.0×1015、5.0×1015、6.0×1015ions·cm-2時,幼苗的MDA含量均升高,在劑量為5×1015ions·cm-2時最高,比對照升高了30.34%(P<0.05)。當注入劑量為3.0×1015、4.0×1015、7.0×1015、8.0×1015ions·cm-2時,幼苗的MDA 含量降低,在劑量為3.0×1015ions·cm-2時最低,比對照降低了2.11%(P>0.05)。

圖5 金蓮花幼苗MDA(A)和 H2O2(B)含量與氮離子注入劑量的關系Fig.5 Relationship between the MDA (A) and H2O2 (B) content of T. chinensis seedlings and the dose of nitrogen ion implantation
由圖5-B 可知,低能氮離子注入金蓮花種子萌發后,其幼苗的H2O2含量隨注入劑量的增加呈“升-降-升-降-升”的變化趨勢。與對照相比,不同劑量氮離子注入后其含量均有不同程度的升高,在劑量為8.0×1015ions·cm-2時最高,比對照升高了162.31%(P<0.05),在劑量為2.0×1015、3.0×1015ions·cm-2時,分別比對照增高了7.47%、6.87%(P>0.05)。
上述結果表明,不同劑量氮離子注入均會導致金蓮花幼苗一定的氧化應激反應。
2.5 低能氮離子注入對金蓮花幼苗抗氧化系統的影響
為探討金蓮花幼苗對氮離子注入誘導的氧化應激的抗氧化反應,研究了3種具有代表性的細胞內抗氧化酶(SOD、CAT、POD)活性隨注入劑量的變化情況。SOD對植物體內超氧陰離子有清除作用;POD與光合作用、呼吸作用及生長素的氧化等有密切關系;CAT可催化H2O2分解成氧和水,并且與植物代謝強度及抗性有關。
由圖6-A可知,低能氮離子注入處理金蓮花種子萌發后,其幼苗的SOD 活性隨劑量的增加呈現“升-降-升-降”的變化趨勢。與對照組相比,在氮離子注入劑量為2.0×1015、3.0×1015ions·cm-2時,幼苗的SOD活性升高,分別比對照升高了56.64%(P<0.05)、21.48%(P<0.05)。在注入劑量為1.0×1015、4.0×1015~8.0×1015ions·cm-2時,幼苗的SOD 活性下降,在劑量為8.0×1015ions·cm-2時最低,比對照降低了45.20%(P<0.05)。

圖6 金蓮花幼苗 SOD(A)、CAT(B)和 POD(C)含量與氮離子注入劑量的關系Fig.6 Relationship between the SOD(A),CAT(B) and POD(C) content of T. chinensis seedlings and the dose of nitrogen ion implantation
金蓮花幼苗的CAT 活性隨氮離子注入劑量增加的變化趨勢與SOD 大致相同。由圖6-B 可知,與對照相比,在注入劑量為1.0×1015~3.0×1015、7.0×1015ions·cm-2時,幼苗的CAT 活性升高,其中在劑量為3.0×1015ions·cm-2時最高,比對照升高了41.35%(P<0.05)。在注入劑量為4.0×1015~6.0×1015、8.0×1015ions·cm-2時,幼苗的CAT活性下降,在劑量為8.0×1015ions·cm-2時最低,比對照降低了34.59%(P<0.05)。
由圖6-C 可知,金蓮花幼苗的POD 活性隨氮離子注入劑量增加呈現“升-降-升”的變化趨勢。與對照相比,在注入劑量為1.0×1015~3.0×1015ions·cm-2時,幼苗的POD 活性升高,分別比對照升高了16.69%(P<0.05)、36.24%(P<0.05)、8.42%(P<0.05)。在注入劑量為4.0×1015~8.0×1015ions·cm-2時,幼苗的POD 活性下降,在劑量為6.0×1015ions·cm-2時最低,比對照降低了21.20%(P<0.05)。
2.6 各生理指標相關性分析
不同劑量氮離子注入金蓮花種子后,所測各生理指標的相關性如表2 所示。注入劑量與金蓮花的發芽率、SOD 和POD 活性呈顯著負相關關系(P<0.05),與H2O2含量呈極顯著負相關關系(P<0.01),與葉綠素、可溶性蛋白、MDA 含量和CAT 活性為負相關關系,但無顯著性。金蓮花種子的發芽率與H2O2呈顯著負相關關系(P<0.05),與SOD 活性呈顯著正相關關系(P<0.05),與葉綠素、可溶性蛋白、MDA、CAT 和POD 呈正相關關系但不顯著。葉綠素含量與丙二醛含量呈顯著正相關關系(P<0.05),與可溶性蛋白、CAT 和POD 呈負相關關系但不顯著,與H2O2和SOD 呈正相關關系但不顯著。可溶性蛋白與MDA 呈負相關關系但不顯著,與H2O2呈顯著負相關關系(P<0.05),與SOD 與CAT 呈顯著(P<0.05)或極顯著(P<0.01)正相關關系,與POD呈正相關關系但不顯著。MDA 與H2O2呈正相關關系但不顯著,與SOD、CAT和POD呈負相關關系但不顯著。SOD 與CAT 和POD 呈極顯著正相關關系(P<0.01)。說明氮離子注入導致的金蓮花一系列生理指標的變化之間存在相互關聯。

表2 生理指標的相關性分析Table 2 Correlation analysis of physiological indexes
2.7 氮離子注入對抗氧化相關基因表達的影響
為了進一步從遺傳方面研究氮離子注入對金蓮花幼苗生長的刺激作用,本研究選取了4 個抗氧化酶系統相關基因Fe/Mn-SOD1、Cu/Zn-SOD1、CAT3和POD2,采用qRT-PCR測定了其在對照和3.0×1015ions·cm-2氮離子注入組的金蓮花幼苗葉片中的表達量,結果如圖7 所示。與對照相比,Fe/Mn-SOD1、Cu/Zn-SOD1和CAT3基因的表達水平均上調,分別提高了175%(P<0.01)、5.11%(P>0.05)和48.86%(P<0.05)。POD2基因的表達水平比對照顯著下調(P<0.05)。

圖7 對照和3.0×1015 ions·cm-2氮離子注入組的金蓮花幼苗中4個抗氧化相關基因的相對表達量Fig.7 Relative expressions of four antioxidation-related genes in T. chinensis seedlings in the control and 3×1015 ions·cm-2 nitrogen ion implantation groups
3 討論
前人研究表明,離子注入微生物、植物細胞及其種子后,其存活率與注入劑量呈現獨特的“馬鞍型”效應曲線[26]。在本研究中,不同劑量(1.0~8.0×1015ions·cm-2)氮離子注入的金蓮花種子發芽率隨注入劑量的增加呈“升-降-升-降”的“馬鞍型”趨勢,這與劉志高等[27]通過不同劑量的鈦離子注入石蒜種子得到的結果基本一致。原因可能是金蓮花具有休眠期,當氮離子注入劑量較低時,對金蓮花種子有一定刺激作用,打破了金蓮花的休眠,因此促進了金蓮花種子的萌發,而劑量較高時造成的損傷較重,抑制了種子的萌發。
葉綠素是植物光合作用的基礎,本試驗通過分析氮離子注入對SPAD 值的影響,結果表明,隨著氮離子注入劑量的增加,金蓮花葉片中SPAD 值呈“升-降-升-降”的趨勢,注入劑量過高時,SPAD 值開始低于對照。這與吳座功等[22]用低能氮離子注入蒙古黃芪種子時得到的研究結果一致。原因可能是氮離子注入后,促進了葉片組織中葉綠素相關物質的合成;注入劑量過高時,生理損傷加重,抑制了葉綠素的合成。
在逆境條件下,植物會主動積累可溶性蛋白,對細胞的生命物質及生物膜起到保護作用[28]。本試驗中可溶性蛋白含量隨著氮離子注入劑量的增加出現“升-降-升-降”的變化趨勢,這與周小云等[29]研究氮離子注入小麥種子新春11 號得到的可溶性蛋白的變化趨勢一致。說明金蓮花幼苗在氮離子注入后可通過積累可溶性蛋白修復氮離子引起的損傷。在注入劑量為3.0×1015ions·cm-2時,可溶性蛋白含量最高,修復能力最強,超過該劑量后可溶性蛋白含量降低,可能是由于氮離子注入打破了金蓮花細胞內的酶系統平衡,導致修復能力逐漸減弱,而在更高劑量時細胞自身又重新建立了酶系統并開始自我修復,使可溶性蛋白含量再升高。
離子注入是一種非生物脅迫,能夠誘導植物產生ROS (例如H2O2),對機體造成傷害。氮離子注入的金蓮花幼苗H2O2含量均大于對照組,與Semsang 等[30]提出的低能氮離子注入導致泰國茉莉水稻幼苗的ROS含量升高的結果相似。植物體通過SOD、POD、CAT 等抗氧化酶緩解ROS傷害。本試驗3種抗氧化酶活性大致呈“升-降-升-降”的變化趨勢,在氮離子注入劑量為1.0×1015~3.0×1015ions·cm-2時,幼苗體內的POD、CAT、SOD 活性基本均高于對照組,這可能是氮離子注入在金蓮花體內產生的ROS 啟動了細胞的修復保護反應,刺激了編碼抗氧化酶的基因應答,從而使抗氧化酶活性提高[31-32]。MDA 含量在氮離子注入后的變化趨勢與3 種酶含量的變化趨勢基本相反,間接地證實氮離子注入對金蓮花的影響以及金蓮花自身所具有的協調修復作用。當氮離子注入劑量繼續增大時,抗氧化酶活性開始下降,可能是離子注入造成細胞傷害嚴重,致使代謝紊亂,酶的合成受阻;在更高劑量時酶活性又出現上升的趨勢,可能是由于細胞重新建立了酶系統,細胞開始自我修復。
本研究發現,氮離子注入會導致金蓮花生理指標的變化,而這種變化并不表現在某一項生理指標上,而是各個指標相互關聯相互影響。由此推測,氮離子注入會對金蓮花造成了一系列損傷,在較低劑量氮離子注入金蓮花時,活性較高的抗氧化酶能有效清除離子注入產生的ROS、維持細胞膜結構的穩定性,同時植物體積累的可溶性蛋白等滲透調節物質對氮離子引起的損傷進行修復,抗氧化酶和滲透調節物質的增加在一定程度上促進了植物體的代謝活動,使葉綠素含量增加,最終促進了植物體生長發育。而隨著注入劑量的增加,金蓮花幼苗中沒有足夠的抗氧化酶和滲透調節物質來消除過量的ROS,從而導致幼苗生長受到抑制。
研究表明,氮離子注入會對植物分子水平造成一定影響。一方面,離子注入使植株體內基因序列、表達發生改變,有研究揭示離子注入會影響植物基因的表達量[33-34]。然而關于金蓮花抗氧化相關基因在氮離子注入下的轉錄反應,目前鮮有研究。植物的SOD 根據金屬輔基可以分為Mn-SOD,Cu/Zn-SOD 和Fe-SOD。研究表明,在應對非生物脅迫時,植物CSD1、CSD2和MSD1基因的表達顯著上調[35],該結論與本試驗的結果類似。本研究選取前期各生理生化指標良好的3.0×1015ions·cm-2氮離子注入金蓮花幼苗與對照組進行比較,發現Cu/Zn-SOD、Fe/Mn-SOD和CAT基因的轉錄水平與對照相比均上調,說明3.0×1015ions·cm-2氮離子注入能夠增加編碼SOD和CAT基因的表達,其中CAT基因的結果與Du等[36]的研究一致。總的來說,抗氧化酶相關基因在緩解相對低劑量氮離子注入誘導的氧化脅迫中起到了關鍵作用,3.0×1015ions·cm-2氮離子注入可以通過增強抗氧化相關基因的表達,提高了抗氧化系統活性,清除了氮離子注入產生的過量ROS,促進了金蓮花幼苗的生長。另一方面,離子注入改變了植物體內甲基化、轉座子和DNA 結構等。龔佳夢等[37]發現快中子、返回式衛星搭載、重離子等不同電離輻射下金蓮花的基因多態性存在明顯差異,說明各種電離輻射可有效引起金蓮花DNA 分子的變異。因此推測氮離子注入金蓮花的過程中發生能量沉積、動量傳遞,刺激DNA 的損傷修復、相關基因的表達和生化代謝網絡的調控,最終引起金蓮花M1代的生物誘變效應。
本試驗結果均來自于金蓮花當代,其有益性狀可以通過組織培養技術保存和擴繁,后續也可以進行多代跟蹤研究,篩選獲得穩定遺傳的有益突變材料。
4 結論
本試驗研究了不同劑量的氮離子注入對金蓮花種子發芽率及幼苗生理生化特性的影響,發現一定劑量氮離子注入能夠促進金蓮花種子的萌發、提高苗期葉綠素和可溶性蛋白含量、促進抗氧化相關基因的表達、增強金蓮花抗氧化系統的活性、有效清除低劑量離子注入幼苗中適量的ROS,從而促進幼苗生長。3.0×1015ions·cm-2可以作為氮離子注入誘變金蓮花的優選劑量。

