穩定同位素技術在甘肅環縣不同鄉鎮肉羊溯源中的應用
郄夢潔 李 政 趙姍姍 陽曉婷 趙 燕
(中國農業科學院農業質量標準與檢測技術研究所農產品質量安全重點實驗室, 北京 100081)
甘肅省慶陽市環縣水質苦咸、礦化程度高、無污染,野生草藥資源豐富,盛產地椒、麻黃等供羊食用的100多種中藥材[1]。環縣草場廣闊,羊只年飼養量70萬只以上,農戶按照“10+1”模式養殖灘羊、小尾寒羊、湖羊;按照“30+2”模式養殖絨山羊和黑山羊[1]。盛產的羊羔肉是環縣傳統地方風味名吃,具有嫩而不膻、瘦而不柴、營養豐富、味道鮮美的特質,素有“朝登黃土地、暮住土窯洞、饑食中藥草、渴飲礦泉水”的美譽[2]。“環縣羊羔肉”是著名的地理標志產品,榮獲全國十佳羊肉品牌第一名和全國綠色農業十佳畜牧地標品牌等殊榮[2-3]。雖然環縣已逐漸形成肉羊產業的規模化、機械化、舍飼化發展,但部分散戶也面臨著飼養管理不規范、不分舍飼養、防疫技術滯后等食品安全問題[1,4]。此外,在巨大的經濟利潤刺激下,不法商人屢次將其他產地低等級的羊肉貼上地理標志羊肉的標簽后投入市場[5]。為了維護消費者權益,實現政府對市場上羊肉的監管,在發生食品安全事故后快速實施產品的召回,以及對“環縣羊羔肉”地理標志品牌進行保護,為“環縣羊羔肉”產品打入國際市場提供技術支持,對環縣肉羊進行溯源研究極為必要。
生物體內的穩定同位素組成受氣候、環境、生物代謝類型等因素的影響,上述因素可導致穩定同位素分餾,從而使不同種類及地域來源的動植物食品中穩定同位素自然豐度存在差異,可作為一種“自然指紋”區分不同來源的動植物食品[5-7]。近年來,采用穩定同位素技術對肉羊進行產地溯源的報道日漸增多[8],例如米瑞芳等[9]從內蒙古、新疆、寧夏、新西蘭和意大利5個地區采集羊肉樣品并利用穩定同位素技術進行產地溯源,判別準確率達100%。然而,目前的肉羊溯源研究的最小范圍僅止步于縣[9-11],更小范圍的產地溯源有待深入探究。此外,以往的研究通常采用羊肉組織對肉羊進行產地溯源研究[12],需要將羊進行宰殺取肉,有采集、攜帶不方便,費時費力,容易變質等缺點,導致試驗誤差大和樣品采集成本高等問題;而毛發組織和血液樣品具有可活體取樣、容易采取、組織性質穩定、容易保存等優點。Sun等[13]測定了我國5個不同地區2 種飼養方式下綿羊肌肉和羊毛中的δ13C、δ15N 和δ2H 值,結果表明,羊肉和羊毛的δ13C、δ15N 和δ2H 組合的判別準確率分別為88.9%和83.8%,且羊肉與羊毛中的3 種穩定同位素比值呈線性相關。由此推測,采用易取的羊毛或羊血樣品進行溯源是一種更為經濟、省時、省力、有效的方法。
目前還沒有對鄉鎮級別的肉羊進行產地溯源的有效技術,不利于地理標志產品“環縣羊羔肉”的品牌保護。本研究對環縣肉羊羊毛和羊血樣品中的碳、氮、氫、氧4 種穩定同位素比值進行檢測分析,研究羊毛和羊血中穩定同位素比值的相關性,并通過對不同鄉鎮羊毛和羊血樣品中的穩定同位素比值進行判別分析,構建鄉鎮級別的肉羊產地溯源模型,以期實現肉羊的活體建檔,以低成本構建肉羊數據庫,從而完成對“環縣羊羔肉”品牌保護的目標。
1 材料與方法
1.1 樣品信息
用于溯源的樣品分別來自于環縣南湫鄉楊國禮農場和新龍輝養殖合作社,甜水鄉宏康養殖農民專業合作社及曲子鎮西溝村豪順養殖專業合作社。所有肉羊均為散欄飼養,均在7 月下旬采樣。每個農場各采集20 只肉羊身上的頸毛樣品和全血樣品,共計160 份羊血和羊毛樣品。采用無添加劑的干燥真空采血管進行血液樣品采集,采樣量約20 mL。在每只羊的頸部貼皮層處剪取約1 cm2的羊頸毛作為羊毛樣品,采樣量約2 g,用密封袋保存。樣品具體信息和采集樣品的具體地理位置分別如表1和圖1所示。
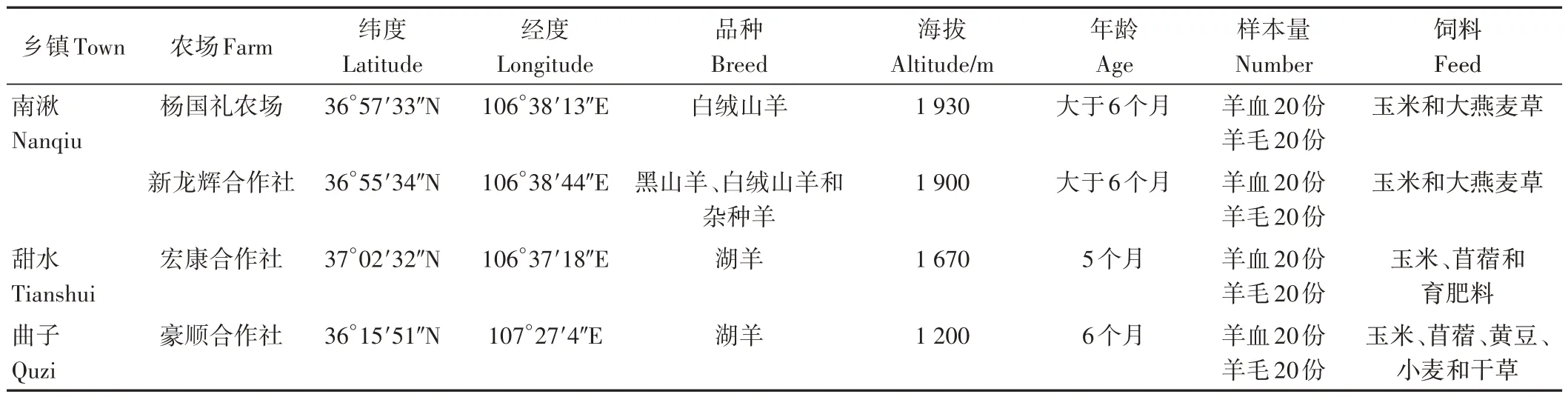
表1 環縣羊血和羊毛樣品地理信息Table 1 Region information of sample for sheep blood and wool in Huan county
1.2 儀器及試劑
Flash 2000-Conflo IV interface-Delta V 元素分析與穩定同位素質譜聯用儀,美國Thermo 公司;WGL-230D 電熱鼓風干燥箱,天津市泰斯特儀器有限公司;SCIENTZ-48高通量組織研磨器,寧波新芝生物科技股份有限公司;H1850臺式高速離心機,湖南湘儀實驗室儀器開發有限公司。
氯仿和甲醇,分析純,北京國藥集團化學試劑有限公司;去離子水,杭州娃哈哈集團有限公司;USGS43、USGS62、USGS42、CBS、KHS 穩定同位素標準物質,美國Geological Survey Reston;IAEA-600 穩定同位素標準物質,奧地利國際原子能機構。
1.3 前處理方法
采集的羊毛樣品用去離子水浸泡清洗后,在60 ℃條件下恒溫干燥12 h。稱量1.00 g清洗后的羊毛樣品置于10 mL 離心管中。按照固液比1∶5 的比例加入5 mL 氯仿/甲醇(v/v=2∶1)混合溶液浸泡2 h 進行脫脂處理。樣品用去離子水清洗后,浸泡30 min,再按照固液比1∶5 的比例加入5 mL 氯仿/甲醇(v/v=2∶1)混合溶液浸泡2 h。用去離子水清洗后,在60 ℃條件下將樣品烘至全干(質量差小于0.02 mg)。脫脂后的羊毛樣品剪成約1 mm備用。
稱量1.00 g 冷凍干燥后的羊血樣品置于10 mL 離心管中。按照固液比1∶5 的比例加入5 mL 氯仿/甲醇(v/v=2∶1)混合溶液進行脫脂處理。隨后將樣品放置在渦旋振蕩器上震蕩10 min。振蕩結束后,樣品在5 000 r·min-1條件下離心5 min。去除上清液,再次按照固液比1∶5 的比例在樣品中加入5 mL 氯仿/甲醇(v/v=2∶1)混合溶液脫脂,再次震蕩離心。如此重復兩次后,將樣品冷凍干燥至全干(質量差小于0.02 mg)。脫脂后的羊血樣品經磨粉過篩后備用。
1.4 δ13C和δ15N的測定
稱量150 μg 干燥脫脂后的樣品用錫杯稱量包裹后投入元素分析與穩定同位素比值質譜聯用儀(elemental analyzer-isotope ratio mass spectrometer,EAIRMS)進行碳氮同位素比值分析。樣品通過自動進樣器進入元素分析儀,元素分析儀的裂解管溫度為960 ℃,樣品中的C和N被裂解爐中的玻璃化碳還原為CO2和N2,全過程在線自動進行。CO2和N2通過氣相進行分離,色譜柱溫為50 ℃。CO2和N2分別經由ConFlo IV 裝置進入EA-IRMS,測定C 和N 同位素的比值。載氣氦氣的流速為100 mL·min-1。選用USGS43(δ13C=-21.28‰,δ15N=8.44‰),USGS62(δ13C=-14.79‰,δ15N=20.17‰)和IAEA-600(δ13C=-27.77‰,δ15N=1.00‰)作為校正δ13C 和δ15N 的標準樣品。δ13C 和δ15N 的分析精度均為±0.15‰。
1.5 δ2H和δ18O的測定
稱量250 μg 干燥脫脂后的樣品用銀杯包裹后投入EA-IRMS 進行氫氧同位素比值分析。樣品通過自動進樣器進入元素分析儀,元素分析儀的裂解管溫度為1 420 ℃,樣品中的H 和O被裂解爐中的玻璃化碳還原為H2和CO,全過程在線自動進行。H2和CO 通過氣相進行分離,色譜柱溫為80 ℃,H2和CO 分別經由ConFlo IV 裝置進入IRMS,測定H 和O 同位素的比值。載氣氦氣的流速為100 mL·min-1。選用CBS(δ2H=- 197‰,δ18O=3.8‰)、KHS(δ2H= -51.4‰,δ18O=20.3‰)和USGS42(δ2H=-78.5‰,δ18O=8.56‰)作為校正δ2H 和δ18O 的標準樣品。δ2H 的分析精度為±3‰。δ18O的分析精度為±0.4‰。
1.6 數據分析
采用SPSS 22.0 軟件對數據進行單因素方差分析(Duncan 多重比較)及線性判別分析(linear discriminant models,LDA)。采用SIMCA 14.1 軟件對不同農場的羊毛和羊血樣品進行主成分分析(principal components analysis,PCA)及正交偏最小二乘判別分析(orthogonal partial least squares discriminant analysis,OPLS-DA)。采用Excel 2016 軟件對羊毛和羊血樣品的穩定同位素比值進行相關性分析。
2 結果與分析
2.1 肉羊羊毛和羊血穩定同位素組成特征
如表2 所示,3 個鄉鎮羊毛樣品的δ13C 和δ2H 均值大于羊血樣品的δ13C和δ2H均值,而羊血樣品的δ15N和δ18O 均值大于羊毛樣品δ15N 和δ18O 均值。3 個鄉鎮羊毛樣品中δ13C、δ15N、δ2H和δ18O的均值分別為-16.90‰、3.94‰、-89.19‰和12.50‰。所有羊血樣品中δ13C、δ15N、δ2H 和δ18O 的均值分別為-19.39‰、4.08‰、-112.41‰和12.87‰。
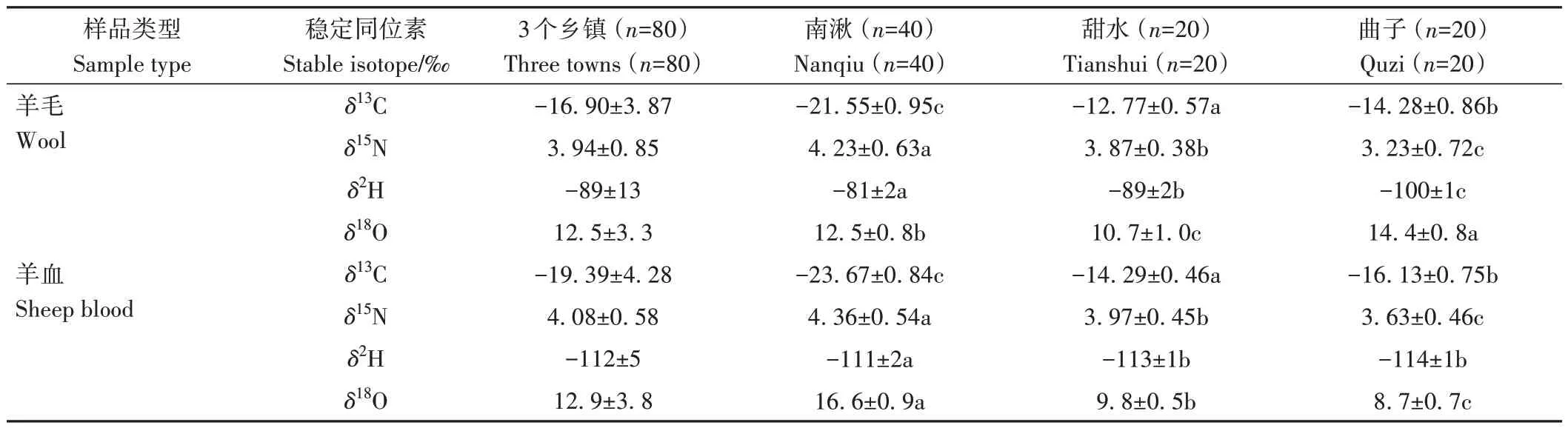
表2 3個鄉鎮羊血和羊毛中δ13C、δ15N、δ2H和δ18O值Table 2 The values of δ13C, δ15N, δ2H and δ18O for sheep blood and wool in three towns
各鄉鎮羊血和羊毛樣品的的δ13C、δ15N、δ2H 和δ18O整體均具有顯著差異。羊毛和羊血中δ13C值從大到小的鄉鎮順序均依次為甜水>曲子>南湫。南湫羊毛的δ13C 值明顯低于其他鄉鎮羊毛的δ13C 值。羊毛和羊血中δ15N值從大到小的鄉鎮順序均依次為南湫>甜水>曲子。羊毛和羊血中δ2H 值從大到小的鄉鎮順序均依次為南湫>甜水>曲子。此外,南湫鄉肉羊羊血中δ18O 值大于羊毛中δ18O 值,而甜水和曲子肉羊羊毛中δ18O 值均大于羊血中δ18O 值。羊毛中δ18O 值從大到小的鄉鎮順序依次為曲子>南湫>甜水。羊血中δ18O值從大到小的鄉鎮順序依次為南湫>甜水>曲子。曲子肉羊羊毛的δ18O值明顯高于其他鄉鎮羊毛的δ18O值。
2.2 羊毛和羊血中穩定同位素比值的相關性
羊毛和羊血的相關性分析結果表明(圖2),羊毛和羊血中δ13C 值呈顯著線性正相關,相關系數為0.813,其相關系數檢驗的概率P值近似為0.000,說明羊血和羊毛組織δ13C 分餾速率較為一致。而羊毛和羊血中δ15N、δ2H 和δ18O的相關性較弱,相關系數分別為0.369、0.080 和0.000,其相關系數檢驗的概率P值均近似為0.000,表明二者的氮氫氧穩定同位素分餾速率差異較大。
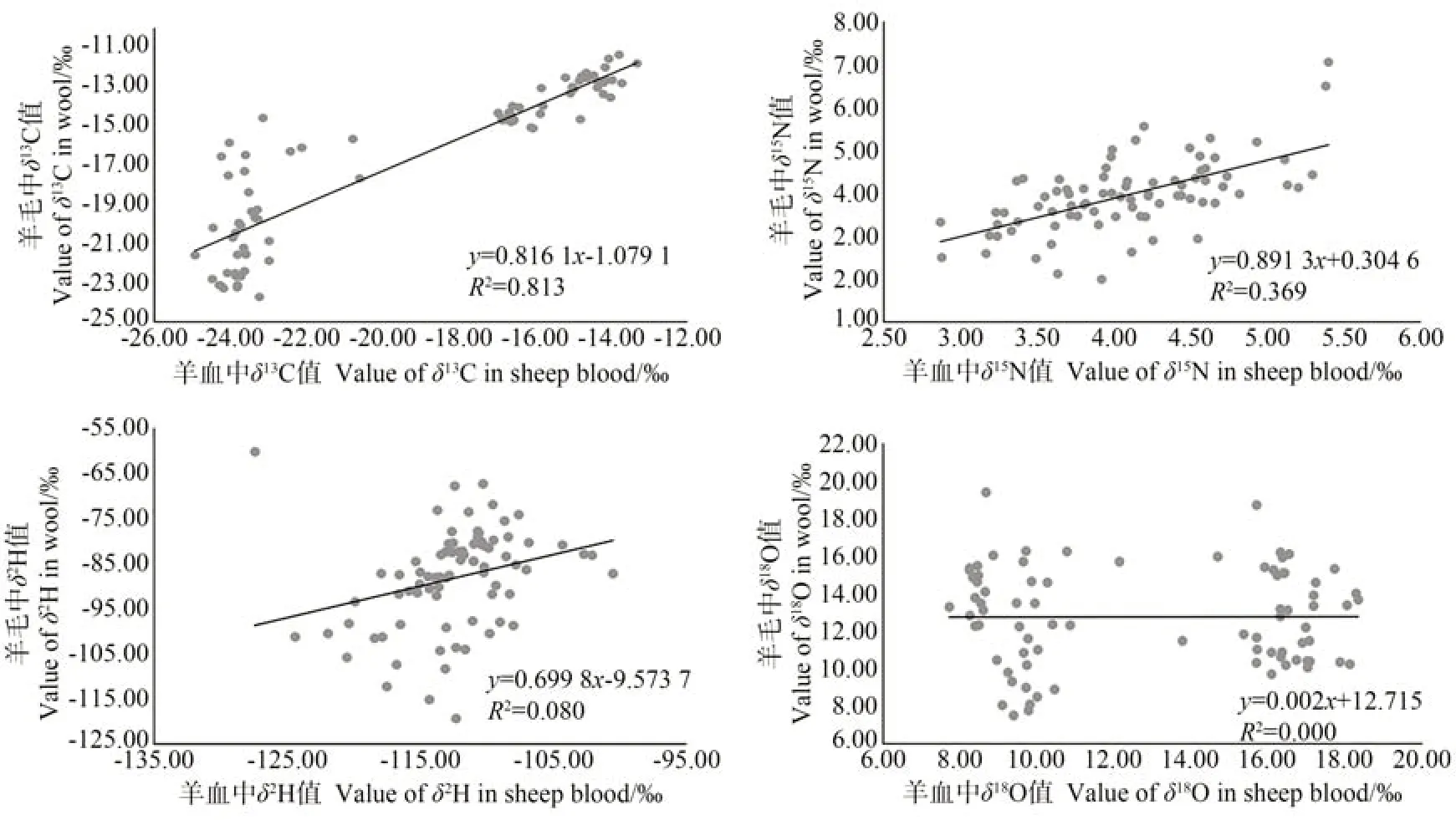
圖2 3個鄉鎮羊毛和羊血樣品的相關性分析Fig.2 Correlation analysis for sheep blood and wool in three towns
2.3 穩定同位素比值對肉羊產地的判別分析
分別對3 個鄉鎮羊毛和羊血進行PCA 和OPLSDA 分析,結果如圖3 所示。PCA 結果表明,南湫、甜水和曲子的羊毛樣品被明顯區分開,而甜水和曲子的羊血樣品未被區分開。OPLS-DA 結果表明,無論是羊毛樣品還是羊血樣品,南湫、甜水和曲子3個鄉鎮的樣品均被完全區分開。有監督的OPLS-DA 分析結果明顯優于無監督的PCA分析結果。
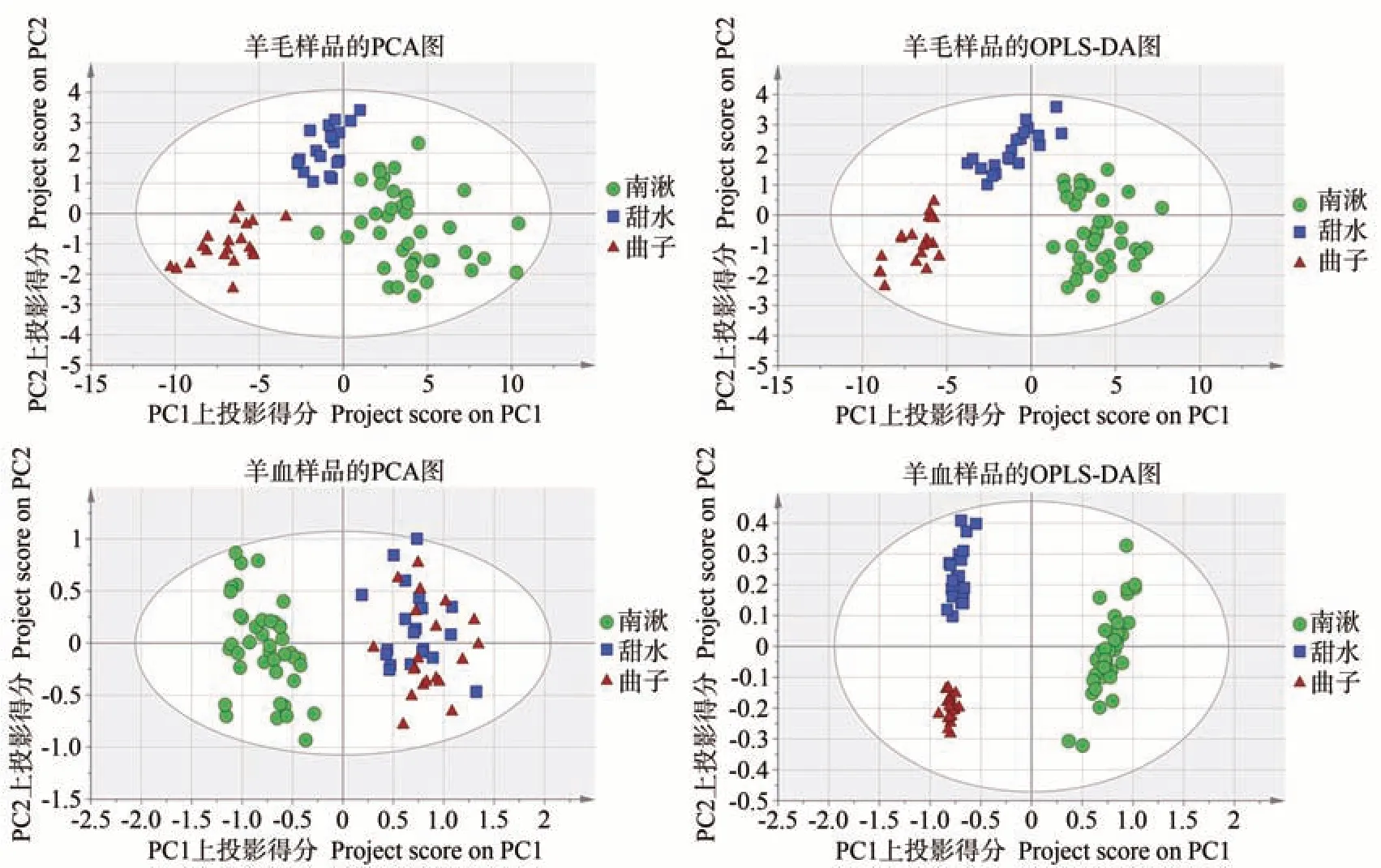
圖3 3個鄉鎮羊毛和血液的PCA和OPLS-DA圖Fig.3 The PCA plot and OPLS-DA plot for sheep blood and wool in three towns
通過3 個鄉鎮羊毛和羊血樣品中不同穩定同位素組合的線性判別分析結果可知(表3),不論是羊毛還是羊血樣品,4 種穩定同位素組合的線性判別準確率最高:3 個鄉鎮的羊毛原始判別準確率為95.0%,交叉驗證判別準確率為91.3%,其線性判別模型得分圖如圖4所示;3個鄉鎮的羊血原始判別準確率和交叉驗證判別準確率均為97.5%。因此,羊血對環縣肉羊溯源的準確度優于羊毛。此外,羊毛的碳氮穩定同位素組合原始判別準確率和交叉驗證判別準確率高達92.5%,而羊血不論是碳氮穩定同位素組合還是氫氧穩定同位素組合的判別準確率均高于90.0%。
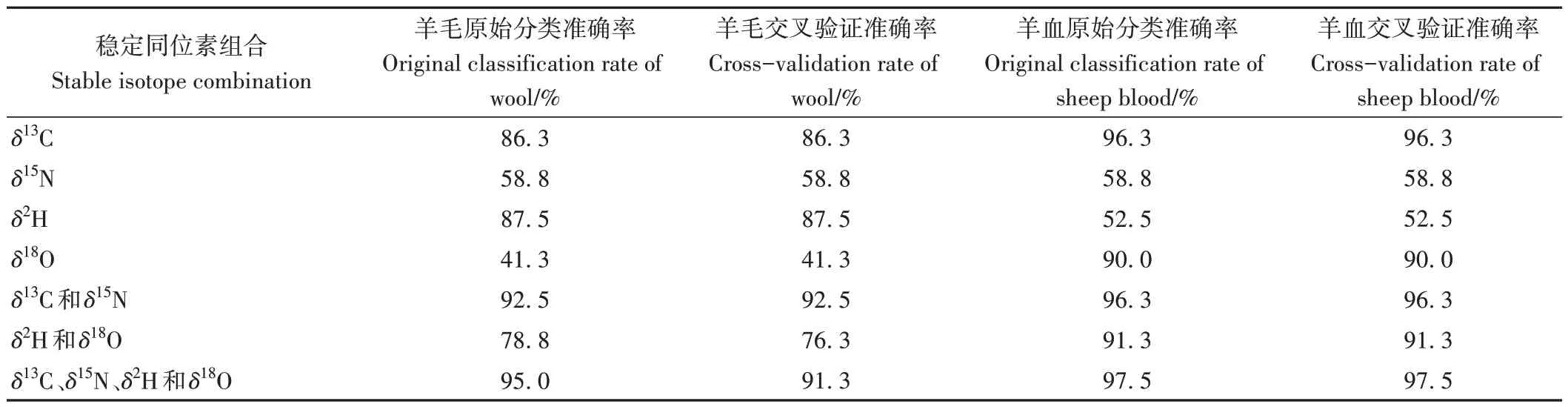
表3 3個鄉鎮羊毛和羊血樣品中不同穩定同位素組合的線性判別分析結果Table 3 The results of LDA for different stable isotope combinations in sheep blood and wool samples from three towns
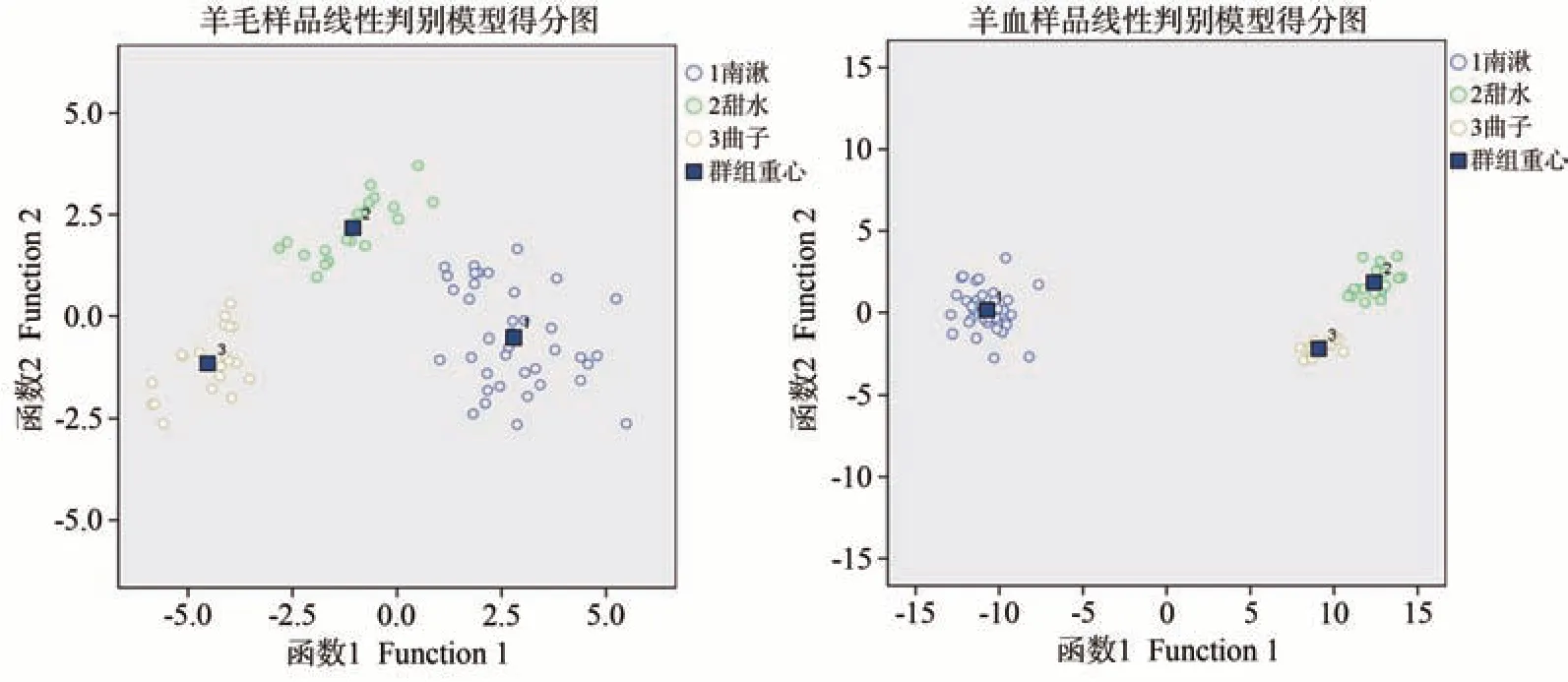
圖4 以δ13C、δ15N、δ2H和δ18O為組合的3個鄉鎮羊毛和羊血線性判別模型得分圖Fig.4 Score chart of linear discriminant model of sheep blood and wool in three towns based on four isotopic values of δ13C,δ15N, δ2H and δ18O
3 討論
3.1 肉羊中穩定同位素比值的影響因素
動物體δ13C值與飼料中C3和C4植物的比例密切相關[14-15]。C3植物的δ13C 值(-32‰~-21‰)低于C4植物(-19‰~-12‰)[9]。動物組織δ13C 值越高,表明其飲食中含有C4植物的比例越高[12,16]。3 個鄉鎮羊血和羊毛樣品中δ13C 值均具有顯著差異。羊毛和羊血樣品中δ13C值從大到小的順序均依次為甜水>曲子>南湫。南湫肉羊的飼料為玉米和大燕麥草;甜水肉羊的飼料為玉米、苜蓿和育肥料;曲子肉羊的飼料為玉米、苜蓿、黃豆、小麥和干草(表1)。除了玉米為C4植物,其他均為C3植物。由此可知,甜水肉羊飼料中玉米所占比例最高,而南湫肉羊飼料中玉米所占比例最低。此外,動物體內的δ13C值在生物體內的積累與變化除與飼料相關外,還與其品種相關。南湫肉羊主要品種為山羊,而甜水和曲子肉羊為湖羊,即品種為綿羊。如表2 所示,山羊δ13C值明顯低于綿羊。王倩[17]研究發現在飼料相同的情況下,阿拉善左旗的山羊中δ13C 值明顯低于阿拉善右旗和額濟納旗的綿羊中δ13C 值,這與本研究結果相同。推測其原因可能是不同品種肉羊的生活習性和代謝機制不同,從而導致其體內穩定同位素的分餾差異。
各鄉鎮羊血和羊毛樣品中δ15N 值均具有顯著差異。羊毛和羊血樣品中δ15N值從大到小均依次為南湫>甜水>曲子。前人研究表明,施用化肥種植出的飼料δ15N值較低[18]。動物食用施用化肥種植的植物飼料導致動物組織中δ15N 值也相應降低。除玉米外,南湫和甜水肉羊主要以野生大燕麥草和苜蓿為食。而曲子肉羊飼料中還包括施用化肥種植出的黃豆和小麥。此外,攝入可以直接利用大氣固氮的豆科植物會導致動物體δ15N 值降低[8,11]。甜水和曲子肉羊飼料中有豆科植物,如苜蓿和黃豆。因此,南湫樣品δ15N 值最高,而曲子樣品δ15N值最低。
動物體δ2H 值和δ18O 值會受到地域環境的海拔、緯度、溫度、氣候、地形和季節等多種地理參數的綜合影響[5,19]。在地域環境變化明顯的情況下,動物體中的δ2H 值和δ18O 值呈現隨緯度升高和海拔增加而降低的變化規律[9,20]。而本研究中羊毛樣品δ18O 值從大到小依次為曲子>南湫>甜水;羊毛樣品δ2H值與羊血樣品δ2H 值和δ18O 值從大到小的順序為南湫>甜水>曲水,結果與海拔和緯度無相關性。大氣水隨全球系統性循環,經過蒸發、冷凝和結晶等步驟最終沉降成為地下水,地下水中的δ2H和δ18O通過飲用水和飼料轉移到動物組織中[21]。因此,動物體中的δ2H值和δ18O值反映了地下水中的δ2H 值和δ18O 值,與地理位置相關[22]。曲子羊毛樣品的δ2H 值遠小于南湫和甜水羊毛樣品的δ2H值。甜水與南湫僅相距9.1 km,而甜水與曲子相距114.2 km,說明兩地距離越大,羊毛樣品的δ2H 值相差越大。但有關不同鄉鎮的地下水中δ2H、δ18O 值和動物體中δ2H、δ18O 值的相關性至今未有報道,還需進一步研究。
3.2 肉羊不同組織的穩定同位素分餾效應
以往肉羊產地溯源多采用羊肉進行溯源研究[23],但羊肉樣品具有采集、攜帶不方便,容易變質、誤差大和成本高等問題。采用血液和毛發部位進行肉羊溯源研究除具有組織性質穩定、容易保存的特點,還具有不用宰殺取樣即可為肉羊建立檔案的優點。此外,血液樣品和毛發樣品也是非常好的溯源樣品。劉澤鑫等[24]對陜西關中不同區縣來源的牛尾毛樣品的δ13C和δ15N 值進行檢測,結果表明陜西關中不同地區肉牛組織中同位素組成存在差異,可利用牛尾毛對區縣內小范圍肉牛進行溯源。但本研究采用羊血和羊毛進行的是同一個縣內不同鄉鎮的產地溯源研究,3 個鄉鎮的羊毛原始判別準確率為95.0%,交叉驗證判別準確率為91.3%;3 個鄉鎮的羊血原始判別準確率和交叉驗證判別準確率均為97.5%,結果也非常理想。
動物不同組織中穩定同位素組成隨飲食的改變而變化,且穩定同位素分餾作用會導致動物不同組織中的同位素比值存在較大差異[25-26]。組織之間的同位素差異可以反映組織的化學成分和周轉率的變化[23,27]。動物糞便或胃內容物的分析應提供有關動物即時飲食的信息[28];血液能反映動物幾個小時內到幾天的短期穩定同位素變化的情況[25,29];脂肪、肝臟、肌肉和毛發反映幾星期到幾個月的較長期飲食信息[29];相比其他組織,骨膠原所反映的飲食信息時間更長[25]。可根據不同的溯源需求選擇合適的采樣組織。因此,羊毛樣品主要反映肉羊較長期幾個月的飼料中穩定同位素組成信息,而血液樣品可以反映肉羊較短期幾天內飼料和飲水中穩定同位素組成信息。這便是羊毛和羊血中δ13C值呈顯著線性正相關,而δ15N、δ2H和δ18O值相關性較弱的原因。
3.3 穩定同位素在肉羊產地來源判別中的應用
不論是PCA分析還是OPLS-DA分析,南湫樣品均與其他兩鄉鎮的樣品完全分離。南湫樣品為大于6 個月的成年山羊,而曲子和甜水樣品為5個月和6個月的幼年綿羊。兩種羊被投喂的飼料不同,體內代謝不同,進而導致同位素分餾機制不同[17]。羊血PCA 分析結果表明,曲子和甜水樣品有部分混合的現象。曲子和甜水樣品雖均為湖羊,但兩地的羊被投喂的飼料不同,地理位置不同。因此羊血和羊毛的OPLS-DA 分析圖表明兩地的樣品被全部區分開。
不論是羊毛還是羊血樣品,4種穩定同位素組合的線性判別準確率最高,3個鄉鎮的羊毛原始判別準確率為95.0%,交叉驗證判別準確率為91.3%;羊血原始判別準確率和交叉驗證判別準確率均為97.5%。以δ13C、δ15N、δ2H 和δ18O 為組合的3 個鄉鎮羊毛和羊血線性判別模型得分圖表明,3 個鄉鎮的羊毛和羊血樣品均被明顯分開(圖4)。如圖1 所示,甜水與曲子相距114.2 km,而南湫與甜水僅相距9.1 km。如此小區域內的肉羊溯源,判別準確率均大于90.0%,充分表明4種穩定同位素比值在肉羊溯源領域的準確性與有效性。此外,除全部4種穩定同位素組合外,羊血和羊毛樣品線性判別最有效的穩定同位素組合為δ13C 和δ15N,這主要是由3 個鄉鎮肉羊的年齡、品種和飼料組成不同所致。而羊血樣品的δ2H 和δ18O 組合線性判別準確率也能達到91.3%。血液中主要成分是水,即羊血的δ2H 和δ18O 值主要與肉羊的飲水相關。這一結果表明,在同一區域肉羊年齡、品種和飼料組成一致的情況下,根據δ2H 和δ18O 值的差異足以區分不同小區域的肉羊。
4 結論
本研究采用穩定同位素技術結合化學計量學方法對環縣南湫鄉、甜水鄉和曲子鎮的肉羊進行產地溯源,結果表明,3 個鄉鎮的肉羊羊毛和羊血樣品中δ13C、δ15N、δ2H 和δ18O 整體均存在顯著性差異,且羊毛和羊血中的穩定同位素分餾速率差異較大。羊毛的4 種穩定同位素比值原始判別準確率為95.0%,交叉驗證判別準確率為91.3%;羊血的4 種穩定同位素比值原始判別準確率和交叉驗證判別準確率均為97.5%。本研究首次基于穩定同位素技術對鄉鎮級別(最小距離為9.1 km)的肉羊進行產地溯源,實現了肉羊的活體建檔及低成本構建肉羊數據庫,不僅為環縣肉羊鄉鎮級別的小產地溯源研究提供了基礎數據支持,也為其他食品小產地溯源研究提供了新思路。

